Acteoside Inhibits Epithelial Mesenchymal Transformation of Hepatoma Cells Through Regulation of ERK1/2 Signaling Pathway
-
摘要:目的
探讨阿克替苷(ACT)通过调控ERK1/2通路抑制人肝癌HCCLM3细胞上皮间质转化(EMT)的作用及其机制。
方法CCK-8法检测肝癌细胞的增殖能力;划痕实验和Transwell实验检测肝癌细胞侵袭及迁移能力;实时定量PCR和蛋白质印迹实验检测ACT对ERK1/2信号通路和上皮间质转化相关基因(E-cadherin、N-cadherin)mRNA和蛋白的表达。
结果CCK-8法检测结果显示,ACT可降低肝癌HCCLM3细胞的活性,抑制肝癌细胞的增殖能力,并与药物浓度和时间有一定的相关性。划痕实验和Transwell实验结果显示,ACT能抑制肝癌HCCLM3细胞迁移和侵袭能力,并呈浓度依赖性。荧光定量PCR和蛋白质印迹实验表明,ACT可下调ERK1/2信号通路相关基因mRNA和蛋白的表达,上调EMT相关基因E-cadherin mRNA和蛋白的表达,下调N-cadherin mRNA和蛋白的表达。
结论ACT可抑制人肝癌HCCLM3细胞EMT、侵袭及迁移,其作用机制与下调ERK1/2信号通路密切相关。
Abstract:ObjectiveTo investigate the effect and mechanism of acteoside (ACT) in inhibiting epithelial-mesenchymal transition (EMT) in human hepatoma HCCLM3 cells by regulating the ERK1/2 pathway.
MethodsCCK-8 assay was used to detect the effect of hepatocellular carcinoma cell proliferation. The invasion and migration of HCC cells were detected by scratch and Transwell tests. The mRNA and protein expression levels of the ERK1/2 signaling pathway and EMT-related genes (E-cadherin and N-cadherin) were detected by real-time PCR and Western blot analyses.
ResultsACT reduced the activity of HCCLM3 cells and inhibited the proliferation of HCC cells, and the effects had certain correlation with drug concentration and time. ACT inhibited the migration and invasion process of HCCLM3 cells in a concentration-dependent manner. ACT downregulated the mRNA and protein expression of genes related to the ERK1/2 signaling pathway. It increased the mRNA and protein expression levels of the EMT-related gene E-cadherin but decreased those of N-cadherin.
ConclusionACT could inhibit EMT and the invasion and migration of HCCLM3 cells in human hepatoma, and the underlying mechanism is closely related to the downregulation of the ERK1/2 signaling pathway.
-
Key words:
- Acteoside /
- HCCLM3 cells /
- ERK1/2 signaling pathway /
- Epithelial mesenchymal transformation /
- Invasion /
- Migration
-
0 引言
肝细胞癌(hepatocellular carcinoma, HCC)是全球危害人类健康常见的恶性肿瘤之一。由于肿瘤复杂的发病机制和异质性,就诊时多数已发生肝内外转移,预后较差。阿克替苷(acteoside, ACT),是一种水溶性的苯丙素苷类化合物,具有抗氧化[1]、抗炎[2]、抗菌[3]、抗动脉粥样硬化[4]、抗肿瘤[5]等多种药理活性。ACT在肝癌细胞中的具体作用和机制尚无更深入的研究。
上皮间质转化(epithelial-mesenchymal transitions, EMT)作为恶性肿瘤侵袭和转移的第一步,是一个动态、可逆的过程,而抑制EMT发生可作为抑制肿瘤侵袭及转移的一种重要手段。恶性肿瘤的发生和发展与细胞信号转导通路的异常调控有关[6]。细胞外信号调节激酶1/2(extracellular signal regulated kinase1/2, ERK1/2)作为MAPK信号通路的亚通路在肝癌细胞的EMT、侵袭及迁移过程中发挥重要作用[7]。目前尚未见有关ACT通过ERK1/2信号通路影响肝癌细胞EMT的具体作用和机制的研究报道。因此,本实验拟初步探讨ERK1/2信号通路在肝癌细胞中的表达,并通过细胞学实验探讨中草药化合物ACT与肝癌生物学机制的相关性,为ACT治疗肝癌提供实验依据和理论基础。
1 材料与方法
1.1 细胞株和试剂
人肝癌HCCLM3细胞(中国上海科学院上海细胞库);ACT(南京景竹生物科技有限公司);高糖DMEM培养基、0.25%胰蛋白、CCK-8试剂(均购自美国Gibco公司);胎牛血清(美国沃卡威生物技术有限公司);PBS(美国Labconco公司);无血清冻存液(英国Whatman公司);0.1%结晶紫(北京索莱宝生物科技有限公司);ERK1/2抑制剂PD98059、SteadyPure通用型RNA提取试剂盒、Evo M-MLV反转录试剂预混液、SYBR Green Premix Pro Taq HS qPCR Kit(均购自美国MedChemExpress公司);5×蛋白上样缓冲液、RIPA强裂解液、PMSF裂解液、10% SDS、Tris-HCL缓冲液、PAGE胶凝固剂、促凝剂、BCA蛋白浓度测定试剂盒和ECL Plus化学发光显色液(均购自北京Solarbio科技有限公司);E-cadherin抗体(ab231303)、N-cadherin抗体(ab76011)(均购自英国Abcam公司);ERK1/2抗体(AF0155)、p-ERK1/2抗体(AF1015)、Beta actin抗体(AF7018)、辣根酶标记酶山羊抗兔IgG(S0001)(均购自美国Affinity公司)。
1.2 方法
1.2.1 细胞培养
肝癌HCCLM3细胞用含10%胎牛血清、青霉素和链霉素双抗(1×105u/L)的高糖DMEM培养液,常规复苏细胞后,置于37℃、5% CO2细胞培养箱中培养,待细胞生长至80%~90%时,用0.25%胰蛋白酶消化,进行细胞换液、传代、冻存或用于后续实验。
1.2.2 CCK-8法检测细胞的增殖
按药物浓度设置5组(0、40、80、120、160 µmol/L),取对数生长期的肝癌HCCLM3细胞,各组按5×103个细胞/孔接种于3个96孔板,每组设置5个复孔,细胞培养板置于培养箱中培养24 h。待细胞贴壁后,加入上述不同浓度的ACT药物,分别继续培养24、48、72 h后,每孔加入10 µl CCK-8溶液培养30 min,酶标仪检测450 nm波长处各孔吸光度(OD)值,分析细胞的增殖能力,根据OD值计算细胞抑制率,并筛选出最佳抑制浓度和时间。
细胞抑制率=(对照组OD值-实验组OD值)/(对照组OD值-空白组OD值)×100%。
1.2.3 划痕实验检测细胞的运动能力
在铺板前用Marker笔在6孔板背面均匀划横线,每孔3~5条。将肝癌HCCLM3细胞按5×105个/孔接种于培养板中,每组设置3个复孔,置于37℃、5%CO2恒温培养箱中,待75%~85%细胞贴壁后用10 µl枪头垂直划痕。磷酸盐缓冲溶液PBS洗细胞3次,加入不同浓度ACT。分别在0、12、24 h后每孔选取5个视野在显微镜下拍照记录。
1.2.4 Transwell实验检测肝癌细胞侵袭及迁移实验
在4℃条件下将基质胶按1:8稀释,吸取60 µl包被Transwell小室上室面,置于培养箱使基质胶聚合成凝胶。取对数生长期的细胞,细胞贴壁后加入不同浓度的ACT处理24 h。制备细胞悬液,用无血清培养基重悬细胞。计数并调整细胞密度为(1×104~1×105)个/毫升。吸取200 µl细胞悬液加入小室。24孔板下室加入600 µl含20%血清的培养基,培养24 h。取出小室,放入烧杯中PBS洗2遍,95%乙醇固定30 min。用0.1%结晶紫染色30 min,PBS清洗3遍。放置在显微镜下观察,分别选取五个视野,用Image J软件计数穿过小室的肝癌细胞数。迁移实验在小室底部膜的上室不铺胶,其余步骤同侵袭实验。实验重复3次。
1.2.5 实时定量PCR检测ACT对ERK1/2信号通路和EMT相关基因mRNA的表达
不同浓度的ACT处理细胞24 h,按照SteadyPure通用型RNA提取试剂盒说明书进行操作,分别提取细胞的总RNA,荧光定量PCR仪检测ERK1/2信号通路和EMT相关基因在mRNA水平的表达量。ERK1基因上游引物序列为5'-TCAACACCACCTGCGACCT-3',下游为5'-CGTAGCCACCTGCGACCT-3';ERK2基因上游引物为5'-TGGAGCAGTATTACGACCCG-3',下游为5'-TTGAGCTTTTCCTTAGGCAAGT-3';E-cadherin基因上游引物为5'-GCCCCGCCTTATGATTCTC-3';下游为5'-GCCCCATTCGTTCAAGTAGTC-3';N-cadherin上游基因引物为5'-ACCAGGTTTGGAATGGGACA-3',下游为5'-TTGGGTGAAGGGGTGCTTG-3';GAPDH基因上游引物为5'-TGTGTCCGTCGTGGATCTGA-3',下游为5'-TTGCTGTTGAAGTCGCAGAG-3'。反转录条件为37℃ 15 min,85℃ 5 s,4℃。PCR扩增反应采用Real-time PCR试剂盒SYBR Green Premix Pro Taq HS qPCR Kit进行,反应条件为95℃预变性30 s,95℃ 5 s,60℃ 30 s进行40个循坏,所有信息由荧光定量PCR仪收集。2-ΔΔct法分析实验数据。
1.2.6 蛋白质印迹实验检测ACT对ERK1/2信号通路和EMT相关蛋白的表达
取对数生长期的肝癌细胞,加入无血清培养基饥饿细胞24 h,加入不同浓度ACT处理24 h,按细胞裂解液说明书提取细胞蛋白。按照BCA试剂盒说明书,检测各组蛋白浓度。蛋白上样每孔取20 µg蛋白。蛋白电泳条件是上胶80 V,30 min,分离胶120 V,1.5 h,电泳后用1×TBST清洗3次、每次8 min后进行转膜,转膜条件是2300 MA、转膜2 h。转膜后用含5%脱脂奶粉封闭2 h,封闭完成后分别添加一抗anti-ERK1/2(1:1 000)、anti-p-ERK1/2(1:2 000)、anti-E-cadherin(1:1 000)、anti-N-cadherin(1:10 000)、anti-Beta actin(1:1 0000),4℃孵育过夜,1×TBST缓冲液洗膜3次,添加二抗IgG(1:5 000)室温孵育1 h,洗膜,ECL化学发光液曝光,拍照记录,使用Image J软件计算条带灰度值,并分析结果。
1.3 统计学方法
采用SPSS25.0和GraphPad Prism 8.0软件进行数据统计分析。计量资料用均数±标准差(x±s)表示;多组之间比较用单因素方差分析,两组间比较用t检验分析;P < 0.05为差异有统计学意义。
2 结果
2.1 ACT对肝癌细胞增殖的影响
随着ACT药物浓度和作用时间的增加,可明显抑制肝癌HCCLM3细胞的增殖。当ACT浓度在160 µmol/L且作用时间为24 h时,其对人肝癌HCCLM3细胞的抑制作用最明显,并计算IC50约为102 µmol/L,见表 1。因此,依据上述实验结果,我们拟选择ACT低浓度80 µmol/L和高浓度120 µmol/L、且作用时间为24 h进行后续实验。
表 1 ACT对HCCLM3肝癌细胞增殖抑制率的影响(%)Table 1 Effect of ACT on proliferation inhibition rate of hepatocellular carcinoma HCCLM3 cells (%)
2.2 ACT对肝癌细胞迁移能力的影响
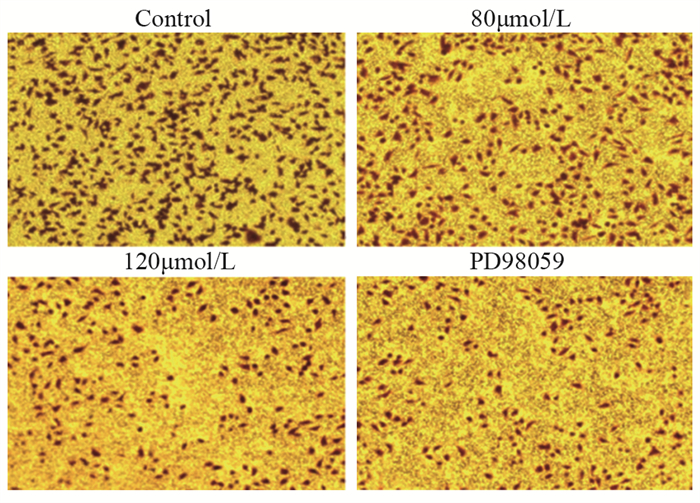
将实验分为4组,即对照组(0 µmol/L)、ACT浓度80 µmol/L组、ACT浓度120 µmol/L组、阳性对照组(PD98059抑制剂组)。划痕实验结果显示,四组肝癌HCCLM3细胞作用0、12、24 h后,与对照组相比,随着ACT药物浓度增加细胞迁移能力明显降低;与PD98059抑制剂组相比,ACT浓度80 µmol/L和120 µmol/L组细胞迁移能力差异无统计学意义(P > 0.05),见图 1、表 2。Transwell迁移实验表明,4组肝癌细胞作用24 h后,80 µmol/L和120 µmol/L ACT组细胞的迁移数与对照组相比,差异有统计学意义(P < 0.001),PD98059抑制剂组与120 µmol/L组相比,差异无统计学意义(P > 0.05),见图 2、表 2。
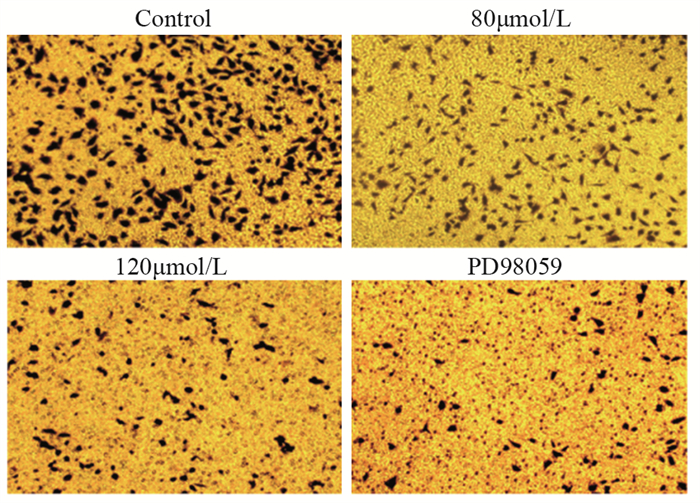
表 2 各组肝癌HCCLM3细胞迁移和侵袭数目比较(n=6, x±s)Table 2 Comparison of migration and invasion number of hepatocellular carcinoma HCCLM3 cells among the groups (n=6, x±s)
2.3 ACT对肝癌细胞侵袭能力的影响
Transwell侵袭实验表明,作用24 h后,与对照组相比,ACT 80 µmol/L组侵袭细胞数差异有统计学意义(P < 0.05);PD98059抑制剂组与120 µmol/L组相比,差异无统计学意义(P > 0.05),见图 3和表 2。这表明ACT能抑制肝癌HCCLM3细胞的侵袭能力,并随药物浓度增加其能力越弱。
2.4 ACT通过ERK1/2信号通路对肝癌细胞EMT相关基因mRNA的影响
2.4.1 ACT对ERK1/2信号通路基因mRNA的影响
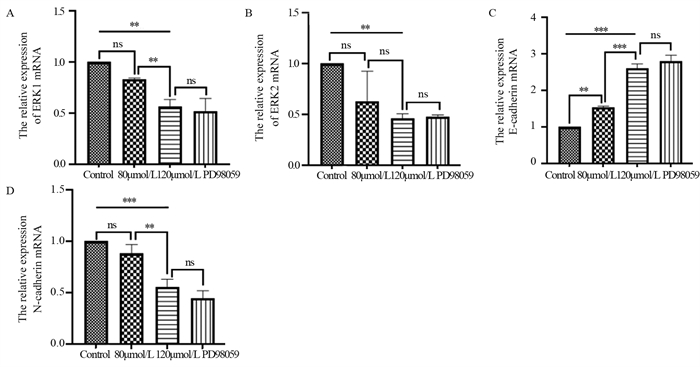
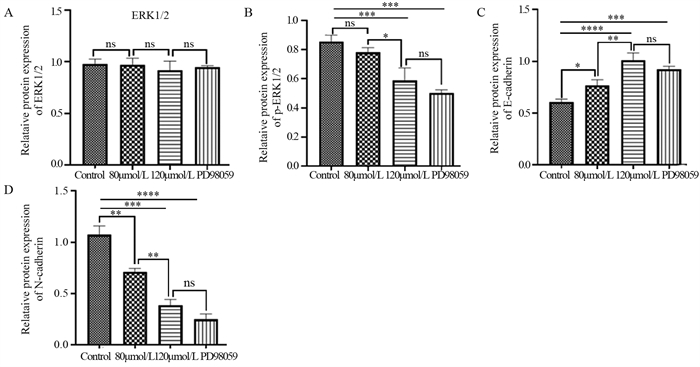
对照组ERK1 mRNA的表达与ACT 120 µmol/L组比较,差异有统计学意义(P < 0.01),见图 4A;ACT 120 µmol/L组和PD98059抑制剂组比较,差异无统计学意义(P > 0.05)。ACT 120 µmol/L组ERK2 mRNA的表达与对照组相比,差异有统计学意义(P < 0.01);而其余各组差异均无统计学意义,见图 4B。这表明ACT对肝癌细胞的作用与ERK1/2信号通路相关。
2.4.2 ACT对肝癌细胞EMT相关基因E-cadherin、N-cadherin mRNA的影响
与对照组相比,各实验组E-cadherin mRNA表达上调,见图 4C;而ACT 120 μmol/L组与PD98059抑制剂组相比差异无统计学意义(P > 0.05)。与对照组相比,各实验组N-cadherin mRNA表达明显下调,且随着药物浓度的增高下调更显著;ACT 120 μmol/L组与PD98059抑制剂组相比差异无统计学意义(P > 0.05),见图 4D。
2.5 ACT通过ERK1/2信号通路对肝癌细胞EMT相关蛋白的影响
2.5.1 ACT对ERK1/2信号通路蛋白的影响
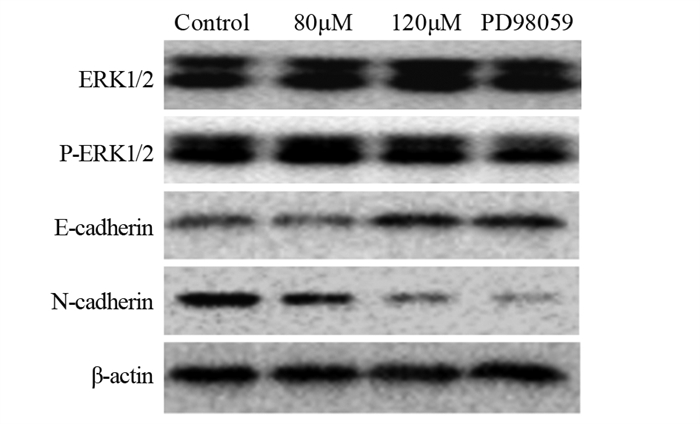
Western blot法测定各组细胞中ERK1/2、p-ERK1/2信号通路关键蛋白的表达水平,见图 5。各组ERK1/2蛋白的表达差异无统计学意义(P > 0.05),见图 6A~B。
2.5.2 ACT对EMT相关蛋白E-cadherin、N-cadherin的影响
与对照组相比,各实验组E-cadherin蛋白的表达明显上调,其中,ACT 120 μmol/L组上调更显著(P < 0.0001);而ACT 120 μmol/L组与PD98059抑制剂组相比差异无统计学意义(P > 0.05),见图 6C。与对照组相比,各实验组间N-cadherin蛋白的表达明显下调,差异有统计学意义;ACT 120 μmol/L组与PD98059抑制剂组相比差异无统计学意义(P > 0.05),见图 6D。
3 讨论
ACT是从多种中草药中提取的一种水溶性化合物,可通过多靶点、多途径抑制恶性肿瘤,如口腔鳞状细胞癌[8]、结肠癌[9]和胶质细胞瘤[10]的发生和发展。本课题组前期研究表明,ACT可通过调控ERK5、p38MAPK、JNK信号通路进而抑制肝癌细胞的生物学变化[7, 11-12]。ERK1/2作为MAPK信号通路的亚通路,其是否也可影响肝癌细胞的EMT尚无报道。为了进一步研究ACT是否通过调控ERK1/2信号通路抑制肝癌HCCLM3细胞的EMT、侵袭和转移,本实验发现,ACT可明显抑制肝癌HCCLM3细胞的增殖、侵袭和迁移。
ERK1/2是MAPK信号通路的亚通路,越来越多的研究表明其在肝细胞癌中异常表达。Zhao等[13]的研究表明槲皮素作为一种有效的肝脏保护剂,在肝癌晚期可通过MEK1/ERK1/2信号通路进而抑制癌细胞增殖和扩散。赵嘉琪[14]发现,人参皂苷CK可通过调控ERK1/2通路诱导人肝癌细胞的增殖和线粒体凋亡。李玉龙等[15]的研究表明,高浓度健脾解毒方能延缓荷瘤鼠恶液质的发生和进展,这提示可能与健脾解毒方上调TCR、ERK1/2及p-ERK1/2有关。吴志贤等[16]通过构建慢病毒表达载体介导siRNA沉默Id-1,抑制人肝癌细胞HepG2裸鼠皮下移植瘤的生长,其机制可能与调控ERK1/2 MAPK信号通路有关。本研究结果显示,ACT作用于肝癌细胞后p-ERK1/2蛋白和mRNA的表达显著降低(P < 0.05),且呈浓度依赖性,而120 µmol ACT与PD98059抑制剂组相比差异无统计学意义(P > 0.05)。据此,我们推测ACT可通过下调ERK1/2信号通路进而抑制人肝癌HCCLM3细胞的增殖、侵袭及迁移。
EMT的发生是多种蛋白分子、生长因子和转录因子共同作用的结果。肝癌细胞的侵袭迁移与EMT的发生发展密切相关。EMT发生的特点为上皮细胞连接蛋白E-钙黏蛋白基因的表达下调,蛋白质产物N-钙黏蛋白、波形蛋白上调,进而促进间充质黏附。文献[17]表明,小檗胺可抑制人肝癌SMMC-7721细胞侵袭转移,其机制可能与其调控EMT相关蛋白的表达有关。刘博佳等[18]实验显示,羽扇豆醇可抑制异种移植HepG2细胞荷瘤小鼠肿瘤的生长,肿瘤组织中E-cadherin蛋白表达增高,N-cadherin蛋白表达降低。本实验前期研究也证实,ACT可抑制肝癌HepG2细胞基质金属蛋白酶的表达,进而抑制肝癌的侵袭及转移[7]。在前期研究的基础上进一步发现,ACT处理后人肝癌HCCLM3细胞中E-cadherin蛋白和mRNA表达明显增加,而N-cadherin的表达明显下降。进一步证实ACT可抑制肝癌细胞EMT的发生,其可能通过下调ERK1/2信号通路来实现,其具体作用机制与EMT相关蛋白E-cadherin、N-cadherin的表达有关。
综上,ACT可通过调控ERK1/2信号通路进而抑制人肝癌HCCLM3细胞上皮间质转化,其具体作用与E-cadherin表达的上调和N-cadherin表达的下调有关。本实验仅是在体外细胞水平研究,仍需行体内实验进一步研究,进而为后续中草药化合物ACT在临床上的进一步开发利用提供理论基础和实验依据。
Competing interests: The authors declare that they have no competing interests.作者贡献:袁倩倩:实验操作、结果整理及论文撰写何昱静、温雪、张久聪、郑英、卢利霞、李斌:数据统计分析于晓辉:实验设计及文稿审校 -
表 1 ACT对HCCLM3肝癌细胞增殖抑制率的影响(%)
Table 1 Effect of ACT on proliferation inhibition rate of hepatocellular carcinoma HCCLM3 cells (%)

表 2 各组肝癌HCCLM3细胞迁移和侵袭数目比较(n=6, x±s)
Table 2 Comparison of migration and invasion number of hepatocellular carcinoma HCCLM3 cells among the groups (n=6, x±s)

-
[1] Alipieva K, Korkina L, Orhan IE, et al. Verbascoside——a review of its occurrence, (bio)synthesis and pharmacological significance[J]. Biotechnol Adv, 2014, 32(6): 1065-1076. doi: 10.1016/j.biotechadv.2014.07.001
[2] Pesce M, Franceschelli S, Ferrone A, et al. Verbascoside down-regulates some pro-inflammatory signal transduction pathways by increasing the activity of tyrosine phosphatase SHP-1 in the U937 cell line[J]. J Cell Mol Med, 2015, 19(7): 1548-1556. doi: 10.1111/jcmm.12524
[3] Maquiaveli CDC, Rochetti AL, Fukumasu H, et al. Antileishmanial activity of verbascoside: Selective arginase inhibition of intracellular amastigotes of Leishmania (Leishmania) amazonensis with resistance induced by LPS plus IFN-γ[J]. Biochem Pharmacol, 2017, 127: 28-33. doi: 10.1016/j.bcp.2016.12.018
[4] Fan Y, Zhang K. Verbascoside inhibits the progression of atherosclerosis in high fat diet induced atherosclerosis rat model[J]. J Physiol Pharmacol, 2021, 72(3): 329-337.
[5] Zhang Y, Yuan Y, Wu H, et al. Effect of verbascoside on apoptosis and metastasis in human oral squamous cell carcinoma[J]. Int J Cancer, 2018, 143(4): 980-991. doi: 10.1002/ijc.31378
[6] 潘琦璐, 马礼兵. 上皮-间质转化在恶性肿瘤发病和侵袭转移中的作用研究进展[J]. 实用医学杂志, 2020, 36(17): 2443-2447. https://www.cnki.com.cn/Article/CJFDTOTAL-SYYZ202017026.htm Pan QL, Ma LB. The role of epithelial-mesenchymal transition in the pathogenesis, invasion and metastasis of malignant tumors[J]. Shi Yong Yi Xue Za Zhi, 2020, 36(17): 2443-2447. https://www.cnki.com.cn/Article/CJFDTOTAL-SYYZ202017026.htm
[7] 熊婉媛, 侯怀晶, 于晓辉, 等. 肝细胞癌的发生、发展与p38MAPK信号通路关系的研究进展[J]. 肝脏, 2018, 23(8): 736-739. doi: 10.3969/j.issn.1008-1704.2018.08.029 Xiong WY, Hou HJ, Yu XH, et al. Study on the relationship between p38MAPK signaling pathway and hepatocellular carcinoma[J]. Gan Zang, 2018, 23(8): 736-739. doi: 10.3969/j.issn.1008-1704.2018.08.029
[8] Yan Z, Xiao Y, Chen Y, et al. Screening and identification of epithelial-to-mesenchymal transition-related circRNA and miRNA in prostate cancer[J]. Pathol Res Pract, 2020, 216(2): 152784. doi: 10.1016/j.prp.2019.152784
[9] Gunaratne A, Chan E, El-Chabib TH, et al. Apkc alters the tgfbeta response in nsclc cells through both smad-dependent and smad-independent pathways[J]. J Cell Sci, 2015, 128(3): 487-498.
[10] Sorrentino A, Thakur N, Grimsby S, et al. The type i tgf-beta receptor engages traf6 to activate tak1 in a receptor kinase-independent manner[J]. Nat Cell Biol, 2008, 10(10): 1199-1207. doi: 10.1038/ncb1780
[11] 张裕. 毛蕊花糖苷通过ERK5信号通路影响肝癌细胞侵袭及迁移的实验研究[D]. 甘肃中医药大学, 2020. Zhang Y. The study of Verbascoside on invasion and migration of hepatocarcinoma cells through ERK5 signaling pathway[D]. Gansu University of Chinese Medicine, 2020.
[12] 朱博兰. 毛蕊花糖苷通过JNK信号通路影响肝癌细胞增殖及自噬的实验研究[D]. 兰州大学, 2020. Zhu BL. Verbascoside affect the proliferation and autophagy of HCC cells by regulating the JNK signaling pathway[D]. Lanzhou University, 2020.
[13] Zhao X, Wang J, Deng Y, et al. Quercetin as a protective agent for liver diseases: A comprehensive descriptive review of the molecular mechanism[J]. Phytother Res, 2021, 35(9): 4727-4747. doi: 10.1002/ptr.7104
[14] 赵嘉琪, 苏杰琳, 陈佳欣, 等. 人参皂苷CK通过调控ERK1/2通路诱导人肝癌细胞线粒体凋亡作用机制的研究[J]. 时珍国医国药, 2021, 32(5): 1094-1097. doi: 10.3969/j.issn.1008-0805.2021.05.19 Zhao JQ, Su JL, Chen JX, et al. Effect of ginsenoside CK on mitochondrial apoptosis in human hepatocellular carcinoma cells by regulating ERK1/2 pathway[J]. Shi Zhen Guo Yi Guo Yao, 2021, 32(5): 1094-1097. doi: 10.3969/j.issn.1008-0805.2021.05.19
[15] 李玉龙, 卢丽莎, 孙保国, 等. 健脾解毒方对脾虚肝癌大鼠生存的影响及与TCR、ERK1/2信号通路的关系[J]. 光明中医, 2019, 34(12): 1813-1817. doi: 10.3969/j.issn.1003-8914.2019.12.016 Li YL, Lu LS, Sun BG, et al. Effect of Jianpi Jiedu Decoction on survival of liver cancer rats with spleen deficiency and its relationship with TCR and ERK1/2 signaling pathways[J]. Guang Ming Zhong Yi, 2019, 34(12): 1813-1817. doi: 10.3969/j.issn.1003-8914.2019.12.016
[16] 吴志贤, 曾达武, 林苏, 等. 慢病毒载体介导siRNA沉默Id-1通过ERK1/2信号通路抑制裸鼠人肝癌移植瘤生长[J]. 福建医科大学学报, 2018, 52(2): 69-74. https://www.cnki.com.cn/Article/CJFDTOTAL-FJYD201802001.htm Wu ZX, Zeng DW, Lin S, et al. Inhibitory effect of lentiviral vector for siRNA of Id-1 on human transplanted carcinoma in nude mice[J]. Fujian Yi Ke Da Xue Xue Bao, 2018, 52(2): 69-74. https://www.cnki.com.cn/Article/CJFDTOTAL-FJYD201802001.htm
[17] 余彬彬, 钱金娥, 曹剑波. 小檗胺对肝癌SMMC-7721细胞侵袭转移的影响[J]. 中国现代应用药学, 2018, 35(12): 1771-1775. https://www.cnki.com.cn/Article/CJFDTOTAL-XDYD201812004.htm Yu BB, Qian JE, Cao JB. Effect of berbamine on migration and invasion of human liver cancer SMMC-7721 cells[J]. Zhongguo Xian Dai Ying Yong Yao Xue, 2018, 35(12): 1771-1775. https://www.cnki.com.cn/Article/CJFDTOTAL-XDYD201812004.htm
[18] 刘博佳, 宁青, 钟荣玲, 等. 羽扇豆醇对人肝癌细胞HepG2和SK-HEP-1侵袭、转移的影响及机制研究[J]. 中国中药杂志, 2020, 45(24): 6028-6035. https://www.cnki.com.cn/Article/CJFDTOTAL-ZGZY202024021.htm Liu BJ, Ning Q, Zhong RL, et al. Effects of lupinol on invasion and metastasis of human hepatoma HepG2 and SK-HEP-1 cells and its mechanism[J]. Zhongguo Zhong Yao Za Zhi, 2020, 45(24): 6028-6035. https://www.cnki.com.cn/Article/CJFDTOTAL-ZGZY202024021.htm



 下载:
下载: