-
摘要:目的
探讨TM9SF3在肺腺癌中的表达及其临床意义。
方法利用TCGA和GEPIA数据库筛选差异表达的TM9SF家族分子,并分析其对肺腺癌患者预后的影响。通过人类蛋白组学图谱数据库、免疫印迹实验和聚合酶链式反应实验验证TM9SF3在LUAD患者中的表达和定位。利用GSEA分析与TM9SF3相关的基因的信号通路富集分析。使用TIMER数据库和CIBERSORT算法分析差异表达的TM9SF3和免疫细胞浸润程度的相关性。
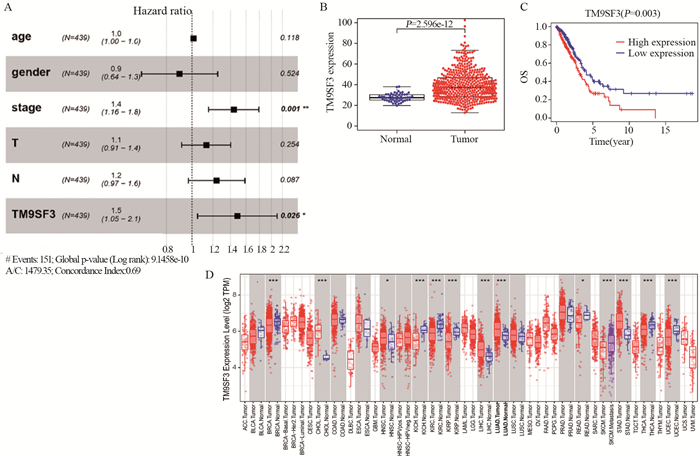
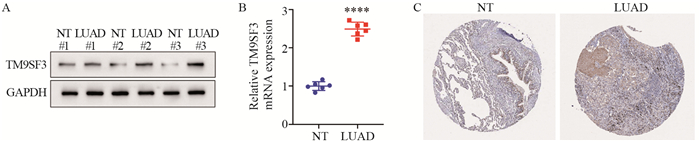
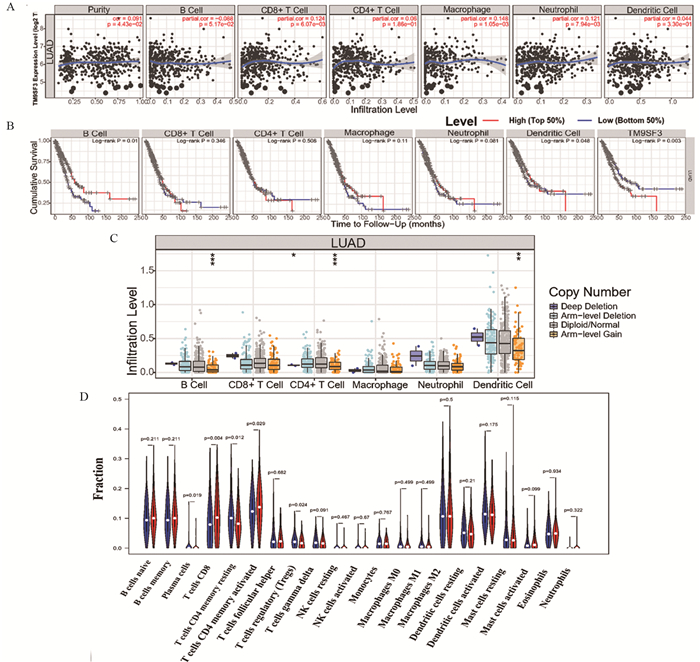
结果TM9SF3在LUAD的表达显著升高,并对LUAD患者的预后有显著不良影响。免疫印迹实验和聚合酶链式反应实验结果证实TM9SF3在LUAD高表达。同时,与TM9SF3表达相关的基因主要富集在调节免疫细胞活性的细胞信号通路。TM9SF3的表达与六种免疫细胞的表达改变明显相关。
结论TM9SF3在肺腺癌中差异表达并且可作为肺腺癌患者潜在的预后标志物。TM9SF3也能够改变LUAD患者中免疫细胞浸润水平,有望成为一个新的肺腺癌免疫治疗潜在靶点。
Abstract:ObjectiveTo investigate the expression and clinical significance of TM9SF3 in lung adenocarcinoma (LUAD).
MethodsTCGA and GEPIA databases were used to screen the differentially-expressed TM9SF family molecules and analyze their effects on patient prognosis with LUAD. The expression and localization of TM9SF3 in LUAD patients were verified by a human proteomic mapping database, Western blot assay, and polymerase chain reaction assay. Herein, the GSEA was used for the signal pathway enrichment analysis of TM9SF3-related genes. Meanwhile, the TIMER database and CIBERSORT algorithm were used to analyze the correlation between differentially-expressed TM9SF3 and the degree of immune cell infiltration.
ResultsThe expression of TM9SF3 in LUAD was significantly increased and had a significant adverse effect on the prognosis of LUAD patients. In addition, immunoblotting and polymerase chain reaction confirmed that TM9SF3 was highly expressed in LUAD. Meanwhile, the genes related to TM9SF3 expression were mainly enriched in cell signaling pathways regulating immune cell activity. The expression of TM9SF3 was significantly correlated with the expression changes of six immune cells.
ConclusionTM9SF3 is differentially expressed in LUAD and may be used as a potential prognostic marker for LUAD patients. TM9SF3 can also change the level of immune cell infiltration in LUAD patients and is expected to be a new potential target for LUAD immunotherapy.
-
Key words:
- Lung adenocarcinoma /
- Immunotherapy /
- TM9SF3 /
- Prognosis /
- Immune microenvironment
-
0 引言
图像引导放射治疗(image guided radiation therapy, IGRT)已经成为恶性肿瘤治疗的重要手段之一,机载先进影像可以减小、校正患者的摆位误差,提高患者放疗的准确性[1-2]。目前基于三维IGRT已经成为主流,按能量可分为千伏级(kilovolt, kV)和兆伏级(megavolt, MV)[3],根据CT成像原理可分锥形束CT(cone beam CT, CBCT)和扇形束CT(fan beam CT, FBCT),FBCT的图像质量优于CBCT。一体化直线加速器机载的图像引导系统如联影直线加速器uRT 506c、CT-on-rail机载kV-FBCT[1]。虽然这种机载FBCT在线扫描时具有与诊断CT相似的图像质量[4-5],但kV-FBCT的中心与直线加速器治疗中心相距超过1米,导致采集kV影像时和放疗的时间之间有一定时间间隔,从而导致潜在的误差。因此,非等中心的kV影像清晰度是否能有效减低摆位误差、治疗计划体积(planning target volume, PTV)边界仍需要深入探索。南方医科大学深圳医院在2022年6月安装联影一体式直线加速器uRT-linac 506c并在肿瘤科开始投入使用,现回顾性分析该机器所配置的kV-FBCT和MV-CBCT校位数据,分析不同部位肿瘤患者在PTV各个方向的摆位误差和外放边界。
1 资料与方法
1.1 临床资料
收集2022年6月—2022年9月间在南方医科大学深圳医院肿瘤科行放射治疗的所有患者73例,剔除完成放射治疗≤3次的患者1例及照射上肢患者2例,共入组患者70例。其中男性36例、女性34例;年龄29~86岁,中位年龄58岁。根据照射部位不同将患者分为5个亚组:头颈组14例,胸部组(除乳腺)11例,乳腺组23例,上腹部组9例及盆腔组13例;行根治性放疗和辅助及新辅助放疗者33例,共计901例次,剂量范围:36~69.96 Gy,中位剂量60 Gy。姑息放疗37例,共计604例次,剂量范围:20~50 Gy,中位剂量30 Gy。所有患者均已签署知情同意书,该研究获得南方医科大学深圳医院伦理委员会的批准(NYSZYYEC20220029)。
1.2 体位固定及CT扫描
头颈组统一采用头颈肩面罩固定,仰卧位;其他组均为真空垫固定,仰卧位,肝脏肿瘤放疗需行腹部气囊加压固定,因患者不配合可以不做强制要求;盆腔组需适当充盈膀胱,排空直肠。模拟扫描CT为联影uCT-710,60排,孔径70 cm,扫描层厚:头颈部2 mm,胸腹部3 mm,电压均为120 kV;管电流:头颈部285 mAs,其余部位150 mAs。直线加速器机载kV-FBCT为24排16层诊断级立体等像素CT,孔径70 cm,扫描条件如下:电压均为120 kV;管电流:头颈部为20 mAs,胸腹部75 mAs;MV-CBCT扫描条件如下:1.5 MV-X线,头颈部直线加速器机器跳数为7.2,其余部位总跳数为9。
1.3 图像采集及配准
图像采集基于联影直线加速器uRT-linac 506c机载的图像引导系统,患者常规摆位后放疗前行kV-FBCT或MV-CBCT扫描,与计划CT图像配准,由加速器自带软件完成周围骨组织和PTV配准,技师和医师共同确认配准后分别记录配准中心点在患者左右(left-right, LR)、前后(anterior-posterior, AP)和头脚(superior-inferior, SI)方向的位移。共采集配准图像1 130例次,行kB-FBCT扫描1 025例次,MV-CBCT扫描105例次。其中头颈组195例次,扫描配准图像为4~33例次,中位值为11例次;胸部组168例次,扫描配准图像为6~23例次,中位值为15例次;乳腺组431人次,扫描配准图像为10~27例次,中位值为20例次;上腹部组128例次,扫描配准图像为4~22例次,中位值为15例次,盆腔组208例次,扫描配准图像为6~30例次,中位值为14例次。
1.4 摆位误差数据分析及计算
记录摆位误差LR、AP、SI三个方向的数值,在LR、AP和SI方向上均可获得不同的位移数值。在同一个方向上,对某一个患者的多次位移数值可计算其标准差(standard deviation, SD),当有n例患者时,则可计算n个SD。计算n例患者在单一方向上所有位移的平均值即为绝对位移偏差;根据n个SD值再计算其标准差即为系统误差(Σ),n例患者SD的均方根(

1.5 三维位移的分析及计算
三维位移为同一个患者当次治疗时左右、前后和头脚方向位移时三维空间欧几里得距离(

1.6 统计学方法
用微软Excel软件计算摆位误差及估计PTV边界。用SPSS20.0软件进行统计分析,Mann-Whitney U检验分析kV-FBCT与MV-CBCT图像引导在不同部位中三维位移差异,双侧以P < 0.05为差异有统计学意义。
2 结果
2.1 摆位误差
70例患者在治疗过程中进行摆位验证,采集kV-FBCT和MV-CBCT扫描图像共1 130例次,产生1 130组三维方向上的摆位误差数据。各组在三维方向上产生的平均位移及根据平均位移得出每组对应的系统误差及随机误差,各组平均位移:左右方向波动在-0.3~1.0 mm之间,前后方向波动在-0.5~0.5 mm之间,头脚方向波动在-1.2~1.0 mm之间,其中各组头脚方向位移变化最明显。各组系统误差:左右方向为0.5~1.9 mm,前后方向为0.5~1.5 mm,头脚方向为0.9~1.4 mm,随机误差:左右方向为1.2~2.8 mm,前后方向为0.9~2.3 mm,头脚方向为1.8~3.1 mm,见表 1。
表 1 70例患者kV-FBCT和MV-CBCT引导所得的不同解剖部位的三维方向摆位误差值(mm)Table 1 Set-up errors indifferent anatomical sites of 70 patients with kV-FBCT and MV-CBCT guidance (mm)
2.2 PTV外放边界及三维位移
根据推荐外扩PTV边界公式得出各组三维外放边界及三维位移,头颈组三维方向外放边界在1.9~3.1 mm,乳腺组在4.6~5.1 mm,上腹部组在3.0~5.5 mm,盆腔组在3.5~6.8 mm,见表 2。70例患者共记录到1 130例次位移偏差,各组患者3D位移散点图,见图 1。头颈组3D平均位移为2.4±1.0 mm,乳腺组为4.1±2.0 mm,盆腔组为4.6±2.1 mm,各组3D位移箱式图见图 2、表 2。
表 2 70例患者kV-FBCT和MV-CBCT测得的不同解剖部位各方向外扩边界及三维位移值(mm)Table 2 Estimated PTV margin and 3D displacements of the different anatomical sites in 70 patients from kV-FBCT and MV-CBCT in each direction (mm)
2.3 kV-FBCT和MV-CBCT三维位移结果
经两种不同机载图像引导系统分析摆位误差,计算得出kV-FBCT(非等中心IGRT)和MV-CBCT(等中心IGRT)组所有患者三维位移中位值分别为4.1 mm和3.4 mm,差异无统计学意义(P=0.212),见图 3、表 3。在不同部位的肿瘤IGRT中,乳腺癌的FBCT引导所导致的三维位移明显大于MV-CBCT,而在头颈部、胸腹部及盆腔肿瘤中两者的三维位移的差异未达到有统计学意义的水平。
![]() 图 3 kV-FBCT和MV-CBCT组所有患者三维位移箱式图Figure 3 The box plot of 3D displacement of all patients in kV-FBCT and MV-CBCT groupsThe median values of 3D displacement in the kV-FBCT and MV-CBCT groups were 4.1 and 3.4 mm, respectively. The median values of 3D displacement of breast group measured by kV-FBCT and MV-CBCT were 4.3 and 3.0 mm (P=0.039).表 3 不同图像引导方式的三维位移值(mm)Table 3 3D displacement values by different image-guiding methods (mm)
图 3 kV-FBCT和MV-CBCT组所有患者三维位移箱式图Figure 3 The box plot of 3D displacement of all patients in kV-FBCT and MV-CBCT groupsThe median values of 3D displacement in the kV-FBCT and MV-CBCT groups were 4.1 and 3.4 mm, respectively. The median values of 3D displacement of breast group measured by kV-FBCT and MV-CBCT were 4.3 and 3.0 mm (P=0.039).表 3 不同图像引导方式的三维位移值(mm)Table 3 3D displacement values by different image-guiding methods (mm)
3 讨论
本研究提示在直线加速器上加载具有诊断级清晰图像的FBCT可进行IGRT,除了提供高清晰的CT影像外,其摆位误差也令人满意。与等中心的MV-CBCT校正体位相比,非等中心的FBCT可带来潜在误差,本研究提示用FBCT进行IGRT需要在PTV边界可能额外增加1 mm的边界来补偿其不确定性,但仍需深入研究。
目前临床上应用最广泛的IGRT是CBCT,但它在图像质量、均匀性和解剖准确性等方面与FBCT相比均存在明显劣势[9],因此有文献表明FBCT更适合用于体内成像,同时与kV-CBCT相比,FBCT在扫描中患者实际接受的辐射剂量更低[9]。与MV-CBCT图像相比,kV-FBCT扫描图像更清晰[9],可更好地有效降低治疗时的体位误差,发现治疗期间肿瘤和正常组织的变化,从而为自适应放疗提供强有力的临床保证。理论上讲kV-FBCT图像清晰度提高可能会有效减少治疗摆位误差,而在本研究中暂未观察到这种结果,反而kV-FBCT三维位移比MV-CBCT大0.7 mm(4.1 mm vs. 3.4 mm),尽管两种CT的三维位移在数值上无统计学意义,但在临床实践中尤其在使用立体定向放射外科治疗技术时,0.7 mm误差也需要引起临床医师的足够重视。在亚组分析中发现乳腺组23例患者,其中有52%(12例)患者摆位验证交替使用了这两种技术,分别配准并采集图像为355例次和74例次,kV-FBCT三维位移大于MV-CBCT,可能是机载的kV-FBCT与MV射线并非同一个等中心,两者相距1 m以上,在从FBCT图像获取实施放射治疗的过程中有一定的时间与距离差,从而导致潜在的不确定性。提示如果采用FBCT进行IGRT,需要额外增加1 mm的PTV边界,从而导致更多的正常组织接受不必要的高剂量照射。
对于头颈部肿瘤来说,从每周1次的电子射野影像验证系统到每周1次的MV-CBCT验证,图像引导系统清晰度的提高能够更加精确的纠正摆位误差,可以使临床靶区外放边界从5 mm缩小到现在公认的3 mm[10]。本研究中头颈组14例患者每周至少3次以上kV-FBCT扫描,提示三维外放边界范围为1.9~3.1 mm,多次FBCT引导的前提下左右和前后方向仅需要外放2 mm就可能满足临床需要。Tan等[11]也同样认为在鼻咽癌放射治疗中2 mm的外扩边界足够覆盖 > 95%的几何范围,甚至认为如果在放疗的第3周行自适应放疗更改放疗计划,1 mm的外扩边界也是足够的,因此缩小外放边界可能更加精确地保护周围危及器官减轻放疗反应,而临床上我们通常采用的PTV均匀外放边界并非最佳,个体化的PTV可能更加合理,但需要进一步探索[12]。本研究也发现图像引导下乳腺组三维平均位移仅为2.4 mm,在左右、前后及头脚方向PTV外放边界分别为4.6、4.9及5.1 mm,系统误差为1.2~1.5 mm,与Donovan等[13]研究结果一致。
摆位误差最小化、放疗期间的有效运动管理、统一的靶区定义及最佳的PTV边界为放疗流程所关注的重点环节。很多学者利用各种先进的图像引导系统来确定CTV与PTV边界的关系[14-15],本研究发现头颈组的系统误差和随机误差均较小,三个方向均 < 2 mm,而且在头颈组和乳腺组中各方向外扩边界与三维外扩边界值近似,说明在某些部位采用某一固定数值外放成PTV边界可能是合理的,而且提示头颈组不需要每次照射前均行FBCT检验,这样使得临床操作简便,提高效率。但在上腹部组和盆腔组中由于各方向外扩与三维外扩边界值差异明显,需个体化三维方向而非均匀外放似乎更符合临床特点。
临床所需PTV的大小主要参照治疗单位各自的系统误差和随机误差的大小,并有数个不同的PTV计算公式[6]。也有剂量覆盖统计模型、肿瘤控制概率与正常组织并发症概率模型等[14],然而,这些模型的临床可靠性需要深入验证。随着计算机技术飞速发展,近年来开发了多种指标用于预测放疗期间肿瘤和正常组织的变化规律,从而实现PTV的个体化和可视化。本团队近年来所研发的一系列预测方法及模型,如基于三维影像的形状统计模型[11]、基于形变配准用于预测放疗期间的解剖变化从而实现在治疗设计中尽量减小PTV[16-18]。也有基于大数据、人工智能等机器学习模型、神经网络模型、支持向量机模型等,所有这些均仍需进一步临床验证[19-20]。
使用不同的图像引导系统来决定外放边界远远不足以满足目前精准放疗的临床需求,将不同的运动管理技术,器官形变特点与放疗具体部位相结合才能更加准确地确定PTV[21],本研究仅行图像引导系统来推测肿瘤外放边界有一定的局限性。腹部和盆腔由于脏器充盈程度的不同和器官在体内的相对运动可能造成较大误差,即使是同一部位也可以由于固定方式不同限制了运动幅度而导致摆位误差的变化。本研究中得出上腹部组(9例)和盆腔组(13例)三维位移相同(均为4.6 mm),可能是由于上腹部组行kV-FBCT8例和MV-CBCT1例,样本量偏少导致,临床实践中扩大样本量可能会得出不同的结果,但在各组患者中三维位移变化总体趋势均符合临床实践。本研究中绝大多数配准图像均采用kB-FBCT(占90%),MV-CBCT扫描数量不够,MV-CBCT初步使用临床经验有待提升。
综上所述,直线加速机载的kV-FBCT能取得和模拟CT相似质量的图像,最大的优点是可以获得患者治疗前实时的三维清晰图像,更准确地反映患者真实的空间体位,为更精准的自适应放疗创造了基础条件,在校验摆位误差方面可获得与MV-CBCT相似的可定量的摆位误差数据,均可为实施精准放疗提供参考。但非等中心的FBCT引导可能导致潜在的误差,需要在临床上特别关注并深入研究。
Competing interests: The authors declare that they have no competing interest.作者贡献:俞华林、许映华:实验操作以及文章撰写王明伟、李曙光:实验数据统计及处理张雯雯:生物信息学数据统计杨劲松、李伟:文章设计和审校 -
-
[1] Olive AL. Lung cancer: epidemiology and sceening[J]. Sury clin North Am, 2002, 102(3): 335-344.
[2] Roberto M, Botticelli A, Cecere F, et al. Immunotherapy in non-small cell lung cancer patients: back to the future[J]. Recenti Prog Med, 2019, 110(12): 587-593.
[3] Yost KE, Satpathy AT, Wells DK, et al. Clonal replacement of tumor-specific T cells following PD-1 blockade[J]. Nat Med, 2019, 25(8): 1251-1259. doi: 10.1038/s41591-019-0522-3
[4] Benghezal M, Cornillon S, Gebbie L, et al. Syn-ergistic control of cellular adhesion by transmembrane 9 proteins[J]. Mol Biol Cell, 2003, 14(7): 2890-2899. doi: 10.1091/mbc.e02-11-0724
[5] Chluba-de Tapia J, de Tapia M, Jäggin V, et al. Cloning of a human multispanning membrane protein cDNA: evidence for a new protein family[J]. Gene, 1997, 197(1-2): 195-204. doi: 10.1016/S0378-1119(97)00263-1
[6] Froquet R, Le Coadic M, Perrin J, et al. TM9-/Phg1 and SadA proteins control surface expression and stability of SibA adhesion molecules in Dictyostelium[J]. Mol Biol Cell, 2012, 23(4): 679-686. doi: 10.1091/mbc.e11-04-0338
[7] Shen L, Du X, Ma H, et al. miR-1193 Suppresses the Proliferation and Invasion of Human T-Cell Leukemia Cells Through Directly Targeting the Transmembrane 9 Superfamily 3 (TM9SF3)[J]. Oncol Res, 2017, 25(9): 1643-1651. doi: 10.3727/096504017X14908284471361
[8] Tang Z, Li C, Kang B, et al. GEPIA: a web server for cancer and nor-mal gene expression profiling and interactive analyses[J]. Nucleic Acids Res, 2017, 45(W1): W98-W102. doi: 10.1093/nar/gkx247
[9] Thul PJ, Lindskog C. The human protein atlas: A spatial map of the human proteome[J]. Protein Sci, 2018, 27(1): 233-244. doi: 10.1002/pro.3307
[10] Vansteenkiste J, Wauters E, Reymen B, et al. Current status of immune checkpoint inhibition in early-stage NSCLC[J]. Ann Oncol, 2019, 30(8): 1244-1253. doi: 10.1093/annonc/mdz175
[11] Iams WT, Porter J, Horn L. Immunotherapeutic approaches for small-cell lung cancer[J]. Nat Rev Clin Oncol, 2020, 17(5): 300-312. doi: 10.1038/s41571-019-0316-z
[12] Garon EB, Hellmann MD, Rizvi NA, et al. Five-Year Overall Survival for Patients With Advanced NonSmall-Cell Lung Cancer Treated With Pembrolizumab: Results From the Phase I KEYNOTE-001 Study[J]. J Clin Oncol, 2019, 37(28): 2518-2527. doi: 10.1200/JCO.19.00934
[13] Reck M, Rodríguez-Abreu D, Robinson AG, et al. Pembrolizumab versus Chemotherapy for PD-L1-Positive Non-Small-Cell Lung Cancer[J]. N Engl J Med, 2016, 375(19): 1823-1833. doi: 10.1056/NEJMoa1606774
[14] Mok TSK, Wu YL, Kudaba I, et al. Pembrol-izumab versus chemotherapy for previously untreated, PD-L1-expressing, locally advanced or metastatic non-small-cell lung cancer (KEYNOTE-042): a randomised, open-label, controlled, phase 3 trial[J]. Lancet, 2019, 393(10183): 1819-1830. doi: 10.1016/S0140-6736(18)32409-7
[15] Herbst RS, Garon EB, Kim DW, et al. Long-Term Outcomes and Retreatment Among Patients With Previously Treated, Programmed Death-Ligand 1-Positive, Advanced Non-Small-Cell Lung Cancer in the KEYNOTE-010 Study[J]. J Clin Oncol, 2020, 38(14): 1580-1590. doi: 10.1200/JCO.19.02446
[16] Gadgeel S, Rodríguez-Abreu D, Speranza G, et al. Updated Analysis From KEYNOTE-189: Pembrolizumab or Placebo Plus Pemetrexed and Platinum for Previously Untreated Metastatic Nonsquamous Non-Small-Cell Lung Cancer[J]. J Clin Oncol, 2020, 38(14): 1505-1517. doi: 10.1200/JCO.19.03136
[17] Walsh RJ, Soo RA. Resistance to immune checkpoint inhibitors in non-small cell lung cancer: biomarkers and therapeutic strategies[J]. Ther Adv Med Oncol, 2020, 12: 1758835920937902.
[18] Boyero L, Sánchez-Gastaldo A, Alonso M, et al. Primary and Acquired Resistance to Immunotherapy in Lung Cancer: Unveiling the Mechanisms Underlying of Immune Checkpoint Blockade Therapy[J]. Cancers (Basel), 2020, 12(12): 3729. doi: 10.3390/cancers12123729
[19] Oo HZ, Sentani K, Sakamoto N, et al. Identification of novel transmembrane proteins in scirrhous-type gastric cancer by the Escherichia coli ampicillin secretion trap (CAST) method: TM9SF3 participates in tumor invasion and serves as a prognostic factor[J]. Pathobiology, 2014, 81(3): 138-148. doi: 10.1159/000357821
[20] Chang H, Jeung HC, Jung JJ, et al. Identification of genes associated with chemosensitivity to SAHA/taxane combination treatment in taxane-resistant breast cancer cells[J]. Breast Cancer Res Treat, 2011, 125(1): 55-63. doi: 10.1007/s10549-010-0825-z
[21] Liu Q, Dong HT, Zhao T, et al. Cancer-associated adipocytes release FU-CA2 to promote aggressiveness in TNBC[J]. Endocr Relat Cancer, 2022, 29(3): 139-149. doi: 10.1530/ERC-21-0243
[22] Cortes JR, Filip I, Albero R, et al. Oncogenic Vav1-Myo1f induces therapeutically targetable macrophage-rich tumor microenvironment in peripheral T cell lymphoma[J]. Cell Rep, 2022, 39(3): 110695. doi: 10.1016/j.celrep.2022.110695
[23] Zhang J, Li H, Wu Q, et al. Tumoral NOX4 recruits M2 tumor asso-ciated macrophages via ROS/PI3K signaling-dependent various cytokine production to promote NSCLC growth[J]. Redox Biol, 2019, 22: 101116. doi: 10.1016/j.redox.2019.101116
[24] Isaeva OI, Sharonov GV, Serebrovskaya EO, et al. Intratumoral immunoglobulin isotypes predict survival in lung adenocarcinoma subtypes[J]. J Immunother Cancer, 2019, 7(1): 279. doi: 10.1186/s40425-019-0747-1
[25] Garaud S, Buisseret L, Solinas C, et al. Tumor infiltrating B-cells signal functional humoral immune responses in breast cancer[J]. JCI Insight, 2019, 5(18): e129641.
[26] Zhao KL, Yang XJ, Jin HZ, et al. Double-edge Role of B Cells in Tumor Immu-nity: Potential Molecular Mechanism[J]. Curr Med Sci, 2019, 39(5): 685-689. doi: 10.1007/s11596-019-2092-5
[27] Veatch JR, Lee SM, Shasha C, et al. Neoantigen-specific CD4(+) T cells in human melanoma have diverse differentiation states and correlate with CD8(+) T cell, macrophage, and B cell function[J]. Cancer Cell, 2022, 40(4): 393-409. e9. doi: 10.1016/j.ccell.2022.03.006
[28] Wu CL, Caumartin J, Amodio G, et al. Inhibition of iNKT Cells by the HLA-G-ILT2 Checkpoint and Poor Stimulation by HLA-G-Expressing Tolerogenic DC[J]. Front Immunol, 2020, 11: 608614.
-
期刊类型引用(5)
1. 苗凌肖, 赵金叶, 李恒, 单凤姣, 张翠红. CBCT图像引导下负压气垫和热塑体膜在腹盆腔肿瘤放疗中的摆位误差比较及体质量指数对复位通过率的影响. 医疗卫生装备. 2025(07)  百度学术
百度学术
2. 王建林,张天,张文君,胡强. 基于机械性能检测分析VitalBeam型直线加速器输出剂量的稳定性评估及故障案例分析. 中国医学装备. 2024(06): 209-213 .  百度学术
百度学术
3. 赵亮,马超,闵骁,熊兵,吴炎,杨爱民. 基于锥形束CT研究不同部位计划靶区外放边界. 现代肿瘤医学. 2024(18): 3549-3555 .  百度学术
百度学术
4. 周军,李寒旭,黄志兵,万久庆,李东春,钟良志. CBCT和EXT图像引导系统在高级别脑胶质瘤放疗中的应用分析. 医疗卫生装备. 2024(08): 57-62 .  百度学术
百度学术
5. 陈文强,赵军军,李扬,袁慧杰. 对比和分析腹部肿瘤影像引导放疗中千伏级锥形束CT与兆伏级电子摄像系统的应用效果. 影像研究与医学应用. 2024(23): 181-183 .  百度学术
百度学术
其他类型引用(0)



 下载:
下载: