Clinical Characteristics and Prognostic Influence Factors of Patients with AIDS-related Malignant Tumor
-
摘要:目的
分析艾滋病病毒(HIV)感染者/艾滋病(AIDS)合并恶性肿瘤患者的临床特点及生存预后情况。
方法回顾性分析354例艾滋病合并恶性肿瘤患者资料,采用Log-rank检验进行单因素分析,采用Cox比例风险回归模型进行多因素分析。
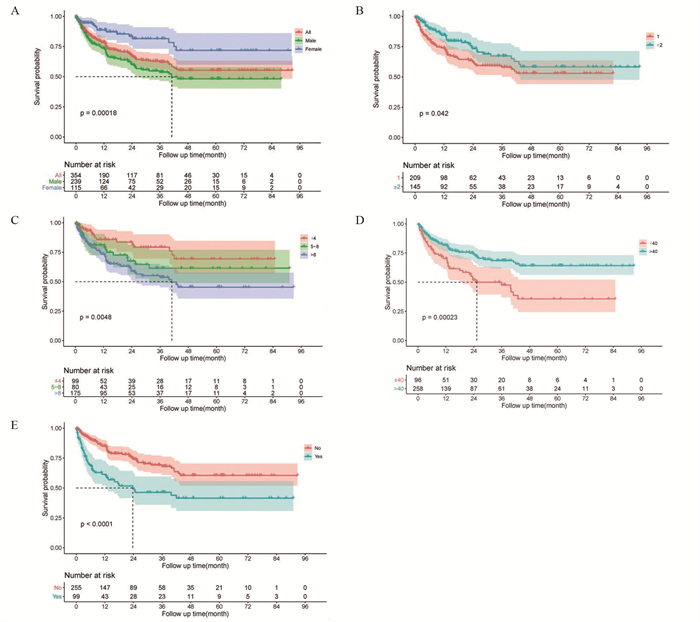
结果患者平均年龄54.10±12.96岁,男女比例2.1:1,艾滋病合并淋巴瘤的患者最多(28.25%);1、3、5年生存率分别为78.48%、62.13%、55.31%。单因素分析显示不同恶性肿瘤类型、年龄、性别、医保类型、确诊合并艾滋病后住院次数、平均住院天数、是否放疗、有无遵医嘱离院等患者的预后差异均有统计学意义;多因素分析显示性别、入院次数、平均住院天数、自费比例以及有无遵医嘱离院是影响患者生存预后的独立危险因素。
结论艾滋病容易合并淋巴瘤、肺癌、宫颈癌。患者在医院接受抗肿瘤疗程不足。
Abstract:ObjectiveTo analyze the clinical characteristics and survival prognosis of patients with AIDS-related malignant tumor.
MethodsWe retrospectively analyzed the data of 354 patients with AIDS-related malignant tumor. Univariate analysis was conducted by Log rank test and multivariate analysis was conducted by Cox proportional risk regression model.
ResultsThe average age of the patients was 54.10±12.96 years old. The ratio of male to female patients was 2.1:1. The number of patients with AIDS complicated with lymphoma was the most, accounting for 28.25%. The 1-, 3- and 5-year survival rates were 78.48%, 62.13% and 55.31%, respectively. Univariate analysis showed that there were statistical differences in prognosis of patients with different types of malignant tumor, age, gender, medical insurance type, number of admissions after diagnosis of AIDS, average length of stay, radiotherapy or not, leaving hospital according to medical advice. Multivariate analysis showed that gender, number of admissions after diagnosis of AIDS, average length of stay, proportion of out-of-pocket and leaving hospital according to medical advice were independent risk factors affecting the survival and prognosis of patients.
ConclusionAIDS is easily complicated with lymphoma, lung cancer and cervical cancer. The patients received insufficient anti-tumor courses in hospital.
-
Key words:
- HIV /
- Malignant tumor /
- Clinical features /
- Survival /
- Prognosis
-
0 引言
肺癌是全球范围内发病率和死亡率最高的恶性肿瘤。2017年死于肺癌的总人数超过乳腺癌、前列腺癌、结直肠癌和脑瘤的总和,预计2020年死于肺癌的人数将达到所有癌症死亡人数的22%以上[1],局部复发和远处转移是导致肺癌高病死率的主要原因。肿瘤的异质性是单次活检无法获取肿瘤全部分子信息的重要原因,也是造成肿瘤耐药性的基础,因此需要对肿瘤的分子分型进行动态评估。液体活检作为一种非侵入性的肿瘤检测方法,可持续、动态地评估肿瘤细胞的基因突变状态[3]。循环肿瘤细胞(circulating tumor cell, CTCs)、循环肿瘤DNA(circulating tumor DNA, ctDNA)、外泌体、mi-RNA、cf-DNA等是肺癌液态活检的主要检测指标[4],其中CTCs可以提供包含DNA、RNA和蛋白质等多层次的分子信息,而其他指标只能提供遗传层面的异常信息[5]。可见CTCs在肺癌的诊断、疗效评价、预后预测等方面作用显著[6]。本文讨论了CTCs的转移级联过程、检测方法,以及肺癌CTCs在临床早期筛查、预测复发转移、疗效监测评价等方面的应用,并融合入中医“正虚伏毒”理论,以期为肺癌转移转化研究提供新的思路。
1 肺癌循环肿瘤细胞
1869年,Ashworth首次提出循环肿瘤细胞的概念,CTCs是从原发肿瘤脱落进入血液的肿瘤细胞,从浸润至进入循环会发生一系列转移级联过程进而造成远处转移和定植[7]。2019年,田建辉等从一例Ⅱa期肺癌患者的血液中分离出CTCs,成功建立了永久性的人肺腺癌循环肿瘤细胞系CTC-TJH-01。CTC-TJH-01处于上皮间质转化(EMT)的中间阶段,具有干细胞表型、耐药性强和休眠的特性,在NOD-SCID小鼠上具有致瘤性和肺转移能力[8]。根据EMT的不同阶段可将CTCs亚群分为上皮-间充质型循环肿瘤细胞、上皮型循环肿瘤细胞和间充质型循环肿瘤细胞[9],不同表型的CTCs转移能力有所差异。
2 CTCs参与肿瘤转移级联过程
2.1 肿瘤细胞脱落
肿瘤细胞从原发灶脱落浸润基底膜主要有两种方式:(1)EMT介导途径。EMT是上皮细胞向间质细胞转化的关键过程,通过分泌相关转录因子(Snail、Twist、ZEB-1)、细胞外分子(TGF-β、HGF)、炎性细胞以及特定的信号转导途径(Wnt、β-catenin、NF-κB、PI3K)调节相关蛋白(上皮标志物:EpCAM、E-cadherin、CK;间质标志物:Vimentin、N-cadherin等)表达,使肿瘤细胞向间充质型转化,从而获得更强的移动性并抵抗细胞凋亡[10];(2)非EMT介导途径。肿瘤细胞通过外力和中心体增大的方式,介导肿瘤细胞被动渗入血液,以单细胞或细胞簇的形式离开原发肿瘤[11]。通过以上两种方式进入循环的CTCs可能具有不同的细胞表型,皆可引起肿瘤转移。
2.2 血液循环中的CTCs
实体肿瘤每天都有数以万计的肿瘤细胞进入血液循环,CTCs在血液循环中面临着免疫监视、血流剪切力、氧化应激等多方面的因素,只有未被免疫系统清除的CTCs才能进一步播散定植[12]。其中单个循环肿瘤细胞易被免疫细胞清除,发生失巢凋亡。而由多个循环肿瘤细胞组成的循环肿瘤细胞簇或循环肿瘤微栓(circulating tumor microemboli, CTM)能更大程度上发生免疫逃逸,具有更强的凋亡抵抗,更易发生转移[13]。血液循环中的CTCs可被血小板识别,激活血小板并诱导相关细胞因子释放和聚集,形成由血小板包被的细胞簇,从而逃避NK细胞和T细胞的杀伤作用,进而发生免疫逃逸[14]。
2.3 CTCs远处转移和定植
进入血液循环的CTCs可以锚定在内皮细胞的表面,通过受体-配体结合的方式使CTC发生外渗,进而产生远处转移。不同的是,单个CTCs通过毛细血管向外迁移,而CTC簇可逆性地重组为单排链,再横向穿过毛细血管[15]。CTCs表面的整联蛋白通过与内皮细胞表面的黏附分子1(ICAM1)或血管细胞黏附分子1(VCAM1)结合,为CTCs突破血管壁细胞外基质提供动力。CTCs产生的趋化因子配体取决于各自受体的表达,进而决定远处的归巢器官[16]。CTCs还可调节肿瘤微环境中相关抑制性免疫细胞以支持自身增殖和存活。
3 肺癌循环肿瘤细胞检测
CTCs的富集和分离主要有两种方式:其一,基于CTCs独特的物理特性,通过过滤或密度梯度离心等方式获取,被称为“非标记依赖法”;其二,基于CTCs经历的EMT过程,表达特异性细胞表面蛋白,可通过免疫磁珠分选、抗体特异性结合等方式获得,被称为“标记依赖法”,最常用的细胞表面标志物是上皮细胞黏附分子(EpCAM)、细胞角蛋白(CK)等。目前常用的基于物理方法的CTCs检测系统主要有:ISET、MetaCell、CellSieve、Parsortix、OncoQuick、VitaAssay等;基于标记依赖的CTCs检测仪器主要有:CellSearch、MagSweeper、MACS、EPISPOT、CellCollector等[17]。然而,不同系统的CTCs检出效率有差异,如Tamminga等比较了CellSearch和ISET对肺癌CTCs的检出率,发现CellSearch的检出率为69%,而ISET的检出率为88%,表明ISET更适合于肺癌患者的CTCs检测[18]。
研究者正在对检测系统进行优化研究,研发出多种不同原理的CTCs检测方法和新型检测仪器,以提高肺癌CTCs的检出率:(1)微流控装置。Wang等设计的集成微流控装置对肺癌CTCs的平均回收率达到92.5%,纯度达到94%[19];(2)芯片法。Yan等则使用集成多功能电化学芯片将CTCs的捕获效率控制在8%~100%[20];(3)免疫磁珠分离法。通常采用上皮细胞黏附分子(EpCAM)作为主要标志物,将与磁性微粒结合的EpCAM抗体加入外周血中,通过免疫磁珠分离富集CTCs[21];(4)纳米技术。核酸适配体修饰的PEG-PLGA-纳米纤维(PPN)微流控系统,可识别肺癌患者中罕见的CTC亚型并进行优化,显著提高对多克隆源性肿瘤细胞的捕获效率[22];(5)新型肺癌CTCs检测仪器。光流式细胞仪(OFCM)集成了多级微流控芯片和四色荧光检测系统,可以完成自动肺癌CTCs分离,进行3D聚焦和单细胞表型分析[23]。
4 肺癌循环肿瘤细胞的临床应用
4.1 早期筛查
肺癌患者在癌症发展早期基本处于无症状阶段,多数患者明确诊断时已至中晚期,已发生转移,错失治疗的最佳时机。肺癌的早期筛查主要通过低剂量计算机断层扫描(LDCT)实现,然而LDCT具有高假阳性,令患有非恶性结节的患者面临不必要的活检相关风险[24]。Duan等使用CellCollector检测了44名肺结节患者和20例健康志愿者外周血中的CTCs,在志愿者外周血中未检测到CTCs。通过病理学诊断结果对比后发现,肺结节患者外周血中CTCs阳性率为52.94%,其诊断特异性为90%,CellCollector系统检测CTCs可有效区分良恶性结节,用于肺癌早期筛查[25]。Li等采用阴性富集-荧光原位杂交(NE-FISH)方法检测肺癌患者及健康志愿者外周血中CTCs水平,发现肺癌患者的CTCs数量明显高于志愿者或患有良性肺疾病的患者,将CTCs与血清肿瘤标志物联合检测可提高早期肺癌患者的诊断敏感度[26]。
4.2 预后及复发转移预测
肺癌的预后与分期密切相关。大量研究表明,检测肺癌患者手术、放化疗前后血液中的CTCs数量和亚群可预测预后,指导进一步的治疗。Wang等发现放射治疗后NSCLC患者外周血中PD-L1+CTC亚群比例升高,预示着治疗反应与预后不良[27]。Tamminga等研究发现晚期NSCLC患者体内CTCs的存在与酪氨酸激酶抑制剂(TKI)或化疗反应率低、无进展生存期(PFS)和总生存期(OS)短相关[28]。复发转移是导致肺癌患者死亡、生存期短和生活质量低的主要原因。患者术后伴有原发灶切除和淋巴结清扫,短期内无法评估和发现复发转移等情况。有研究发现,手术可以导致肺癌患者术后CTCs数目减少,但术后1天与3天的CTCs数目出现早期反弹现象,且与几月后的复发有关[29]。Chinniah等对48例接受放化疗的局部晚期非小细胞肺癌(LA-NSCLC)患者的CTCs进行纵向监测发现,在患者外周血中检测到CTCs早于放射影像学证据显示疾病复发[30]。
4.3 化疗及免疫靶向治疗的疗效监测与评价
由于肿瘤细胞的异质性,存在基因突变(如ALK重排、EGFR突变等)的患者易发生耐药突变,此时需要进行重复的基因检测。通过对捕获的CTCs进行单细胞测序可以检测到EGFR、MET、ALK和ROS1等基因的分子变化以及PD-L1的表达,鉴定肺癌患者免疫靶向治疗后的耐药性突变,其动态变化有助于实时疗效监测及个性化治疗方案的选择[31]。Guibert等研究发现,NSCLC患者外周血中分离的CTCs表面PD-L1阳性率(83%)高于癌组织(41%),且在使用PD-L1抑制剂治疗的患者中,治疗前PD-L1+CTCs与预后不良相关[32]。
5 创新肺癌亚临床研究思路,提出并验证“正虚伏毒”学说
早期肺癌术后患者影像学评估无可见病灶,临床评估为治愈,但是其外周循环和器官组织中还存有CTCs或休眠的肿瘤细胞,患者实际上处于肺癌转移的亚临床状态,这将成为日后复发转移发生的根源。针对该阶段病理特征,田建辉传承《道德经》“有生于无”和《黄帝内经》重视“正气”思想,融合现代肿瘤学和免疫学进展,提出“正虚伏毒”学说并系统验证,“正虚”主要免疫衰老和免疫逃逸为主的免疫抑制内环境,“伏毒”指高危人群或术后患者体内存在的肿瘤干细胞、循环肿瘤细胞和休眠肿瘤细胞等,“伏毒”具有“毒自内生,深伏血道,内藏脏腑,流注全身,伺机为患,正盛则伏而不出,正虚则出而为病”的特点。认为肺癌术后患者存在伏毒是绝对事件,而最终是否发生复发转移与机体的免疫状态密切相关,免疫功能紊乱可以表现为免疫监视和免疫清除能力下降(正虚),促使潜伏在患者循环系统或者脏器内的CTCs(伏毒)、休眠肿瘤细胞和微小转移灶等发生免疫逃逸,最终导致复发与转移的发生[33]。该学说为肺癌复发转移的研究提供了启发和探索。
课题组前期采用阴性富集和阳性富集(微流控芯片结合免疫磁珠分离技术)研究发现肺癌患者外周血中CTC计数与临床分期之间存在负相关性,早期患者外周血中具有较高数目的CTCs。同时研究发现免疫负调控细胞Tregs和MDSCs的比例与肺癌患者的临床分期呈正相关[34]。提示在局部脏器中免疫抑制微环境的形成可能是促进CTCs定植后存活、增殖形成转移灶的原因之一,目前正在进一步研究。此外,田建辉课题组围绕前期建立的肺癌循环肿瘤细胞系(CTC-TJH-01),证实其具有干细胞表型、休眠、免疫逃逸特征,体内研究证实其致瘤性和肺转移特征,目前发现CTCs形成细胞簇后较单个CTCs具有更强的转移能力;而调控NK细胞功能可抑制CTCs肺转移的发生等现象,从而构建了肺癌转移的体内外研究平台,促进肺癌转移转化研究效率的提高[35]。
6 小结与展望
复发转移是导致早期肺癌术后患者死亡的主要因素,也是制约肺癌整体防控效率提高的关键,但是目前仍缺乏成熟的亚临床阶段发病学理论,而循环肿瘤细胞的研究丰富了对该阶段的认识。2018版CSCO《原发性肺癌诊疗指南》肯定了肺癌术后循环肿瘤细胞检测在预测复发中的价值,并逐渐进入临床研究。然而现阶段肺癌CTCs的研究仍局限于检测技术的开发与完善,由于CTCs检测技术具有多样性,而应用不同原理研发的检测系统灵敏度存在差异,导致临床上尚缺乏统一的检测方法和判定标准;另外由于不同CTCs亚群的转移能力也有所区别,仅以CTCs数目预测转移仍存在争议;CTCs最终是否转移与其所处环境因素密切相关,如CTCs与自然杀伤细胞、巨噬细胞等固有免疫细胞;T、B淋巴细胞等适应性免疫细胞以及血小板等存在复杂的作用机制,有待进一步研究探索[36]。因此,通过精准鉴定转移潜能强的CTCs亚群,进而与免疫、凝血功能状态结合构建肺癌转移风险模型是促进临床推广的关键。充分发挥中医学认知疾病的系统性优势,融合现代科学精华不断创新肺癌转移理论和研究体系,将促进突破制约转移疗效提高的瓶颈,推动肺癌整体防控效率的提高。
Competing interests: The authors declare that they have no competing interests.作者贡献:雷海科、李小升:组织随访、数据统计、文章撰写李杰平、刘俊、肖春燕:文章审阅及修改王颖、张维、刘耀、吴永忠::组织实施、文章审阅及修改 -
表 1 艾滋病合并恶性肿瘤患者的临床特征
Table 1 Clinical characteristics of patients with AIDS-related malignant tumor

表 2 艾滋病合并恶性肿瘤患者预后的单因素分析
Table 2 Survival of patients with AIDS-related malignant tumor: univariate analysis

表 3 影响艾滋病合并恶性肿瘤患者预后的多因素分析
Table 3 Multivariate analysis of prognosis of patients with AIDS-related malignant tumor

-
[1] Trickey A, May MT, Gill MJ, et al. Cause-specific mortality after diagnosis of cancer among HIV-positive patients: A collaborative analysis of cohort studies[J]. Int J Cancer, 2020, 146(11): 3134-3146. doi: 10.1002/ijc.32895
[2] Sellier P, Hamet G, Brun A, et al. COREVIH Ile-de-France-Est research group. Mortality of People Living with HIV in Paris Area from 2011 to 2015[J]. AIDS Res Hum Retroviruses, 2020, 36(5): 373-380. doi: 10.1089/aid.2019.0143
[3] Qiao YC, Xu Y, Jiang DX, et al. Epidemiological analyses of regional and age differences of HIV/AIDS prevalence in China, 2004-2016[J]. Int J Infect Dis, 2019, 81: 215-220. doi: 10.1016/j.ijid.2019.02.016
[4] 王丽艳, 秦倩倩, 丁正伟, 等. 中国艾滋病全国疫情数据分析[J]. 中国艾滋病性病, 2017, 23(4): 330-333. [Wang LY, Qian QQ, Ding ZW, et al. Current situation of AIDS epidemic in China[J]. Zhongguo Ai Zi Bing Xing Bing, 2017, 23(4): 330-333. ]
[5] Ji Y, Lu H. Malignancies in HIV-Infected and AIDS Patients[J]. Adv Exp Med Biol, 2017, 1018: 167-179.
[6] 吕繁, 陈方方. 艾滋病疫情估计及结果解读要点[J]. 中华流行病学杂志, 2019, 40(10): 1191-1196. doi: 10.3760/cma.j.issn.0254-6450.2019.10.004 [Lyu F, Chen FF. National HIV/AIDS epidemic estimation and interpretation in China[J]. Zhonghua Liu Xing Bing Xue Za Zhi, 2019, 40(10): 1191-1196. ] doi: 10.3760/cma.j.issn.0254-6450.2019.10.004
[7] Li Z, Morano JP, Khoshnood K, et al. HIV-related stigma among people living with HIV/AIDS in rural Central China[J]. BMC Health Serv Res, 2018, 18(1): 453. doi: 10.1186/s12913-018-3245-0
[8] Vangipuram R, Tyring SK. AIDS-Associated Malignancies[J]. Cancer Treat Res, 2019, 177: 1-21.
[9] Costiniuk CT, Jenabian MA. Cannabinoids and inflammation: implications for people living with HIV[J]. AIDS, 2019, 33(15): 2273-2288. doi: 10.1097/QAD.0000000000002345
[10] 黄曦悦, 石明巧, 苟瑜, 等. 64例HIV/AIDS患者合并肿瘤临床特征分析[J]. 四川医学, 2018, 39(7): 743-747. [Huang XY, Shi MQ, Gou Y, et al. Analysis of the clinical features of 64 cases of HIV/AIDS patients with tumor[J]. Sichuan Yi Xue, 2018, 39(7): 743-747. ]
[11] 王红羚, 张天勇. 肿瘤患者HIV74例感染情况分析[J]. 重庆医学, 2012, 41(31): 3302-3304. doi: 10.3969/j.issn.1671-8348.2012.31.024 [Wang HL, Zhang TY. Survey of HIV infection in 74 tumor patients[J]. Chongqing Yi Xue, 2012, 41(31): 3302-3304. ] doi: 10.3969/j.issn.1671-8348.2012.31.024
[12] 张珂, 熊英, 吴立春, 等. 肿瘤患者中HIV感染状况的初步调查分析[J]. 肿瘤预防与治疗, 2011, 24(2): 83-85. [Zhang K, Xiong Y, Wu LC, et al. Investigation of HIV Infection Status in Cancer Patients[J]. Zhong Liu Fang Zhi Yu Zhi Liao, 2011, 24(2): 83-85. ]
[13] Robbins HA, Shiels MS, Pfeiffer RM, et al. Epidemiologic contributions to recent cancer trends among HIV-infected people in the United States[J]. AIDS, 2014, 28(6): 881-890. doi: 10.1097/QAD.0000000000000163
[14] 中国疾病预防控制中心, 性病艾滋病预防控制中心, 性病控制中心. 2016年12月全国艾滋病性病疫情[J]. 中国艾滋病性病, 2017, 23(2): 93. [NCAIDS, NCSTD, China CDC. Update on the AIDS/STD epidemic in China in December, 2016[J]. Zhongguo Ai Zi Bing Xing Bing, 2017, 23(2): 93. ]
[15] 王袁, 张树敬, 蔡黎霞, 等. 肿瘤专科医院就诊患者HIV感染情况分析[J]. 中国皮肤性病学杂志, 2017, 31(4): 410-411, 418. [Wang Y, Zhang SJ, Cai NX, et al. Prevalence and Analysis of HIV Infection in Tumor Patients in Cancer Hospital[J]. Zhongguo Pi Fu Xing Bing Xue Za Zhi, 2017, 31(4): 410-411, 418. ]
[16] 倪明健, 陈学玲, 马媛媛, 等. 新疆维吾尔自治区艾滋病抗病毒治疗者不同性别死亡率及其影响因素分析[J]. 中华流行病学杂志, 2015, 36(9): 971-975. doi: 10.3760/cma.j.issn.0254-6450.2015.09.014 [Ni MJ, Chen XL, Ma YY, et al. Sex specific mortality in HIV/AIDS patients receiving antiretroviral therapy and risk factors in Xinjiang Uygur autonomous region[J]. Zhonghua Liu Xing Bing Xue Za Zhi, 2015, 36(9): 971-975. ] doi: 10.3760/cma.j.issn.0254-6450.2015.09.014
[17] Antiretroviral Therapy Cohort Collaboration. Survival of HIV-positive patients starting antiretroviral therapy between 1996 and 2013: a collaborative analysis of cohort studies[J]. Lancet HIV, 2017, 4(8): e349-e356. doi: 10.1016/S2352-3018(17)30066-8
[18] 国家癌症中心. 2019中国肿瘤登记年报[M]. 北京: 人民卫生出版社, 2021: 75. [National Cancer Center. Chinese cancer registry annual report 2019[M]. Beijing: People's Medical Publishing House, 2021: 75. ]
[19] 雷海科, 李小升, 赵玉兰, 等. 2011-2018年重庆多中心恶性肿瘤出院患者生存分析[J]. 中国肿瘤, 2020, 29(3): 192-198. [Lei HK, Li XS, Zhao YL, et al. Survival of Discharged Malignant Tumor Patients from Multi-centers in Chongqing from 2011 to 2018[J]. Zhongguo Zhong Liu, 2020, 29(3): 192-198. ]
[20] 胡俊华, 胡艳秋, 许红霞, 等. 佳木斯市艾滋病抗病毒治疗患者生存率及影响因素分析[J]. 中国现代医生, 2021, 59(19): 10-13. [Hu JH, Hu YQ, Xu HX, et al. Analysis of survival rate and influencing factors of AIDS patients treated with antiviral therapy in Jiamusi City[J]. Zhongguo Xian Dai Yi Sheng, 2021, 59(19): 10-13. ]
[21] 郑武, 赵丁源, 张薇, 等. 湖北省2008-2018年艾滋病抗病毒治疗患者生存及影响因素分析[J]. 中国热带医学, 2020, 20(5): 417-422. [Zheng W, Zhao DY, Zhang W, et al. Survival time and influence factors of HAART in Hubei, 2008-2018[J]. Zhongguo Re Dai Yi Xue, 2020, 20(5): 417-422. ]
-
期刊类型引用(3)
1. 张向前,兰堃田,李伟明. 外周血循环肿瘤细胞动态变化与晚期食管癌化疗患者预后的关系. 医药论坛杂志. 2024(21): 2261-2265 .  百度学术
百度学术
2. 李文见. 循环肿瘤细胞表达与经奥希替尼联合EP化疗治疗的晚期NSCLC患者生存的相关性. 河南医学研究. 2023(06): 1068-1071 .  百度学术
百度学术
3. 周明锴. 四项血清指标联合检测在鉴别诊断NSCLC中的价值分析. 实验与检验医学. 2021(03): 655-657+687 .  百度学术
百度学术
其他类型引用(4)



 下载:
下载:

