Diagnostic Value of 18F-labeled PSMA PET/CT for Regional Lymph Node Metastasis in Prostate Cancer: A Meta-analysis
-
摘要:目的
系统评价18F标记的PSMA PET/CT对前列腺癌区域淋巴结转移的诊断价值。
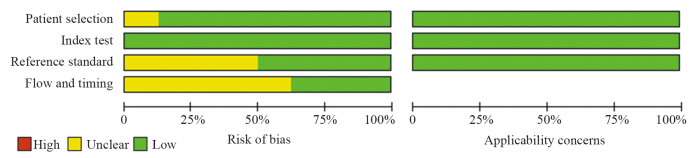
方法检索2000年1月1日至2021年5月31日PubMed、Embase、Cochrane Library、Web of Science、中国知网(CNKI)、维普、万方数据库中应用18F标记的PSMA PET/CT诊断前列腺癌区域淋巴结转移和分期的研究。两名研究者独立筛选文献、提取数据及评价文献质量。使用Meta-disc1.4和Stata16.0软件对数据进行Meta分析。
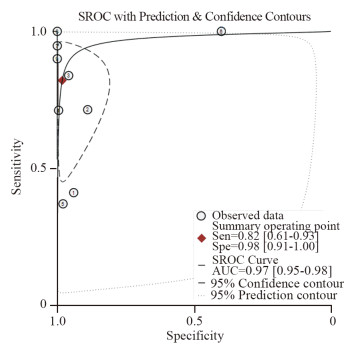
结果共纳入8篇文献,包括754例前列腺癌患者的2101枚淋巴结。Meta分析显示,合并敏感度、合并特异性、合并阳性似然比、合并阴性似然比及诊断比值比分别为0.82(95%CI: 0.61~0.93)、0.98(95%CI: 0.91~1.00)、45.7(95%CI: 9.0~231.3)、0.18(95%CI: 0.07~0.45)、251(95%CI: 34~1851)。综合受试者工作特征曲线下面积为0.97(95%CI: 0.95~0.98)。
结论18F标记的PSMA PET/CT对前列腺癌区域淋巴结转移具有较高的诊断价值。
Abstract:ObjectiveTo evaluate the diagnostic value of 18F-labeled PSMA PET/CT for regional lymph node metastasis in prostate cancer.
MethodsWe searched PubMed, Embase, Cochrane Library, Web of Science, CNKI, VIP and Wanfang database from January 1, 2000 to May 31, 2021 for the studies about the diagnosis of 18F-labeled PSMA PET/CT for regional lymph node metastasis and staging in prostate cancer. Two investigators screened literature, extracted relevant data and assessed the quality of the literature independently. The meta-analysis was performed using Meta-disc 1.4 and Stata 16.0 software.
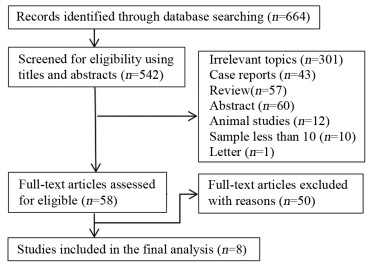
ResultsA total of 8 studies were finally included for the analysis, consisting of 754 prostate cancer patients and 2101 lymph nodes. The results of this meta-analysis showed pooled sensitivity, pooled specificity, pooled positive likelihood ratio, pooled negative likelihood ratio and diagnostic ratio were 0.82 (95%CI: 0.61-0.93), 0.98 (95%CI: 0.91-1.00), 45.7 (95%CI: 9.0-231.3), 0.18 (95%CI: 0.07-0.45) and 251 (95%CI: 34-1851), respectively. The area under the SROC curve was 0.97 (95%CI: 0.95-0.98).
Conclusion18F-labeled PSMA PET/CT has a high diagnostic value for regional lymph node metastasis in prostate cancer.
-
Key words:
- 18F /
- PSMA /
- PET/CT /
- Prostate cancer /
- Lymph node /
- Meta-analysis
-
0 引言
图像引导放射治疗(image guided radiation therapy, IGRT)已经成为恶性肿瘤治疗的重要手段之一,机载先进影像可以减小、校正患者的摆位误差,提高患者放疗的准确性[1-2]。目前基于三维IGRT已经成为主流,按能量可分为千伏级(kilovolt, kV)和兆伏级(megavolt, MV)[3],根据CT成像原理可分锥形束CT(cone beam CT, CBCT)和扇形束CT(fan beam CT, FBCT),FBCT的图像质量优于CBCT。一体化直线加速器机载的图像引导系统如联影直线加速器uRT 506c、CT-on-rail机载kV-FBCT[1]。虽然这种机载FBCT在线扫描时具有与诊断CT相似的图像质量[4-5],但kV-FBCT的中心与直线加速器治疗中心相距超过1米,导致采集kV影像时和放疗的时间之间有一定时间间隔,从而导致潜在的误差。因此,非等中心的kV影像清晰度是否能有效减低摆位误差、治疗计划体积(planning target volume, PTV)边界仍需要深入探索。南方医科大学深圳医院在2022年6月安装联影一体式直线加速器uRT-linac 506c并在肿瘤科开始投入使用,现回顾性分析该机器所配置的kV-FBCT和MV-CBCT校位数据,分析不同部位肿瘤患者在PTV各个方向的摆位误差和外放边界。
1 资料与方法
1.1 临床资料
收集2022年6月—2022年9月间在南方医科大学深圳医院肿瘤科行放射治疗的所有患者73例,剔除完成放射治疗≤3次的患者1例及照射上肢患者2例,共入组患者70例。其中男性36例、女性34例;年龄29~86岁,中位年龄58岁。根据照射部位不同将患者分为5个亚组:头颈组14例,胸部组(除乳腺)11例,乳腺组23例,上腹部组9例及盆腔组13例;行根治性放疗和辅助及新辅助放疗者33例,共计901例次,剂量范围:36~69.96 Gy,中位剂量60 Gy。姑息放疗37例,共计604例次,剂量范围:20~50 Gy,中位剂量30 Gy。所有患者均已签署知情同意书,该研究获得南方医科大学深圳医院伦理委员会的批准(NYSZYYEC20220029)。
1.2 体位固定及CT扫描
头颈组统一采用头颈肩面罩固定,仰卧位;其他组均为真空垫固定,仰卧位,肝脏肿瘤放疗需行腹部气囊加压固定,因患者不配合可以不做强制要求;盆腔组需适当充盈膀胱,排空直肠。模拟扫描CT为联影uCT-710,60排,孔径70 cm,扫描层厚:头颈部2 mm,胸腹部3 mm,电压均为120 kV;管电流:头颈部285 mAs,其余部位150 mAs。直线加速器机载kV-FBCT为24排16层诊断级立体等像素CT,孔径70 cm,扫描条件如下:电压均为120 kV;管电流:头颈部为20 mAs,胸腹部75 mAs;MV-CBCT扫描条件如下:1.5 MV-X线,头颈部直线加速器机器跳数为7.2,其余部位总跳数为9。
1.3 图像采集及配准
图像采集基于联影直线加速器uRT-linac 506c机载的图像引导系统,患者常规摆位后放疗前行kV-FBCT或MV-CBCT扫描,与计划CT图像配准,由加速器自带软件完成周围骨组织和PTV配准,技师和医师共同确认配准后分别记录配准中心点在患者左右(left-right, LR)、前后(anterior-posterior, AP)和头脚(superior-inferior, SI)方向的位移。共采集配准图像1 130例次,行kB-FBCT扫描1 025例次,MV-CBCT扫描105例次。其中头颈组195例次,扫描配准图像为4~33例次,中位值为11例次;胸部组168例次,扫描配准图像为6~23例次,中位值为15例次;乳腺组431人次,扫描配准图像为10~27例次,中位值为20例次;上腹部组128例次,扫描配准图像为4~22例次,中位值为15例次,盆腔组208例次,扫描配准图像为6~30例次,中位值为14例次。
1.4 摆位误差数据分析及计算
记录摆位误差LR、AP、SI三个方向的数值,在LR、AP和SI方向上均可获得不同的位移数值。在同一个方向上,对某一个患者的多次位移数值可计算其标准差(standard deviation, SD),当有n例患者时,则可计算n个SD。计算n例患者在单一方向上所有位移的平均值即为绝对位移偏差;根据n个SD值再计算其标准差即为系统误差(Σ),n例患者SD的均方根(

1.5 三维位移的分析及计算
三维位移为同一个患者当次治疗时左右、前后和头脚方向位移时三维空间欧几里得距离(

1.6 统计学方法
用微软Excel软件计算摆位误差及估计PTV边界。用SPSS20.0软件进行统计分析,Mann-Whitney U检验分析kV-FBCT与MV-CBCT图像引导在不同部位中三维位移差异,双侧以P < 0.05为差异有统计学意义。
2 结果
2.1 摆位误差
70例患者在治疗过程中进行摆位验证,采集kV-FBCT和MV-CBCT扫描图像共1 130例次,产生1 130组三维方向上的摆位误差数据。各组在三维方向上产生的平均位移及根据平均位移得出每组对应的系统误差及随机误差,各组平均位移:左右方向波动在-0.3~1.0 mm之间,前后方向波动在-0.5~0.5 mm之间,头脚方向波动在-1.2~1.0 mm之间,其中各组头脚方向位移变化最明显。各组系统误差:左右方向为0.5~1.9 mm,前后方向为0.5~1.5 mm,头脚方向为0.9~1.4 mm,随机误差:左右方向为1.2~2.8 mm,前后方向为0.9~2.3 mm,头脚方向为1.8~3.1 mm,见表 1。
表 1 70例患者kV-FBCT和MV-CBCT引导所得的不同解剖部位的三维方向摆位误差值(mm)Table 1 Set-up errors indifferent anatomical sites of 70 patients with kV-FBCT and MV-CBCT guidance (mm)
2.2 PTV外放边界及三维位移
根据推荐外扩PTV边界公式得出各组三维外放边界及三维位移,头颈组三维方向外放边界在1.9~3.1 mm,乳腺组在4.6~5.1 mm,上腹部组在3.0~5.5 mm,盆腔组在3.5~6.8 mm,见表 2。70例患者共记录到1 130例次位移偏差,各组患者3D位移散点图,见图 1。头颈组3D平均位移为2.4±1.0 mm,乳腺组为4.1±2.0 mm,盆腔组为4.6±2.1 mm,各组3D位移箱式图见图 2、表 2。
表 2 70例患者kV-FBCT和MV-CBCT测得的不同解剖部位各方向外扩边界及三维位移值(mm)Table 2 Estimated PTV margin and 3D displacements of the different anatomical sites in 70 patients from kV-FBCT and MV-CBCT in each direction (mm)
2.3 kV-FBCT和MV-CBCT三维位移结果
经两种不同机载图像引导系统分析摆位误差,计算得出kV-FBCT(非等中心IGRT)和MV-CBCT(等中心IGRT)组所有患者三维位移中位值分别为4.1 mm和3.4 mm,差异无统计学意义(P=0.212),见图 3、表 3。在不同部位的肿瘤IGRT中,乳腺癌的FBCT引导所导致的三维位移明显大于MV-CBCT,而在头颈部、胸腹部及盆腔肿瘤中两者的三维位移的差异未达到有统计学意义的水平。
![]() 图 3 kV-FBCT和MV-CBCT组所有患者三维位移箱式图Figure 3 The box plot of 3D displacement of all patients in kV-FBCT and MV-CBCT groupsThe median values of 3D displacement in the kV-FBCT and MV-CBCT groups were 4.1 and 3.4 mm, respectively. The median values of 3D displacement of breast group measured by kV-FBCT and MV-CBCT were 4.3 and 3.0 mm (P=0.039).表 3 不同图像引导方式的三维位移值(mm)Table 3 3D displacement values by different image-guiding methods (mm)
图 3 kV-FBCT和MV-CBCT组所有患者三维位移箱式图Figure 3 The box plot of 3D displacement of all patients in kV-FBCT and MV-CBCT groupsThe median values of 3D displacement in the kV-FBCT and MV-CBCT groups were 4.1 and 3.4 mm, respectively. The median values of 3D displacement of breast group measured by kV-FBCT and MV-CBCT were 4.3 and 3.0 mm (P=0.039).表 3 不同图像引导方式的三维位移值(mm)Table 3 3D displacement values by different image-guiding methods (mm)
3 讨论
本研究提示在直线加速器上加载具有诊断级清晰图像的FBCT可进行IGRT,除了提供高清晰的CT影像外,其摆位误差也令人满意。与等中心的MV-CBCT校正体位相比,非等中心的FBCT可带来潜在误差,本研究提示用FBCT进行IGRT需要在PTV边界可能额外增加1 mm的边界来补偿其不确定性,但仍需深入研究。
目前临床上应用最广泛的IGRT是CBCT,但它在图像质量、均匀性和解剖准确性等方面与FBCT相比均存在明显劣势[9],因此有文献表明FBCT更适合用于体内成像,同时与kV-CBCT相比,FBCT在扫描中患者实际接受的辐射剂量更低[9]。与MV-CBCT图像相比,kV-FBCT扫描图像更清晰[9],可更好地有效降低治疗时的体位误差,发现治疗期间肿瘤和正常组织的变化,从而为自适应放疗提供强有力的临床保证。理论上讲kV-FBCT图像清晰度提高可能会有效减少治疗摆位误差,而在本研究中暂未观察到这种结果,反而kV-FBCT三维位移比MV-CBCT大0.7 mm(4.1 mm vs. 3.4 mm),尽管两种CT的三维位移在数值上无统计学意义,但在临床实践中尤其在使用立体定向放射外科治疗技术时,0.7 mm误差也需要引起临床医师的足够重视。在亚组分析中发现乳腺组23例患者,其中有52%(12例)患者摆位验证交替使用了这两种技术,分别配准并采集图像为355例次和74例次,kV-FBCT三维位移大于MV-CBCT,可能是机载的kV-FBCT与MV射线并非同一个等中心,两者相距1 m以上,在从FBCT图像获取实施放射治疗的过程中有一定的时间与距离差,从而导致潜在的不确定性。提示如果采用FBCT进行IGRT,需要额外增加1 mm的PTV边界,从而导致更多的正常组织接受不必要的高剂量照射。
对于头颈部肿瘤来说,从每周1次的电子射野影像验证系统到每周1次的MV-CBCT验证,图像引导系统清晰度的提高能够更加精确的纠正摆位误差,可以使临床靶区外放边界从5 mm缩小到现在公认的3 mm[10]。本研究中头颈组14例患者每周至少3次以上kV-FBCT扫描,提示三维外放边界范围为1.9~3.1 mm,多次FBCT引导的前提下左右和前后方向仅需要外放2 mm就可能满足临床需要。Tan等[11]也同样认为在鼻咽癌放射治疗中2 mm的外扩边界足够覆盖 > 95%的几何范围,甚至认为如果在放疗的第3周行自适应放疗更改放疗计划,1 mm的外扩边界也是足够的,因此缩小外放边界可能更加精确地保护周围危及器官减轻放疗反应,而临床上我们通常采用的PTV均匀外放边界并非最佳,个体化的PTV可能更加合理,但需要进一步探索[12]。本研究也发现图像引导下乳腺组三维平均位移仅为2.4 mm,在左右、前后及头脚方向PTV外放边界分别为4.6、4.9及5.1 mm,系统误差为1.2~1.5 mm,与Donovan等[13]研究结果一致。
摆位误差最小化、放疗期间的有效运动管理、统一的靶区定义及最佳的PTV边界为放疗流程所关注的重点环节。很多学者利用各种先进的图像引导系统来确定CTV与PTV边界的关系[14-15],本研究发现头颈组的系统误差和随机误差均较小,三个方向均 < 2 mm,而且在头颈组和乳腺组中各方向外扩边界与三维外扩边界值近似,说明在某些部位采用某一固定数值外放成PTV边界可能是合理的,而且提示头颈组不需要每次照射前均行FBCT检验,这样使得临床操作简便,提高效率。但在上腹部组和盆腔组中由于各方向外扩与三维外扩边界值差异明显,需个体化三维方向而非均匀外放似乎更符合临床特点。
临床所需PTV的大小主要参照治疗单位各自的系统误差和随机误差的大小,并有数个不同的PTV计算公式[6]。也有剂量覆盖统计模型、肿瘤控制概率与正常组织并发症概率模型等[14],然而,这些模型的临床可靠性需要深入验证。随着计算机技术飞速发展,近年来开发了多种指标用于预测放疗期间肿瘤和正常组织的变化规律,从而实现PTV的个体化和可视化。本团队近年来所研发的一系列预测方法及模型,如基于三维影像的形状统计模型[11]、基于形变配准用于预测放疗期间的解剖变化从而实现在治疗设计中尽量减小PTV[16-18]。也有基于大数据、人工智能等机器学习模型、神经网络模型、支持向量机模型等,所有这些均仍需进一步临床验证[19-20]。
使用不同的图像引导系统来决定外放边界远远不足以满足目前精准放疗的临床需求,将不同的运动管理技术,器官形变特点与放疗具体部位相结合才能更加准确地确定PTV[21],本研究仅行图像引导系统来推测肿瘤外放边界有一定的局限性。腹部和盆腔由于脏器充盈程度的不同和器官在体内的相对运动可能造成较大误差,即使是同一部位也可以由于固定方式不同限制了运动幅度而导致摆位误差的变化。本研究中得出上腹部组(9例)和盆腔组(13例)三维位移相同(均为4.6 mm),可能是由于上腹部组行kV-FBCT8例和MV-CBCT1例,样本量偏少导致,临床实践中扩大样本量可能会得出不同的结果,但在各组患者中三维位移变化总体趋势均符合临床实践。本研究中绝大多数配准图像均采用kB-FBCT(占90%),MV-CBCT扫描数量不够,MV-CBCT初步使用临床经验有待提升。
综上所述,直线加速机载的kV-FBCT能取得和模拟CT相似质量的图像,最大的优点是可以获得患者治疗前实时的三维清晰图像,更准确地反映患者真实的空间体位,为更精准的自适应放疗创造了基础条件,在校验摆位误差方面可获得与MV-CBCT相似的可定量的摆位误差数据,均可为实施精准放疗提供参考。但非等中心的FBCT引导可能导致潜在的误差,需要在临床上特别关注并深入研究。
Competing interests: The authors declare that they have no competing interests.作者贡献:曾春媛:选题、文献检索与筛选、文献质量评价、数据提取、统计分析及论文撰写程勇:文献检索与筛选、文献质量评价、数据提取、论文修改徐浩:指导选题、论文修改与审校 -
表 1 纳入研究的基本特征
Table 1 Characteristics of included studies

表 2 18F标记的PSMA PET/CT诊断前列腺癌区域淋巴结转移的Meta回归分析结果
Table 2 Meta-regression analysis results of 18F-labeled PSMA PET/CT for diagnosis of regional lymph node metastasis in prostate cancer

-
[1] Siegel RL, Miller KD, Fuchs HE, et al. Cancer statistics, 2021[J]. CA Cancer J Clin, 2021, 71(1): 7-33. doi: 10.3322/caac.21654
[2] Ieiri K, Shiota M, Kashiwagi E, et al. The prognosis and the impact of radiotherapy in clinically regional lymph node-positive prostate cancer: which patients are candidates for local therapy with radiation?[J]. Urol Oncol, 2020, 38(12): 931. e1-931. e7. doi: 10.1016/j.urolonc.2020.08.018
[3] Hinsenveld FJ, Wit EMK, van Leeuwen PJ, et al. Prostate-specific membrane antigen PET/CT combined with sentinel node biopsy for primary lymph node staging in prostate cancer[J]. J Nucl Med, 2020, 61(4): 540-545. doi: 10.2967/jnumed.119.232199
[4] Zhang Q, Zang S, Zhang C, et al. Comparison of 68Ga-PSMA-11 PET-CT with mpMRI for preoperative lymph node staging in patients with intermediate to high-risk prostate cancer[J]. J Transl Med, 2017, 15(1): 230. doi: 10.1186/s12967-017-1333-2
[5] Maurer T, Gschwend JE, Rauscher I, et al. Diagnostic efficacy of 68Gallium-PSMA positron emission tomography compared to conventional imaging for lymph node staging of 130 consecutive patients with intermediate to high risk prostate cancer[J]. J Urol, 2016, 195(5): 1436-1443. doi: 10.1016/j.juro.2015.12.025
[6] Kesch C, Kratochwil C, Mier W, et al. 68Ga or 18F for prostate cancer imaging?[J]. J Nucl Med, 2017, 58(5): 687-688. doi: 10.2967/jnumed.117.190157
[7] Sanchez-Crespo A. Comparison of Gallium-68 and Fluorine-18 imaging characteristics in positron emission tomography[J]. Appl Radiat Isot, 2013, 76: 55-62. doi: 10.1016/j.apradiso.2012.06.034
[8] Giesel FL, Hadaschik B, Cardinale J, et al. F-18 labelled PSMA-1007: biodistribution, radiation dosimetry and histopathological validation of tumor lesions in prostate cancer patients[J]. Eur J Nucl Med Mol Imaging, 2017, 44(4): 678-688. doi: 10.1007/s00259-016-3573-4
[9] Jansen BHE, Bodar YJL, Zwezerijnen GLC, et al. Pelvic lymph-node staging with 18F-DCFPyL PET/CT prior to extended pelvic lymph-node dissection in primary prostate cancer-the SALT trial[J]. Eur J Nucl Med Mol Imaging, 2021, 48(2): 509-520. doi: 10.1007/s00259-020-04974-w
[10] Gorin MA, Rowe SP, Patel HD, et al. Prostate specific membrane antigen targeted 18F-DCFPyL positron emission tomography/computerized tomography for the preoperative staging of high risk prostate cancer: results of a prospective, phase Ⅱ, single center study[J]. J Urol, 2018, 199(1): 126-132. doi: 10.1016/j.juro.2017.07.070
[11] Malaspina S, Anttinen M, Taimen P, et al. Prospective comparison of 18F-PSMA-1007 PET/CT, whole-body MRI and CT in primary nodal staging of unfavourable intermediate- and high-risk prostate cancer[J]. Eur J Nucl Med Mol Imaging, 2021, 48(9): 2951-2959. doi: 10.1007/s00259-021-05296-1
[12] Sprute K, Kramer V, Koerber SA, et al. Diagnostic accuracy of 18F-PSMA-1007 PET/CT imaging for lymph node staging of prostate carcinoma in primary and biochemical recurrence[J]. J Nucl Med, 2021, 62(2): 208-213. doi: 10.2967/jnumed.120.246363
[13] Pienta KJ, Gorin MA, Rowe SP, et al. A phase 2/3 prospective multicenter study of the diagnostic accuracy of prostate specific membrane antigen PET/CT with 18F-DCFPyL in prostate cancer patients (OSPREY)[J]. J Urol, 2021, 206(1): 52-61. doi: 10.1097/JU.0000000000001698
[14] Lindenberg L, Mena E, Turkbey B, et al. Evaluating biochemically recurrent prostate cancer: histologic validation of 18F-DCFPyL PET/CT with comparison to multiparametric MRI[J]. Radiology, 2020, 296(3): 564-572. doi: 10.1148/radiol.2020192018
[15] 刘亚超, 刘家金, 张晓军, 等. 18F-DCFPyL PET/CT术前诊断前列腺癌区域转移淋巴结[J]. 中国医学影像技术, 2020, 36(6): 868-872. https://www.cnki.com.cn/Article/CJFDTOTAL-ZYXX202006020.htm Liu YC, Liu JJ, Zhang XJ, et al. 18F-DCFPyL PET/CT in pre-operative diagnosis of regional lymph node metastasis from prostate cancer[J]. Zhongguo Yi Xue Ying Xiang Ji Shu, 2020, 36 (6): 868-872. https://www.cnki.com.cn/Article/CJFDTOTAL-ZYXX202006020.htm
[16] Whiting PF, Rutjes AW, Westwood ME, et al. QUADAS-2: a revised tool for the quality assessment of diagnostic accuracy studies[J]. Ann Intern Med, 2011, 155(8): 529-536. doi: 10.7326/0003-4819-155-8-201110180-00009
[17] Nini A, Gandaglia G, Fossati N, et al. Patterns of clinical recurrence of node-positive prostate cancer and impact on long-term survival[J]. Eur Urol, 2015, 68(5): 777-784. doi: 10.1016/j.eururo.2015.04.035
[18] Trabulsi EJ, Rumble RB, Jadvar H, et al. Optimum imaging strategies for advanced prostate cancer: ASCO guideline[J]. J Clin Oncol, 2020, 38(17): 1963-1996. doi: 10.1200/JCO.19.02757
[19] Kim SJ, Lee SW, Ha HK. Diagnostic performance of radiolabeled prostate-specific membrane antigen positron emission tomography/computed tomography for primary lymph node staging in newly diagnosed intermediate to high-risk prostate cancer patients: a systematic review and meta-analysis[J]. Urol Int, 2019, 102(1): 27-36. doi: 10.1159/000493169
[20] Tu X, Zhang C, Liu Z, et al. The role of 68Ga-PSMA positron emission tomography/computerized tomography for preoperative lymph node staging in intermediate/high risk patients with prostate cancer: a diagnostic meta-analysis[J]. Front Oncol, 2020, 10: 1365. doi: 10.3389/fonc.2020.01365
[21] Dietlein F, Kobe C, Hohberg M, et al. Intraindividual comparison of 18F-PSMA-1007 with renally excreted PSMA ligands for PSMA PET imaging in patients with relapsed prostate cancer[J]. J Nucl Med, 2020, 61(5): 729-734. doi: 10.2967/jnumed.119.234898
[22] Giesel FL, Knorr K, Spohn F, et al. Detection efficacy of 18F-PSMA-1007 PET/CT in 251 patients with biochemical recurrence of prostate cancer after radical prostatectomy[J]. J Nucl Med, 2019, 60(3): 362-368. doi: 10.2967/jnumed.118.212233
[23] Gaur S, Mena E, Harmon SA, et al. Prospective evaluation of 18F-DCFPyL PET/CT in detection of high-risk localized prostate cancer: comparison with mpMRI[J]. AJR Am J Roentgenol, 2020, 215(3): 652-659. doi: 10.2214/AJR.19.22042
[24] Wondergem M, van der Zant FM, Broos WAM, et al. 18F-DCFPyL PET/CT for primary staging in 160 high-risk prostate cancer patients; metastasis detection rate, influence on clinical management and preliminary results of treatment efficacy[J]. Eur J Nucl Med Mol Imaging, 2021, 48(2): 521-531. doi: 10.1007/s00259-020-04782-2
[25] Hövels AM, Heesakkers RA, Adang EM, et al. The diagnostic accuracy of CT and MRI in the staging of pelvic lymph nodes in patients with prostate cancer: a meta-analysis[J]. Clin Radiol, 2008, 63(4): 387-395. doi: 10.1016/j.crad.2007.05.022
-
期刊类型引用(5)
1. 苗凌肖, 赵金叶, 李恒, 单凤姣, 张翠红. CBCT图像引导下负压气垫和热塑体膜在腹盆腔肿瘤放疗中的摆位误差比较及体质量指数对复位通过率的影响. 医疗卫生装备. 2025(07)  百度学术
百度学术
2. 王建林,张天,张文君,胡强. 基于机械性能检测分析VitalBeam型直线加速器输出剂量的稳定性评估及故障案例分析. 中国医学装备. 2024(06): 209-213 .  百度学术
百度学术
3. 赵亮,马超,闵骁,熊兵,吴炎,杨爱民. 基于锥形束CT研究不同部位计划靶区外放边界. 现代肿瘤医学. 2024(18): 3549-3555 .  百度学术
百度学术
4. 周军,李寒旭,黄志兵,万久庆,李东春,钟良志. CBCT和EXT图像引导系统在高级别脑胶质瘤放疗中的应用分析. 医疗卫生装备. 2024(08): 57-62 .  百度学术
百度学术
5. 陈文强,赵军军,李扬,袁慧杰. 对比和分析腹部肿瘤影像引导放疗中千伏级锥形束CT与兆伏级电子摄像系统的应用效果. 影像研究与医学应用. 2024(23): 181-183 .  百度学术
百度学术
其他类型引用(0)



 下载:
下载: