Correlation Between Peripheral Blood Biomarkers and Efficacy of PD-1/PD-L1 Inhibitors Treatment on Lung Cancer
-
摘要:目的
研究外周血生物标志物对接受PD-1/PD-L1抑制剂治疗的肺癌患者疗效的预测及指导意义。
方法收集接受PD-1/PD-L1抑制剂治疗的200例肺癌患者的资料,包括临床指标、外周血指标、疗效指标及生存指标等。
结果无肝转移、免疫联合化疗、NLR≤2.81、LDH≤202.5 u/L患者的疾病控制率(DCR)更高(P < 0.05)。NLR联合LDH预测DCR的AUC值为0.698(P < 0.05)。单因素分析示无肝转移、一线免疫治疗、免疫联合化疗、LDH≤202.5 u/L均与PFS有关(P < 0.05)。多因素分析示无肝转移、LDH≤202.5 u/L患者的PFS更长(P < 0.05)。探索性分析示两周期免疫治疗后NLR、LDH的明显下降提示免疫治疗的有效性(P < 0.05)。
结论NLR≤2.81、LDH≤202.5 u/L、无肝转移、免疫联合化疗与免疫治疗疗效呈正相关,且无肝转移、LDH≤202.5 u/L是接受免疫治疗患者的独立预后因素。另外,外周血NLR、LDH的变化与PD-1/PD-L1抑制剂的疗效相关。
Abstract:ObjectiveTo investigate the predictive and guiding significance of peripheral blood biomarkers on the therapeutic effects of PD-1/PD-L1 inhibitor treatment on lung cancer patients.
MethodsWe collected the data of 200 lung cancer patients treated with PD-1/PD-L1 inhibitors treatment, including clinical indicators, peripheral blood indicators, efficacy indicators and survival indicators.
ResultsThe DCR of patients with non-hepatic metastasis, immune combined chemotherapy, NLR≤2.81 and LDH≤202.5 u/L was higher (P < 0.05). The AUC value of NLR combined with LDH predicting DCR was 0.698 (P < 0.05). Univariate analysis showed that non-hepatic metastasis, first-line immunotherapy, immunotherapy combined with chemotherapy and LDH≤202.5 u/L were related to PFS (P < 0.05). Multivariate analysis showed that the patients with non-hepatic metastasis and LDH≤202.5 u/L had longer PFS (P < 0.05). The significant decrease of NLR and LDH after two cycles of immunotherapy indicated the effectiveness of immunotherapy (P < 0.05).
ConclusionNLR≤2.81, LDH≤202.5 u/L, non-hepatic metastasis and immunotherapy combined chemotherapy are positively correlated with immunotherapy efficacy. Non-hepatic metastasis and LDH≤202.5 u/L are independent prognostic factors of the patients treated with immunotherapy. The changes of peripheral blood NLR and LDH are related to the efficacy of PD-1/PD-L1 inhibitors treatment.
-
Key words:
- Lung cancer /
- Immune checkpoint inhibitors /
- Peripheral blood markers /
- Efficacy /
- Survival
-
0 引言
肺癌是全世界死亡率最高的恶性肿瘤[1],晚期肺癌的治疗已进入以免疫检查点抑制剂(immune checkpoint inhibitors, ICIs)为代表的治疗时代,但实际上免疫治疗的获益人群仅占晚期非小细胞肺癌(non-small cell lung cancer, NSCLC)的20%左右[2]。PD-L1、肿瘤突变负荷(tumor mutation burden, TMB)等一系列临床现有的指导免疫治疗用药的生物标志物未能满足筛选免疫治疗获益群体的需求,因此需要进一步探索更加经济、便捷的指标。外周血液学检测技术简便,可以实现肿瘤实时监测及预后判断,因此,外周血生物标志物的发展前景巨大[3]。炎性反应细胞可促进肿瘤发展,研究发现中性粒细胞绝对值(absolute neutrophil count, ANC)、淋巴细胞计数(absolute lymphocyte count, ALC)、嗜酸性粒细胞计数(absolute eosinophil count, AEC)与ICI治疗的预后相关[4]。癌细胞通过许多生长因子、趋化因子、白细胞介素与微环境进行通讯,研究显示IL-6、C反应蛋白(C-reaction protein, CRP)与免疫治疗的疗效有关[5]。但这些研究还处于初步探索阶段,因此本研究回顾性分析临床指标和外周血指标与肺癌患者接受ICI治疗疗效的相关性,以期探索预测免疫治疗疗效的指标。
1 资料与方法
1.1 研究对象
选取2018年1月—2021年1月在昆明医科大学第三附属医院接受PD-1/PD-L1免疫检查点抑制剂治疗的200例肺癌患者资料,包括籍贯、性别、年龄、吸烟状态、病理类型、临床分期、有无肝转移、ICI的选用情况、治疗线数、治疗方案、表皮酪氨酸激酶受体(epidermal growth factor receptor, EGFR)突变状态、免疫治疗前及免疫治疗两周期后外周血指标。
1.2 研究方法
外周血指标由云南省肿瘤医院检验科进行检测,项目包括CD45CD3、CD4/CD8、ANC(109/L)、ALC(109/L)、单核细胞绝对值(absolute monocytes count, AMC)(109/L)、血小板(platelet, PLT)(109/L)、NLR、淋巴细胞/单核细胞比值(lymphocyte-to-monocyte ratio, LMR)、血小板/淋巴细胞比值(platelet-to-lymphocyte ratio, PLR)、碱性磷酸酶(alkaline phosphates, ALP)(u/L)、LDH(u/L)、纤维蛋白原(fibrinogen, FIB)(u/L)、γ-干扰素(interferon-γ, IFN-γ)(pg/ml)、肿瘤坏死因子-α(tumor necrosis factor, TNF)(pg/ml)、白细胞介素-6(interleukin-6, IL-6)(pg/ml)。
PD-1抑制剂:纳武利尤单抗、帕博利珠单抗、信迪利单抗、特瑞普利单抗、卡瑞利珠单抗; PD-L1抑制剂:阿特珠单抗、德瓦鲁单抗。
免疫联合治疗模式:免疫单药、免疫联合化疗、免疫联合抗血管治疗、免疫联合化疗联合抗血管治疗。
1.3 疗效评价
免疫治疗两周期后进行评价,包括胸部增强计算机断层扫描(computed tomography, CT)以及转移部位影像学检查。按照实体瘤客观疗效评价标准(Response Evaluation Criteria in Solid Tumors, RECIST)1.1版进行疗效评估,分为完全缓解(complete response, CR)、部分缓解(partial response, PR)、疾病稳定(stable disease, SD)及疾病进展(progressive disease, PD),计算客观缓解率(objective response rate, ORR)及疾病控制率(disease control rate, DCR)。PFS定义为治疗开始到疾病进展或者死亡的时间。
1.4 统计学方法
使用SPSS25.0统计软件对临床指标和外周血指标进行回顾性数据分析。疗效分析中,单因素分析采用χ2检验, 多因素分析采用Logistic回归分析,受试者工作曲线(ROC)计算联合指标的曲线下面积(AUC),探究联合指标对免疫治疗疗效的预测价值。生存分析中,单因素分析采用Kaplan-Meier方法,多因素分析采用Cox比例风险回归模型。治疗前后外周血液学指标与疗效相关性采用非参数检验中两个相关样本的Wilcoxon方法进行比较,P < 0.05为差异有统计学意义。
2 结果
2.1 患者临床特征
本研究共入组200例患者,临床指标与免疫治疗疗效相关性见表 1。
表 1 入组患者临床指标与免疫治疗疗效的相关性Table 1 Correlation between clinical indicators and efficacy of immunotherapy on included patients
2.2 外周血指标与免疫治疗疗效的关系
2.2.1 单因素分析
收集外周血指标,取其中位数为临界值,结果显示,NLR≤2.81与DCR有统计学差异(P < 0.05),LDH≤202.5 u/L与DCR有统计学差异(P < 0.05)。其余指标与疗效之间并无明显相关性,见表 2。
表 2 入组患者外周血指标与免疫治疗疗效的相关性Table 2 Correlation between peripheral blood indexes and curative effect of immunotherapy on included patients
2.2.2 多因素分析
将影响疗效的单因素分析中有统计学意义的变量因素纳入Logistic多因素回归分析模型,包括有无肝转移、PD-1/PD-L1抑制剂、免疫治疗线数、免疫治疗方案、NLR、LDH。DCR为反应变量。结果显示,无肝转移、免疫联合化疗、NLR≤2.81、LDH≤202.5 u/L的疗效更佳,见表 3。
表 3 入组患者免疫治疗疗效及预后的多因素分析Table 3 Multivariate analysis of curative effect and prognosis of included patients
2.2.3 联合指标对疗效的预测价值
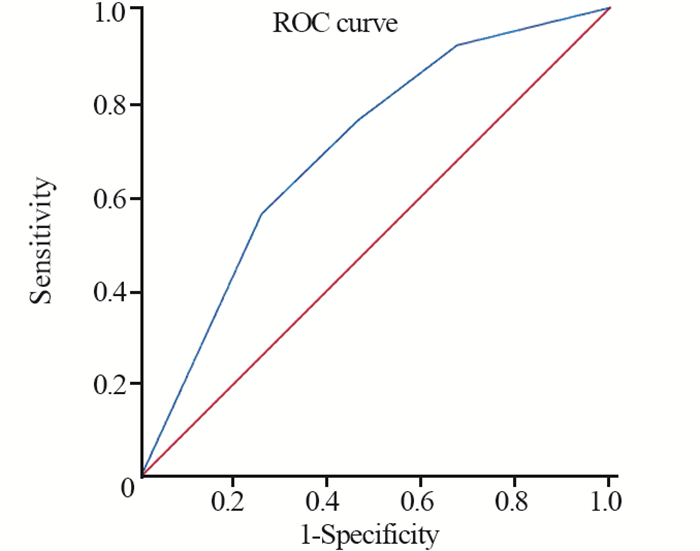
将疗效的多因素分析中有意义的NLR与LDH指标进行联合,使用Logistic回归分析求出预测概率P,最后对P进行ROC曲线面积分析。结果显示,NLR联合LDH的AUC为0.698(95%CI: 0.595~0.801)(P=0.001),见图 1。
2.3 临床指标及外周血指标与预后的关系
2.3.1 单因素分析
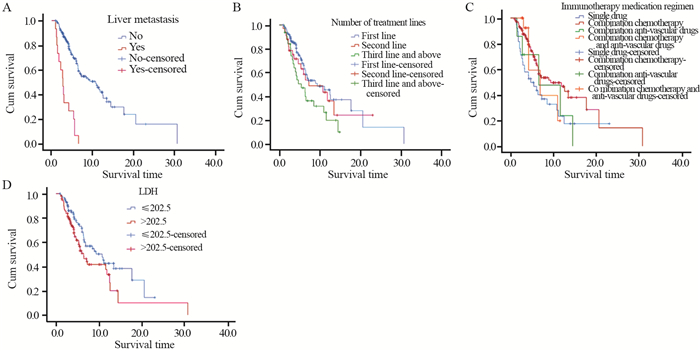
所有患者中位PFS为7.3月,无肝转移患者较肝转移患者PFS明显延长(10.7月vs. 2.7月,P=0.000); 接受一线免疫治疗的患者较接受三线及以上治疗的患者PFS明显延长(9.3月vs. 5.4月,P=0.042); 接受免疫联合化疗治疗的患者较免疫单药治疗的患者PFS明显延长(9.3月vs. 4.7月,P=0.038); 免疫治疗前LDH≤202.5 u/L的患者较LDH > 202.5 u/L的患者PFS明显延长(10.7月vs. 6.4月,P=0.031),见图 2。
2.3.2 多因素分析
将单因素分析中有意义的指标纳入Cox多因素生存分析,包括有无肝转移、免疫治疗线数、免疫治疗方案、LDH。结果显示,无肝转移、LDH≤202.5 u/L的患者的PFS更长,见表 3。
2.4 免疫治疗前后外周血指标变化与疗效的相关性
对各疗效组治疗前后外周血指标进行分析,结果显示,部分缓解组(PR):ANC、PLT、NLR、FIB、LDH、IL-6在两周期治疗后较治疗前明显下降(P < 0.05); 无缓解组(SD+PD):ANC、PLT、NLR、FIB在两周期治疗后较治疗前降低(P < 0.05)。疾病控制组(PR+SD):ANC、PLT、NLR、FIB在两周期治疗后较治疗前明显下降(P < 0.05); 疾病进展组(PD):ALP在两周期治疗后较治疗前明显升高(P < 0.05),见表 4。
表 4 不同分组免疫治疗前后的外周血指标(中位数)Table 4 Peripheral blood indexes of different groups before and after immunotherapy (median)
3 讨论
ICI在肺癌的治疗中已经取得了重大的成果。目前,肿瘤组织PD-L1表达含量是比较公认的疗效预测标志物[6-8],TMB在近几年的指南中也被列为免疫疗法的推荐检测方法[9],然而上述疗效预测标志物却受限于肿瘤组织的获取。外周血液与原发肿瘤具有同源性,且操作简单易于实时评估,潜在的临床应用价值高。因此,探索外周血生物标志物预测免疫治疗的疗效很有必要。
研究表明[10],慢性炎性反应能够抑制机体免疫反应相关途径,促进肿瘤转移,外周血细胞可一定程度上反映机体免疫状态的动态变化。肿瘤细胞的生长会产生乳酸,LDH参与催化此过程[11]。一项荟萃分析评估1 700例接受PD-1/PD-L1抑制剂治疗的NSCLC患者NLR的预测和预后价值,结果表明血液NLR升高与患者PFS和OS缩短相关[12]。本研究与Diem等[13]研究结果显示的高NLR联合高LDH可能是NSCLC免疫治疗疗效的负性预测因子一致。一项荟萃分析纳入1 136例接受免疫治疗的晚期NSCLC患者,显示LDH升高的患者PFS和OS相对较短[14]。本研究中也观察到免疫治疗前LDH≤202.5 u/L的患者较LDH > 202.5 u/L的患者PFS明显延长(中位PFS 10.7 vs. 6.4月,P=0.031)。
既往研究发现肿瘤患者体内TNF-α含量明显升高,是促进肿瘤的生长、扩散及血管生成的重要因子[15]。IFN-γ主要来源于活化的T细胞和NK细胞[16-17],可增强机体抗肿瘤能力。IL-6可能在肿瘤发生发展过程中发挥促炎作用[18]。本研究中未观察到IFN-γ、TNF-α、IL-6指标与疗效预后的相关性,可能与样本量偏少有关。T细胞在肿瘤免疫过程中起主导作用[19],在肿瘤微环境中可辩识肿瘤原位或外周血中的抗原表位的CD8+T细胞常常被消灭[20],进而使肿瘤逃逸宿主免疫系统。本研究中未观察到CD45CD3、CD4/CD8与疗效预后的相关性,也可能与样本量偏少有关。
本研究进一步探索了外周血指标的变化与疗效的关系,显示部分缓解组ANC、PLT、NLR、FIB、LDH、IL-6在两周期免疫治疗后较治疗前大幅度下降,差异有统计学意义; 疾病控制组ANC、PLT、NLR、FIB在两周期免疫治疗后较治疗前明显下降,差异有统计学意义; 疾病进展组ALP在两周期治疗后较治疗前明显升高,差异有统计学意义。本研究中纳入了免疫联合化疗的病例,考虑到化疗的不良反应也会引起ANC、PLT、IL-6指标的下降,因此,本研究仅认为NLR、LDH的变化与免疫治疗的疗效相关。
化疗药物使肿瘤细胞死亡,释放免疫原性物质,激活cGAS-STING途径[21],产生抗肿瘤免疫反应,而抗血管生成药物参与肿瘤微环境的调节[22],研究[7, 23-24]发现免疫治疗与其他治疗联合后可以更好地发挥治疗作用。本研究显示免疫联合化疗相较于免疫单药有更好的疗效。接受免疫联合化疗的患者较免疫单药的患者PFS明显延长(中位PFS 9.3月vs. 4.7月,P=0.038)。研究显示ICI早期介入治疗患者有明显的生存获益。本研究也观察到接受一线免疫治疗的患者较接受三线及以上治疗的患者PFS明显延长(中位PFS 9.3月vs. 5.4月,P=0.042)。
综上所述,NLR≤2.81、LDH≤202.5 u/L、无肝转移、免疫联合化疗与免疫治疗疗效呈正相关,其中NLR与LDH联合预测疗效的价值更高,且无肝转移、LDH≤202.5 u/L是免疫治疗的独立预后因素。另外,探索性研究结果提示外周血指标NLR、LDH的变化与PD-1/PD-L1抑制剂的疗效相关。
本研究存在一定局限性:首先,本研究为回顾性研究,由于各方面因素,大部分病例无法获得OS,因此,仅对PFS展开研究,并且达到终点事件的患者仅90例(45%),未达到终点事件的患者中有34例(17%)失访; 其次,混杂因素多,样本量小,未进行进一步的分层分析,未来需要更多前瞻性临床研究来证实。
Competing interests: The authors declare that they have no competing interests.作者贡献:柯萍:设计研究方案,收集、统计数据,撰写和修改论文江波:指导研究方案设计,修改论文何文杰、涂长玲:指导研究实施聂俊、朱颖:指导统计分析尹庆、孙蕊柱:收集数据 -
表 1 入组患者临床指标与免疫治疗疗效的相关性
Table 1 Correlation between clinical indicators and efficacy of immunotherapy on included patients

表 2 入组患者外周血指标与免疫治疗疗效的相关性
Table 2 Correlation between peripheral blood indexes and curative effect of immunotherapy on included patients

表 3 入组患者免疫治疗疗效及预后的多因素分析
Table 3 Multivariate analysis of curative effect and prognosis of included patients

表 4 不同分组免疫治疗前后的外周血指标(中位数)
Table 4 Peripheral blood indexes of different groups before and after immunotherapy (median)

-
[1] The Lancet. GLOBOCAN 2018: counting the toll of cancer[J]. Lancet, 2018, 392(10152): 985. doi: 10.1016/S0140-6736(18)32252-9
[2] Remon J, Chaput N, Planchard D. Predictive biomarkers for programmed death-1/programmed death ligand immune checkpoint inhibitors in nonsmall cell lung cancer[J]. Curr Opin Oncol, 2016, 28(2): 122-129. doi: 10.1097/CCO.0000000000000263
[3] Friedrich MJ. Going With the Flow: The Promise and Challenge of Liquid Biopsies[J]. JAMA, 2017, 318(12): 1095-1097. doi: 10.1001/jama.2017.10203
[4] Tanizaki J, Haratani K, Hayashi H, et al. Peripheral Blood Biomarkers Associated with Clinical Outcome in Non-Small Cell Lung Cancer Patients Treated with Nivolumab[J]. J Thorac Oncol, 2018, 13(1): 97-105. doi: 10.1016/j.jtho.2017.10.030
[5] Ozawa Y, Amano Y, Koyauchi T, et al. P2.07-022 Inflammatory Cytokine Induction after Anti-PD-1 Ab Administration Relates to the Efficacy and Safety in Patients with Non-Small Cell Lung Cancer[J]. J Thorac Oncol, 2017, 12(11): S2423-S2424. http://europepmc.org/abstract/MED/28748816
[6] Reck M, Rodríguez-Abreu D, Robinson AG, et al. Pembrolizumab versus Chemotherapy for PD-L1-Positive Non-Small-Cell Lung Cancer[J]. N Engl J Med, 2016, 375(19): 1823-1833. doi: 10.1056/NEJMoa1606774
[7] Paz-Ares L, Vicente D, Tafreshi A, et al. A Randomized, Placebo-Controlled Trial of Pembrolizumab Plus Chemotherapy in Patients With Metastatic Squamous NSCLC: Protocol-Specified Final Analysis of KEYNOTE-407[J]. J Thorac Oncol, 2020, 15(10): 1657-1669. doi: 10.1016/j.jtho.2020.06.015
[8] Gandhi L, Rodríguez-Abreu D, Gadgeel S, et al. Pembrolizumab plus Chemotherapy in Metastatic Non-Small-Cell Lung Cancer[J]. N Engl J Med, 2018, 378(22): 2078-2092. doi: 10.1056/NEJMoa1801005
[9] 曾大雄, 黄建安. 美国国家综合癌症网络非小细胞肺癌指南2019 V1版更新要点解读[J]. 世界临床药物, 2019, 40(1): 1-5. https://www.cnki.com.cn/Article/CJFDTOTAL-GWHH201901001.htm Zeng DX, Huang JA. Interpretation of the updated "National Comprehensive Cancer Network Guidelines for non-small cell lung cancer" (2019 V1 Ed. )[J]. Shi Jie Lin Chuang Yao Wu, 2019, 40(1): 1-5. https://www.cnki.com.cn/Article/CJFDTOTAL-GWHH201901001.htm
[10] Khan S, Jain M, Mathur V, et al. Chronic Inflammation and Cancer: Paradigm on Tumor Progression, Metastasis and Therapeutic Intervention[J]. Gulf J Oncol, 2016, 1(20): 86-93. http://europepmc.org/abstract/MED/27050184
[11] Zhang Z, Li Y, Yan X, et al. Pretreatment lactate dehydrogenase may predict outcome of advanced non small-cell lung cancer patients treated with immune checkpoint inhibitors: A meta-analysis[J]. Cancer Med, 2019, 8(4): 1467-1473. doi: 10.1002/cam4.2024
[12] de Jong MC, Mihai R, Khan S. Neutrophil-to-Lymphocyte Ratio (NLR) and Platelet-to-Lymphocyte Ratio (PLR) as Possible Prognostic Markers for Patients Undergoing Resection of Adrenocortical Carcinoma[J]. World J Surg, 2021, 45(3): 754-764. doi: 10.1007/s00268-020-05868-6
[13] Diem S, Schmid S, Krapf M, et al. Neutrophil-to-Lymphocyte ratio (NLR) and Platelet-to-Lymphocyte ratio (PLR) as prognostic markers in patients with non-small cell lung cancer (NSCLC) treated with nivolumab[J]. Lung Cancer, 2017, 111: 176-181. doi: 10.1016/j.lungcan.2017.07.024
[14] Jiang T, Bai Y, Zhou F, et al. Clinical value of neutrophil-to-lymphocyte ratio in patients with non-small-cell lung cancer treated with PD-1/PD-L1 inhibitors[J]. Lung Cancer, 2019, 130: 76-83. doi: 10.1016/j.lungcan.2019.02.009
[15] Bian Y, Li W, Kremer DM, et al. Cancer SLC43A2 alters T cell methionine metabolism and histone methylation[J]. Nature, 2020, 585(7824): 277-282. doi: 10.1038/s41586-020-2682-1
[16] Keating SE, Zaiatz-Bittencourt V, Loftus RM, et al. Metabolic Reprogramming Supports IFN-γ Production by CD56bright NK Cells[J]. J Immunol, 2016, 196(6): 2552-2560. doi: 10.4049/jimmunol.1501783
[17] Salerno F, Guislain A, Cansever D, et al. TLR-Mediated Innate Production of IFN-γ by CD8+ T Cells Is Independent of Glycolysis[J]. J Immunol, 2016, 196(9): 3695-3705. doi: 10.4049/jimmunol.1501997
[18] Del Campo JA, Gallego P, Grande L. Role of inflammatory response in liver diseases: Therapeutic strategies[J]. World J Hepatol, 2018, 10(1): 1-7. doi: 10.4254/wjh.v10.i1.1
[19] Huffman AP, Lin JH, Kim SI, et al. CCL5 mediates CD40-driven CD4+ T cell tumor infiltration and immunity[J]. JCI Insight, 2020, 5(10): e137263. doi: 10.1172/jci.insight.137263
[20] Maimela NR, Liu S, Zhang Y. Fates of CD8+ T cells in Tumor Microenvironment[J]. Comput Struct Biotechnol J, 2018, 17: 1-13. http://europepmc.org/articles/PMC6297055/pdf/main.pdf
[21] Wang Z, Chen J, Hu J, et al. cGAS/STING axis mediates a topoisomerase Ⅱ inhibitor-induced tumor immunogenicity[J]. J Clin Invest, 2019, 129(11): 4850-4862. doi: 10.1172/JCI127471
[22] Jiang X, Wang J, Deng X, et al. The role of microenvironment in tumor angiogenesis[J]. J Exp Clin Cancer Res, 2020, 39(1): 204. doi: 10.1186/s13046-020-01709-5
[23] Pacheco J, Bunn PA. Advancements in Small-cell Lung Cancer: The Changing Landscape Following IMpower-133[J]. Clin Lung Cancer, 2019, 20(3): 148-160.e2. doi: 10.1016/j.cllc.2018.12.019
[24] Fournel L, Wu Z, Stadler N, et al. Cisplatin increases PD-L1 expression and optimizes immune check-point blockade in non-small cell lung cancer[J]. Cancer Lett, 2019, 464: 5-14. doi: 10.1016/j.canlet.2019.08.005
-
期刊类型引用(4)
1. 董子瑜,汪超. 炎症标记物对结直肠癌术后转移患者抗PD-L1免疫治疗效果的预测作用分析. 中国中西医结合消化杂志. 2023(01): 56-60 .  百度学术
百度学术
2. 王培伟,翁一鸣,崔雪,彭敏. 外周血生物标志物与免疫检查点抑制剂治疗晚期食管癌疗效的相关性. 肿瘤防治研究. 2023(01): 58-62 .  本站查看
本站查看
3. 袁燕玲,唐武兵,童丽华,刘敏东,杨文. 预后营养指数与淋巴细胞-单核细胞比值、中性粒细胞-淋巴细胞比值对非小细胞肺癌治疗评价及预后分析. 肿瘤代谢与营养电子杂志. 2023(02): 262-269 .  百度学术
百度学术
4. 李改英,李薇,苏延军. 程序性死亡受体1抑制剂治疗晚期肺癌患者的临床疗效和安全性. 癌症进展. 2023(11): 1246-1248+1260 .  百度学术
百度学术
其他类型引用(6)



 下载:
下载: