Relation Between EB Virus Infection and Curative Effect, Prognosis of Patients with Early-stage Extranodal Nasal-type NK/T-cell Lymphoma
-
摘要:目的
探讨早期结外鼻型NK/T细胞淋巴瘤(ENKTCL)患者治疗前EBV DNA载量、治疗前血清EA-IgA及VCA-IgA抗体水平与临床特征、治疗反应及预后的关系。
方法分析78例早期结外鼻型NK/T细胞淋巴瘤患者的临床特征及影响预后的因素。
结果治疗前EBV DNA、VCA-IgA、EA-IgA阳性率分别为43.6%、20.5%、14.1%。EBV DNA与Ann Arbor分期、原发部位、PTI、治疗后未获得CR显著相关(均P < 0.05)。VCA-IgA、EA-IgA滴度分别与EBV DNA、治疗后未获得CR显著相关(均P < 0.05)。多因素分析发现年龄、EBV DNA、治疗后未获得CR为早期ENKTCL患者OS的独立预后因素(均P < 0.05);年龄、EBV DNA、原发鼻腔外上呼吸消化道、治疗后未获得CR(均P < 0.05)则为早期ENKTCL患者PFS的独立预后因素。
结论治疗前EBV DNA阳性与较晚的Ann Arbor分期、PTI、原发鼻腔外上呼吸消化道、治疗反应差有关。EA-IgA、VCA-IgA水平升高与EBV DNA阳性、治疗反应差有关。治疗前EBV DNA可用于ENKTCL的风险分层及预后预测,而EA-IgA、VCA-IgA对于ENKTCL的预后指导作用有限。
-
关键词:
- 鼻型结外NK/T细胞淋巴瘤 /
- EB病毒 /
- 预后
Abstract:ObjectiveTo explore the correlation of pretreatment EBV DNA load, EBV EA-IgA and VCA-IgA antibodies levels with the clinical characteristics, curative effect and prognosis of the patients with early-stage extranodal nasal-type NK/T-cell lymphoma (ENKTCL).
MethodsWe analyzed the clinical features and prognostic factors of 78 ENKTCL patients.
ResultsPositive rates of pretreatment EBV DNA, VCA-IgA and EA-IgA were 43.6%, 20.5% and 14.1%, respectively. EBV DNA was significantly associated with Ann Arbor stage, primary site, PTI and non-CR (all P < 0.05). VCA-IgA and EA-IgA were related to positive EBV DNA and non-CR (all P < 0.05). Multivariate analysis showed that age, EBV DNA and non-CR were independent prognostic factors for OS (all P < 0.05); age, EBV DNA, primary site and non-CR were independent prognostic factors for PFS (all P < 0.05).
ConclusionThe pretreatment positive EBV DNA is related to advanced Ann Arbor stage, PTI, primary extra-nasal subtypes of upper aerodigestive tract and poor response to treatment. The elevated levels of EA-IgA and VCA-IgA are related to positive EBV DNA and poor response to treatment. Pretreatment EBV DNA could be used for risk stratification and prognosis prediction of ENKTCL, while EA-IgA and VCA-IgA play limited role in guiding the prognosis of ENKTCL.
-
Key words:
- Extranodal nasal-type NK/T-cell lymphoma /
- Epstein-Barr virus /
- Prognosis
-
0 引言
结外NK/T细胞淋巴瘤是一种较为常见的淋巴瘤亚型,约占我国所有非霍奇金淋巴瘤的6.4%[1]。大多数结外NK/T细胞淋巴瘤起源于上呼吸消化道[2],被称为结外鼻型NK/T细胞淋巴瘤(extranodal nasal-type natural killer/T-cell lymphoma, ENKTCL)。多数患者发现时为早期,且与EB病毒(Epstein-Barr virus, EBV)感染密切相关[3]。
EBV在ENKTCL中主要表现为Ⅱ型潜伏感染及病毒基因高表达,可以通过EBER原位杂交检测[4]。目前有研究认为EBV DNA水平升高与不良预后相关[5-7],但也有报道[8-9]认为治疗前EBV DNA水平对预后没有影响。感染EB病毒的细胞能够表达多种抗原,其中衣壳抗原(capsid antigen, VAC)和早期抗原(early antigen, EA)是最常见的两种抗原。两者相对应的抗体VCA-IgA和EA-IgA已广泛应用于鼻咽癌的早期辅助诊断和预后预测[10],而EA-IgA和VCA-IgA升高对于ENKTCL的预后价值少有报道。因此,本研究回顾性分析了南京医科大学附属肿瘤医院早期ENKTCL患者治疗前EBV DNA载量、治疗前血清EA-IgA、VCA-IgA抗体水平与临床特征及预后的关系,以期为早期ENKTCL预后预测提供参考。
1 资料与方法
1.1 病例入组
本研究回顾性分析了2011—2018年南京医科大学附属肿瘤医院放疗科收治的早期结外鼻型NK/T细胞淋巴瘤患者的临床资料。纳入标准:(1)经病理活检和免疫组织化学确诊为NK/T细胞淋巴瘤;(2)Ann Arbor分期为ⅠE、ⅡE期;(3)原发部位为鼻腔、鼻咽等上呼吸消化道;(4)初治患者;(5)有治疗前血浆EBV DNA载量、治疗前血清VCA-IgA及EA-IgA抗体水平资料;(6)临床随访资料完整;(7)无重要脏器功能不全或其他肿瘤。最终符合入组条件的患者为78例。本研究获得江苏省肿瘤医院伦理委员会批准。
1.2 资料收集
收集患者一般临床资料:性别、年龄、美国东部肿瘤协作组(Eastern Cooperative Oncology Group, ECOG)评分、B症状。肿瘤相关检查资料:治疗前后的血常规、生化常规、EBV DNA、EB病毒抗体等血液学检测;鼻咽及颈部MRI、胸腹部CT、骨扫描、PET-CT等影像学资料,并进行治疗前骨髓穿刺排除骨髓侵犯。临床分期根据2014年Lugano修订的Ann Arbor分期原则。再分期由高年资放疗科医师结合影像学资料进行。乳酸脱氢酶(lactic dehydrogenase, LDH)升高定义为LDH≥245 u/L。原发部位定义为单个解剖部位,包括鼻腔、鼻咽、副鼻窦等结外部位。原发肿瘤侵袭(primary tumor invasion, PTI)定义为原发肿瘤从原发部位向邻近结构或组织生长,或同时累及多个连续部位。
1.3 实验室检查
全血标本离心分离血浆后,用EB病毒核酸扩增(PCR)荧光定量检测试剂盒测定血浆EBV DNA水平,操作方法按照试剂盒说明书进行。将混合好的PCR反应液在ABI 7300PCR仪上进行基因扩增检测,PCR反应步骤:93℃预变性2 min,1个循环;55℃ 1 min,10个循环;延伸72℃ 45 s,共30个循环。实验设阳性质控和阴性质控,实验过程严格按照SOP文件执行,当质控品在控时结果有效,EBV DNA表达量 < 1.0×102 copies/ml被视为阴性。采用EB病毒抗体检测试剂盒(德国IBL公司)通过酶联免疫吸附法测定VCA-IgA、EA-IgA抗体滴度,检测结果≥12 u/ml为阳性。
1.4 治疗方案
早期ENKTCL患者以接受放化疗综合治疗为主。模式包括:单纯放疗、序贯放化疗(放疗+化疗、化疗+放疗)、“三明治”治疗(化疗+放疗+化疗)、同步放化疗。所有患者均接受调强放射治疗(intensity-modulated radiotherapy, IMRT),采用6MV-X直线加速器。中位照射剂量为54 Gy(44~65 Gy)。使用扩大受累野放疗,肿瘤区(gross tumor volume, GTV)定义为影像学及内窥镜检查所见的原发肿瘤和阳性淋巴结。高危亚临床靶区(clinical target volume, CTV)依据原发部位、分期决定。原发肿瘤局限于鼻腔,CTV包括双侧鼻腔、双侧前组筛窦、硬腭和上颌窦;原发肿瘤超出鼻腔,应扩大至受累的邻近器官或结构,如后鼻孔受侵,应包括鼻咽。ⅠE期原发鼻腔ENKTCL不做颈淋巴结预防照射,ⅡE期患者CTV包括双颈淋巴结引流区。ⅠE-ⅡE期鼻腔外上呼吸消化道ENKTCL原则上均行颈淋巴结预防照射。
化疗方案包括蒽环类及非蒽环类药物。蒽环类方案包括CHOP(环磷酰胺、阿霉素、长春新碱、泼尼松)、EPOCH(依托泊苷、环磷酰胺、阿霉素、长春新碱、泼尼松);非蒽环类方案包括P-GEMOX(左旋门冬酰胺酶、吉西他滨、奥沙利铂)、P-GDP(左旋门冬酰胺酶、吉西他滨、顺铂、地塞米松)、GDP(吉西他滨、顺铂、地塞米松)、SMILE(甲氨蝶呤、异环磷酰胺、地塞米松、左旋门冬酰胺酶、依托泊苷)、MESA(甲氨蝶呤、依托泊苷、地塞米松、培门冬酶)。中位化疗周期数为4个周期(1~11个周期)。
1.5 疗效评估及随访
近期疗效评价根据WHO实体瘤疗效评价标准(Response Evaluation Criteria in Solid Tumors, RECIST)分为:完全缓解(complete remission, CR)、部分缓解(partial remission, PR)、疾病稳定(stability disease, SD)和疾病进展(progressive disease, PD)。无进展生存期(progression-free survival, PFS)定义为疾病诊断至进展、死亡或末次随访的时间。总生存期(overall survival, OS)定义为疾病诊断至死亡或末次随访时间。所有患者在治疗结束后1月随访,两年内每3月随访1次,第3~5年每半年随访1次,5年后每年随访1次。随访内容主要包括体格检查、血常规、生化、肿瘤标志物、EBV DNA、EBV抗体等血液学检查,以及头颈部MRI、胸腹部CT等影像学检查。所有患者随访截止日期为2020年12月31日。
1.6 统计学方法
采用SPSS23.0软件进行统计分析。采用卡方检验对临床基线资料进行分析。将患者的性别、年龄、Ann Arbor分期、ECOG评分、有无B症状、EBV DNA、VCA-IgA及EA-IgA抗体滴度首次治疗有无CR、临床检验指标等纳入单因素分析。单因素分析使用Kaplan-Meier生存分析,采用Log rank检验生存结局指标。多因素分析采用Cox比例风险模型。P < 0.05为差异有统计学意义。
2 结果
2.1 患者临床基线特征
全组患者临床特征见表 1。根据纳入及排除标准,我们共纳入78例早期结外鼻型NK/T细胞淋巴瘤患者,中位年龄为50岁(14~81岁)。原发部位以鼻腔为主(78.2%),17例(21.8%)发生于鼻腔外上呼吸消化道,主要包括鼻咽、副鼻窦、扁桃体等。ⅡE患者中32例患者(91.4%)为区域淋巴结受累,2例患者无区域淋巴结受累但出现纵隔淋巴结受累,1例无区域淋巴结受累但同时出现锁骨上、纵隔及腋窝淋巴结受累。
表 1 结外鼻型NK/T细胞淋巴瘤患者的临床基线资料(n(%))Table 1 Clinical baseline data of extranodal nasal-type natural killer/T-cell lymphoma (ENKTCL) patients (n(%))
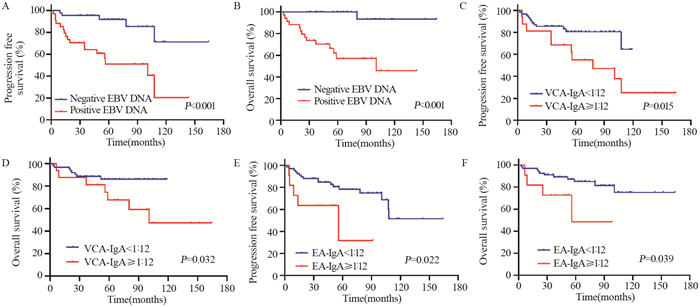
与EBV阴性组相比,EBV阳性与Ann Arbor分期(P=0.012)、原发部位(P=0.044)、PTI(P=0.039)显著相关,未发现与性别、年龄、ECOG评分、B症状、LDH、血红蛋白显著相关。VCA-IgA、EA-IgA阳性率分别为20.5%、14.1%,VCA-IgA、EA-IgA分别与EBV DNA显著相关(P=0.023, 0.038)。
2.2 治疗情况
全组患者中,12例(15.4%)接受单纯放疗,36例(46.2%)接受序贯治疗,24例(30.8%)接受化疗+放疗+化疗的“三明治”治疗,6例(7.8%)接受同步放化疗。所有患者接受了IMRT,中位照射剂量为54 Gy(44~65 Gy)。仅有3例(3.8%)患者接受 < 50 Gy照射。37例ⅠE期原发鼻腔ENKTCL未做颈淋巴结预防照射,有1例ⅠE期原发鼻腔ENKTCL患者行颈淋巴结预防照射,ⅡE期患者均行颈淋巴结引流区。ⅠE-ⅡE期鼻腔外上呼吸消化道ENKTCL患者行颈淋巴结预防照射。
66例患者接受了含蒽环类、非蒽环类药物为主的化疗。其中,12例接受蒽环类方案化疗(CHOP、EPOCH),4例患者在CHOP方案基础上加入左旋门冬酰胺酶(P-CHOP),36例接受非蒽环类化疗,14例患者因疗效不佳、经济原因、药物过敏等原因更换方案。
2.3 近期疗效与远期生存情况
中位随访时间为58.8月(3.0月~164.23月)。全组患者治疗后达CR者67例(85.9%),PR者7例(9.0%),SD者3例(3.8%),PD者1例(1.3%)。EBV DNA、VCA-IgA、EA-IgA阳性分别与治疗后未获得CR(P=0.035、0.027、0.043)相关,见表 1。全组死亡患者15例,12例死于肿瘤,3例死于其他疾病。全组患者3、5年PFS分别为81.7%、74.0%,3、5年OS分别为87.9%、81.1%。
2.4 单因素与多因素分析
单因素分析发现,年龄≥60岁、ECOG评分≥2分、原发鼻腔外上呼吸消化道、EBV DNA阳性、VCA-IgA阳性、EA-IgA阳性、治疗后未获得CR与不良的OS密切相关;年龄≥60岁、ECOG评分≥2分、Ann Arbor分期ⅡE、原发鼻腔外上呼吸消化道、PTI、EBV DNA阳性、VCA-IgA阳性、EA-IgA阳性、颈部淋巴结未预防性照射、治疗后未获得CR则与较差的PFS显著相关,见图 1、表 2。
表 2 早期ENKTCL患者OS和PFS单因素分析Table 2 Univariate analysis of for OS and PFS of patients with early-stage ENKTCL
为纠正可能存在的混杂因素,我们将单因素分析中P < 0.2的自变量纳入多因素分析。全组患者中,年龄≥60岁(P=0.033)、EBV DNA(P=0.004)、治疗后未获得CR(P=0.002)为早期ENKTCL的OS的独立预后因素,年龄≥60岁(P=0.031)、EBV DNA(P=0.036)、原发鼻腔外上呼吸消化道(P=0.009)、治疗后未获得CR(P=0.001)则为早期ENKTCL的PFS的独立预后因素,见表 3。
表 3 早期ENKTCL患者OS和PFS多因素分析Table 3 Multivariate analysis of OS and PFS of patients with early-stage ENKTCL
3 讨论
与鼻咽癌相似,EBV在ENKTCL中为Ⅱ型潜伏感染,不表达针对细胞毒性T淋巴细胞的EBNA2和EBNA3基因[11],从而具有逃避宿主免疫反应的优势。外周血循环EBV DNA部分来源于坏死和凋亡的肿瘤细胞,EBV DNA拷贝水平可能与肿瘤增殖水平有关。既往研究发现治疗前EBV DNA阳性的ENKTCL患者常表现为更晚的分期、结外受累、B症状及LDH水平升高[12-13]。与文献报道相似,本研究中EBV DNA阳性与Ann Arbor分期晚相关。原发肿瘤倾向于通过黏膜延伸至邻近结构或组织,PTI作为局部肿瘤负荷指标已被多项研究证实为预测ENKTCL预后的重要因素[14-15]。本研究认为EBV DNA阳性与PTI相关,即EBV阳性患者倾向于具有局部肿瘤侵袭特征。本研究未发现EBV DNA与B症状、LDH有相关性,与文献报道不符。可能原因为:(1)样本量较少;(2)本研究只纳入早期ENKTCL患者,ⅠE期与ⅡE期肿瘤负荷差异可能不明显。本研究认为与原发鼻腔上呼吸消化道相比,原发鼻腔外上呼吸消化道患者的EBV阳性比例更高且有统计学意义,但P值接近0.05。而有研究认为ENKTCL的原发部位与EBV DNA无关[9],但该研究仅比较鼻腔与鼻腔外部位,未单独对鼻腔、鼻腔外上呼吸消化道与EBV DNA的差异进行探究。未来进一步探索上呼吸消化道发病部位不同所致临床特征、EBV DNA水平及预后差异十分必要。
EBV DNA水平与短期疗效相关。有研究报道治疗前血浆EBV DNA含量低于1.0×104 copies/ml的ENKTCL患者对于治疗的总体应答率显著高于血浆EBV DNA含量高于1.0×104 copies/ml患者[16]。本研究发现治疗前EBV DNA阴性患者的CR率显著高于阳性患者,有更好的治疗反应,与既往文献报道相符。治疗前EBV-DNA对于ENKTCL预后的预测作用存在争议。既往多数研究均认为治疗前EBV DNA水平升高与不良预后有关。Su等[17]研究发现诊断时log[EBV DNA]≥3.8有较差的PFS和OS。Liang等[18]的一项前瞻性研究检测了32例ENKTCL患者EBV-DNA载量,发现治疗前EBV-DNA阳性是影响预后的独立危险因素。但也有研究显示治疗前EBV-DNA水平对早期ENKTCL患者的预后没有影响。Wang等[8]使用PCR法前瞻性检测治疗前后血浆样本中EBV-DNA的含量,结果表明治疗前EBV-DNA水平不是预测PFS和OS的独立预后因素,而治疗后血浆EBV DNA水平可以预测早期复发和不良预后。Wang等[19]检测了99例ENKTCL患者治疗前、中、后的EBV DNA,发现EBV DNA阴性患者的3年PFS、OS均显著优于EBV DNA阳性患者。因此动态检测EBV拷贝数对于ENKTCL的预后具有一定意义。本研究对78例患者进行多因素分析发现,治疗前EBV DNA阳性是PFS和OS的独立预后危险因素。但由于纳入的患者仅部分在后续随访中进行了EBV DNA检测,未能对治疗后EBV DNA与预后关系进行分析。
VCA、EA产生的抗体为分泌型抗体,主要参与鼻黏膜免疫反应[20]。在鼻咽癌中,VCA-IgA和EA-IgA联合检测可以应用于早期筛查[21],与临床分期密切相关[22]。而VCA-IgA和EA-IgA对于鼻咽癌患者的预后价值还存在争议[23]。VCA-IgA、EA-IgA在ENKTCL中的研究较少。Huang等[4]首次报道了VCA-IgA、EA-IgA与ENKTCL患者预后的相关性。该研究发现EBV EA-IgA≥1:10、VCA-IgA≥1:160与LDH升高、区域淋巴结累及、分期晚相关,并且OS和PFS较差。其中,EA-IgA≥1:10是OS的独立预后因素(P=0.008),与较低的CR率(P=0.001)和较高的复发率(P=0.016)有关。且本研究中EA-IgA、VCA-IgA的阳性率分别为20.5%、14.1%,两者与EBV DNA阳性有关,与其他临床特征均未见相关性。EA-IgA、VCA-IgA阴性患者有较好的治疗反应。单因素分析发现EA-IgA、VCA-IgA滴度阳性有较差的PFS、OS,但多因素分析显示EA-IgA、VCA-IgA均不是影响PFS、OS的独立危险因素。本研究EA-IgA、VCA-IgA抗体滴度临界值低于Huang等[4]的研究,可能造成结果差异;Huang等将VCA-IgA滴度阳性标准降至阳性1:40后同样发现与临床特征及预后无明显相关性。由此,我们猜想较高水平的抗体滴度表明EBV感染处于裂解增殖期,EBV相关癌蛋白的过度表达可能导致肿瘤细胞进一步转化为更具侵袭性的克隆,预后较差。较低滴度的VCA-IgA、EA-IgA对于ENKTCL预后预测作用不大,高滴度临界值选取及其对于ENKTCL的作用需要进一步研究,两者联合检测能否提高预测的准确性也有待探究。另外,本研究仅有少部分患者(11例)放疗后进行EB病毒检测,治疗后EB病毒动态变化对于预后的意义也值得进一步分析。
本研究还存在一些局限性:首先,本研究为小样本量的回顾性研究,结果可能需要在更大规模的队列研究中进行验证;其次,不同实验室EBV DNA、EB病毒抗体的检测方法及临界值不同,导致结果存在差异。另外,本研究纳入患者来自华东地区,研究结果是否可以外推到其他人群还有待探讨。
综上,治疗前EBV DNA阳性与较晚的Ann Arbor分期、PTI、原发鼻腔外上呼吸消化道、治疗反应差有关,治疗前EBV DNA阳性是PFS和OS的独立预后危险因素。EA-IgA、VCA-IgA水平升高与EBV DNA阳性、治疗反应差有关,与其他临床特征无相关性。EA-IgA、VCA-IgA均不是影响PFS、OS的独立因素。治疗前EBV DNA可用于ENKTCL的风险分层及预后预测,而EA-IgA、VCA-IgA对于ENKTCL的预后指导作用有限。
Competing interests: The authors declare that they have no competing interests.作者贡献:许恬:文章撰写、资料采集、随访及统计学分析杨露、袁芳琴:资料采集、随访何侠、尹丽:文章审校 -
表 1 结外鼻型NK/T细胞淋巴瘤患者的临床基线资料(n(%))
Table 1 Clinical baseline data of extranodal nasal-type natural killer/T-cell lymphoma (ENKTCL) patients (n(%))

表 2 早期ENKTCL患者OS和PFS单因素分析
Table 2 Univariate analysis of for OS and PFS of patients with early-stage ENKTCL

表 3 早期ENKTCL患者OS和PFS多因素分析
Table 3 Multivariate analysis of OS and PFS of patients with early-stage ENKTCL

-
[1] Wang L, Li LR, Zhang L, et al. The landscape of new drugs in extranodal NK/T-cell lymphoma[J]. Cancer Treat Rev, 2020, 89: 102065. doi: 10.1016/j.ctrv.2020.102065
[2] Tse E, Kwong YL. The diagnosis and management of NK/T-cell lymphomas[J]. J Hematol Oncol, 2017, 10(1): 85. doi: 10.1186/s13045-017-0452-9
[3] Yamaguchi M, Suzuki R, Oguchi M. Advances in the treatment of extranodal NK/T-cell lymphoma, nasal type[J]. Blood, 2018, 131(23): 2528-2540. doi: 10.1182/blood-2017-12-791418
[4] Huang Y, Rao H, Yan S, et al. Serum EBV EA-IgA and VCA-IgA antibodies can be used for risk group stratification and prognostic prediction in extranodal NK/T cell lymphoma: 24-year experience at a single institution[J]. Ann Hematol, 2017, 96(8): 1331-1342. doi: 10.1007/s00277-017-3013-y
[5] Ha JY, Cho H, Sung H, et al. Superiority of Epstein-Barr Virus DNA in the Plasma Over Whole Blood for Prognostication of Extranodal NK/T Cell Lymphoma[J]. Front Oncol, 2020, 10: 594692. doi: 10.3389/fonc.2020.594692
[6] Zhao Q, Fan S, Chang Y, et al. Clinical efficacy of cisplatin, dexamethasone, gemcitabine and pegaspargase (DDGP) in the initial treatment of advanced stage (stage Ⅲ-Ⅳ) extranodal NK/T-cell lymphoma, and its correlation with Epstein-Barr virus[J]. Cancer Manag Res, 2019, 11: 3555-3564. doi: 10.2147/CMAR.S191929
[7] Kim SJ, Yoon DH, Jaccard A, et al. A prognostic index for natural killer cell lymphoma after non-anthracycline-based treatment: a multicentre, retrospective analysis[J]. Lancet Oncol, 2016, 17(3): 389-400. doi: 10.1016/S1470-2045(15)00533-1
[8] Wang L, Wang H, Wang JH, et al. Post-treatment plasma EBV-DNA positivity predicts early relapse and poor prognosis for patients with extranodal NK/T cell lymphoma in the era of asparaginase[J]. Oncotarget, 2015, 6(30): 30317-30326. doi: 10.18632/oncotarget.4505
[9] Kwong YL, Pang AWK, Leung AYH, et al. Quantification of circulating Epstein-Barr virus DNA in NK/T-cell lymphoma treated with the SMILE protocol: diagnostic and prognostic significance[J]. Leukemia, 2014, 28(4): 865-870. doi: 10.1038/leu.2013.212
[10] Chen Y, Xin X, Cui Z, et al. Diagnostic Value of Serum Epstein-Barr Virus Capsid Antigen-IgA for Nasopharyngeal Carcinoma: a Meta-Analysis Based on 21 Studies[J]. Clin Lab, 2016, 62(6): 1155-1166. http://europepmc.org/abstract/med/27468579
[11] Lin N, Ku W, Song Y, et al. Genome-Wide Analysis of Epstein-Barr Virus Isolated from Extranodal NK/T-Cell Lymphoma, Nasal Type[J]. Oncologist, 2019, 24(9): e905-e913. doi: 10.1634/theoncologist.2017-0588
[12] Chen Y, Zheng X, Chen B, et al. The clinical significance of Epstein-Barr virus DNA in peripheral blood mononuclear cells in patients with non-Hodgkin lymphoma[J]. Leuk Lymphoma, 2017, 58(10): 2349-2355. doi: 10.1080/10428194.2017.1300894
[13] Wu T, Yang Y, Zhu SY, et al. Risk-adapted survival benefit of IMRT in early-stage NKTCL: a multicenter study from the China Lymphoma Collaborative Group[J]. Blood Adv, 2018, 2(18): 2369-2377. doi: 10.1182/bloodadvances.2018021311
[14] Wu RY, Liu K, Wang WH, et al. Patterns of Primary Tumor Invasion and Regional Lymph Node Spread Based on Magnetic Resonance Imaging in Early-Stage Nasal NK/T-cell Lymphoma: Implications for Clinical Target Volume Definition and Prognostic Significance[J]. Int J Radiat Oncol Biol Phys, 2017, 97(1): 50-59. doi: 10.1016/j.ijrobp.2016.09.013
[15] Qi SN, Xu LM, Yuan ZY, et al. Effect of primary tumor invasion on treatment and survival in extranodal nasal-type NK/T-cell lymphoma in the modern chemotherapy era: a multicenter study from the China Lymphoma Collaborative Group (CLCG)[J]. Leuk Lymphoma, 2019, 60(11): 2669-2678. doi: 10.1080/10428194.2019.1602265
[16] Ito Y, Kimura H, Maeda Y, et al. Pretreatment EBV-DNA copy number is predictive of response and toxicities to SMILE chemotherapy for extranodal NK/T-cell lymphoma, nasal type[J]. Clin Cancer Res, 2012, 18(15): 4183-4190. doi: 10.1158/1078-0432.CCR-12-1064
[17] Su YJ, Wang PN, Chang H, et al. Extranodal NK/T-cell lymphoma, nasal type: Clinical features, outcome, and prognostic factors in 101 cases[J]. Eur J Haematol, 2018, 101(3): 379-388. doi: 10.1111/ejh.13126
[18] Liang JH, Wang L, Gale RP, et al. Efficacy of pegaspargase, etoposide, methotrexate and dexamethasone in newly diagnosed advanced-stage extra-nodal natural killer/T-cell lymphoma with the analysis of the prognosis of whole blood EBV-DNA[J]. Blood Cancer J, 2017, 7(9): e608. doi: 10.1038/bcj.2017.88
[19] Wang XX, Li PF, Bai B, et al. Efficacy of significance of pre-, interim-, and post-treatment plasma Epstein-Barr virus DNA load in NK/T-cell lymphoma treated with P-GEMOX protocol[J]. Leuk Lymphoma, 2019, 60(8): 1917-1925. doi: 10.1080/10428194.2018.1563690
[20] Winter JR, Jackson C, Lewis JE, et al. Predictors of Epstein-Barr virus serostatus and implications for vaccine policy: A systematic review of the literature[J]. J Global Health, 2020, 10(1): 010404. doi: 10.7189/jogh.10.010404
[21] Rao D, Fu M, Chen Y, et al. A combination of two ELISA tests for nasopharyngeal carcinoma screening in endemic areas based on a case-control study[J]. PeerJ, 2020, 8: e10254. doi: 10.7717/peerj.10254
[22] Yao JJ, Lin L, Jin YN, et al. Prognostic value of serum Epstein-Barr virus antibodies in patients with nasopharyngeal carcinoma and undetectable pretreatment Epstein-Barr virus DNA[J]. Cancer Sci, 2017, 108(8): 1640-1647. doi: 10.1111/cas.13296
[23] Tan LP, Tan GW, Sivanesan VM, et al. Systematic comparison of plasma EBV DNA, anti-EBV antibodies and miRNA levels for early detection and prognosis of nasopharyngeal carcinoma[J]. Int J Cancer, 2020, 146(8): 2336-2347. doi: 10.1002/ijc.32656
-
期刊类型引用(1)
1. 张宁,高彦闯. 淋巴瘤患儿外周血EB病毒核酸载量与治疗效果及预后关系. 航空航天医学杂志. 2025(06): 657-659 .  百度学术
百度学术
其他类型引用(2)



 下载:
下载: