Relation Between EB Virus Infection and Curative Effect, Prognosis of Patients with Early-stage Extranodal Nasal-type NK/T-cell Lymphoma
-
摘要:目的
探讨早期结外鼻型NK/T细胞淋巴瘤(ENKTCL)患者治疗前EBV DNA载量、治疗前血清EA-IgA及VCA-IgA抗体水平与临床特征、治疗反应及预后的关系。
方法分析78例早期结外鼻型NK/T细胞淋巴瘤患者的临床特征及影响预后的因素。
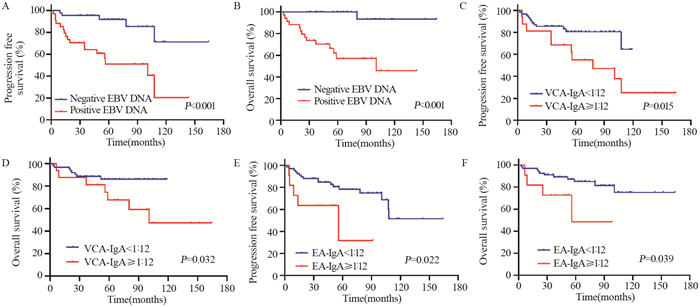
结果治疗前EBV DNA、VCA-IgA、EA-IgA阳性率分别为43.6%、20.5%、14.1%。EBV DNA与Ann Arbor分期、原发部位、PTI、治疗后未获得CR显著相关(均P < 0.05)。VCA-IgA、EA-IgA滴度分别与EBV DNA、治疗后未获得CR显著相关(均P < 0.05)。多因素分析发现年龄、EBV DNA、治疗后未获得CR为早期ENKTCL患者OS的独立预后因素(均P < 0.05);年龄、EBV DNA、原发鼻腔外上呼吸消化道、治疗后未获得CR(均P < 0.05)则为早期ENKTCL患者PFS的独立预后因素。
结论治疗前EBV DNA阳性与较晚的Ann Arbor分期、PTI、原发鼻腔外上呼吸消化道、治疗反应差有关。EA-IgA、VCA-IgA水平升高与EBV DNA阳性、治疗反应差有关。治疗前EBV DNA可用于ENKTCL的风险分层及预后预测,而EA-IgA、VCA-IgA对于ENKTCL的预后指导作用有限。
-
关键词:
- 鼻型结外NK/T细胞淋巴瘤 /
- EB病毒 /
- 预后
Abstract:ObjectiveTo explore the correlation of pretreatment EBV DNA load, EBV EA-IgA and VCA-IgA antibodies levels with the clinical characteristics, curative effect and prognosis of the patients with early-stage extranodal nasal-type NK/T-cell lymphoma (ENKTCL).
MethodsWe analyzed the clinical features and prognostic factors of 78 ENKTCL patients.
ResultsPositive rates of pretreatment EBV DNA, VCA-IgA and EA-IgA were 43.6%, 20.5% and 14.1%, respectively. EBV DNA was significantly associated with Ann Arbor stage, primary site, PTI and non-CR (all P < 0.05). VCA-IgA and EA-IgA were related to positive EBV DNA and non-CR (all P < 0.05). Multivariate analysis showed that age, EBV DNA and non-CR were independent prognostic factors for OS (all P < 0.05); age, EBV DNA, primary site and non-CR were independent prognostic factors for PFS (all P < 0.05).
ConclusionThe pretreatment positive EBV DNA is related to advanced Ann Arbor stage, PTI, primary extra-nasal subtypes of upper aerodigestive tract and poor response to treatment. The elevated levels of EA-IgA and VCA-IgA are related to positive EBV DNA and poor response to treatment. Pretreatment EBV DNA could be used for risk stratification and prognosis prediction of ENKTCL, while EA-IgA and VCA-IgA play limited role in guiding the prognosis of ENKTCL.
-
Key words:
- Extranodal nasal-type NK/T-cell lymphoma /
- Epstein-Barr virus /
- Prognosis
-
0 引言
三阴性乳腺癌(triple-negative breast cancer, TNBC)恶性程度高,易出现早期复发和内脏转移,是乳腺癌中侵袭性最强,预后最差的亚型[1]。由于缺乏特异性治疗靶点,内分泌治疗和靶向治疗基本无效,化疗仍是晚期TNBC主要的治疗手段。TNBC早期对化疗相对敏感,但随着治疗推进,患者逐渐产生耐药,导致治疗失败及预后不良。接受常规化疗的转移性TNBC患者的中位总生存期仅9~12月[2]。此外,化疗带来的不良反应如心脏毒性、神经毒性、胃肠道反应、骨髓抑制等也不容小觑,严重影响患者生活质量[3]。因此,研发新型抗肿瘤药物是一个亟待解决的难题。
中医药是临床抗癌治疗的重要组成部分,具有多途径、多靶点、多通路的协同抗肿瘤特点,可逆转肿瘤化疗耐药、提高机体免疫功能、抑制肿瘤远处转移[4-5]。槲皮素是一种广泛存在于多种中草药(白花蛇舌草、黄芩、三七)中的黄酮类化合物,具有抗炎、抗氧化、抗病毒、抗肿瘤等药理作用[6-7]。研究表明,槲皮素可通过抑制肿瘤细胞增殖、转移及诱导凋亡等多种途径来发挥抗肿瘤作用[7]。其中,细胞凋亡是诸多抗肿瘤药物杀伤肿瘤细胞的重要途径。文献证实槲皮素在宫颈癌、肺癌、肝癌等多种肿瘤中可通过促进细胞凋亡发挥抗肿瘤作用[8-10]。槲皮素的促凋亡作用涉及多种分子和信号通路,如通过内质网应激途径诱导宫颈癌细胞凋亡[8];通过抑制磷脂酰肌醇3-激酶(phosphatidylinositide 3-kinases, PI3K)/丝氨酸/苏氨酸蛋白激酶B(RAC-α serine/threonine-protein kinase, AKT)信号通路促进肺腺癌细胞凋亡等[9]。TNBC中,槲皮素是否也通过诱导凋亡发挥抗肿瘤作用也是本研究探索的目的。
JAK2/STAT3信号通路是细胞内重要信号转导通路,通过影响下游多种效应分子的活化状态,参与调控肿瘤发生、发展等多个环节[11]。研究表明富含黄酮物质的中药可抑制JAK2/STAT3通路发挥抗肿瘤作用。甘草总黄酮抑制 JAK2/STAT3通路可减小异种移植乳腺癌肿瘤体积[12]。槲皮素可通过抑制JAK2/STAT3信号通路促进直肠癌细胞和卵巢癌细胞凋亡[13-14]。这些研究为我们深入探索槲皮素在TNBC中的促凋亡机制提供了新的思路。本课题组前期利用叶酸修饰构建脂质体槲皮素(folic acid-modified liposome quercetin, FLQ)[15],克服了槲皮素水溶性差、靶向性不足、生物利用度低等问题,旨在探索叶酸修饰脂质体槲皮素是否通过JAK2/STAT3信号通路促进TNBC细胞线粒体途径凋亡,为叶酸修饰脂质体槲皮素应用于临床TNBC治疗提供理论依据。
1 材料与方法
1.1 细胞系及主要试剂
人三阴性乳腺癌细胞系(MDA-MB-231)购自武汉普诺赛生命科技有限公司;DMEM试剂盒、胎牛血清、胰酶和青/链霉素均购自美国Gibco公司;细胞周期检测试剂盒、线粒体膜电位试剂盒和ROS检测试剂盒均购自上海碧云天生物技术有限公司;Annexin V-FITC/PI细胞凋亡试剂盒购自杭州联科生物;RIPA裂解液、PMSF蛋白酶抑制剂及5×蛋白上样缓冲液购自北京索莱宝科技有限公司;ECL发光试剂盒购自美国Advansta公司;JAK2抗体(74987)、STAT3抗体(30835)、p-JAK2抗体(4406)和p-STAT3抗体(9145)均购自美国Cell Signaling Technology公司;细胞色素C(Cytochrome C, Cyt C)抗体(ab133504)和Cleaved-Caspase-3抗体(ab2302)均购自英国Abcam公司;Bcl2抗体(68103-1-Ig)、Bcl-xL抗体(26967-1-AP)、Bax抗体(50599-2-Ig)、Bak抗体(29552-1-AP)、GAPDH抗体(60004-1-Ig)、辣根过氧化物酶标记的山羊抗鼠(SA00001-1)和山羊抗兔(SA00001-2)二抗均购自武汉三鹰生物技术有限公司。
1.2 实验方法
1.2.1 细胞培养
将人三阴性乳腺癌细胞系(MDA-MB-231)置于含10%胎牛血清、100 μg/ml链霉素和100 U/ml青霉素的DMEM培养基中,在含5%CO2、37℃恒温培养箱中培养,待细胞融合至80%~90%进行传代。
1.2.2 叶酸修饰脂质体槲皮素的制备
将槲皮素与卵磷脂、脑磷脂、胆固醇、聚乙二醇混合,再与氯仿混合后溶解于二甲基亚砜中,经真空干燥、水合反应、超声波破碎和微孔滤膜过滤,得到槲皮素脂质体,与N, N-羰基二咪唑和吡啶混合搅拌后加入三乙胺,避光反应6 h后加入含叶酸的二甲基亚砜溶液,再避光反应24 h后加入冰乙醚,抽滤得到滤饼后溶于丙酮,过滤再旋转蒸发至半干状,真空干燥备用,进行细胞实验室时用DMSO溶解,再用完全培养基稀释成需要的浓度。
1.2.3 CCK-8法检测FLQ对TNBC细胞活力的影响
取对数生长期的MDA-MB-231细胞,按3×103/孔接种于96孔板内,24 h后更换为不同浓度的FLQ(0、1、2、4、8、16、32、64、128 μmol/L),分别于FLQ处理后48 h,按照CCK-8试剂盒说明书,向每孔加入100 µl检测液,置于培养箱中孵育2 h,酶标仪检测450 nm处的吸光度值,选择合适的FLQ浓度进行后续实验。细胞活力(%)=(A实验孔-A空白孔)/(A对照孔-A空白孔)×100%。
1.2.4 克隆形成实验检测FLQ对TNBC细胞增殖能力的影响
取对数生长期的MDA-MB-231细胞消化离心(1 000 r/min, 5 min),按200个/孔接种于6孔板内,分为对照组和FLQ组,对照组用0.1%的DMSO处理,FLQ组用20 μmol/L的FLQ处理,置于细胞培养箱中连续培养14天,终止培养后,用甲醛固定后结晶紫染色,计数>50个细胞的克隆数。
1.2.5 流式细胞术检测FLQ对TNBC细胞凋亡的影响
取对数生长期的MDA-MB-231细胞消化离心,按3×105/孔接种于6孔板内,分为对照组和FLQ组,对照组用0.1%的DMSO处理,FLQ组用20 μmol/L的FLQ处理,置于细胞培养箱中培养48 h,收集细胞,预冷的PBS冲洗,1 200 r/min,离心5 min,弃上清液,100 μl Binding buffer制细胞悬液,依次加入Annexin V-FITC和PI染色液各5 μl,室温避光孵育15 min。加入400 μl Binding buffer混悬细胞后上流式细胞仪检测细胞凋亡率。
1.2.6 流式细胞术检测FLQ对TNBC细胞内ROS水平的影响
按照1.2.5分组给药处理细胞48 h,收集细胞,PBS冲洗,1 500 r/min,离心5 min,弃上清液,加入100 μl稀释好的DCFH-DA探针,37℃避光孵育20 min,流式细胞仪检测细胞内ROS水平。
1.2.7 流式细胞术检测FLQ对TNBC细胞线粒体膜电位的影响
按照1.2.5分组给药处理细胞48 h,收集细胞,PBS冲洗,每孔加入1 ml培养基+1 ml JC-1工作液,充分混匀后37℃孵育20 min,1 500 r/min,离心5 min,弃上清液,1×JC-1染色缓冲液洗涤,最后加入适量JC-1染色缓冲液冲悬后,流式细胞仪检测线粒体膜电位。
1.2.8 Western blot检测JAK2/STAT3信号通路及凋亡相关蛋白的表达
取对数生长期的MDA-MB-231细胞以4×105个/孔接种于6孔板内,分为对照组和FLQ组,对照组用0.1%的DMSO处理,FLQ组用20 μmol/L的FLQ处理,48 h后提取总蛋白,BCA定量法定量后,加入5×蛋白上样缓冲液,100℃水浴使蛋白变性。每孔20 μg进行蛋白凝胶电泳,湿法转至PVDF膜,5%脱脂奶粉封闭,TBST洗膜,一抗4℃孵育过夜,TBST洗涤后加入二抗,室温下孵育1 h,TBST洗膜,加入ECL发光液,凝胶成像采集系统采集凝胶图像,Image J软件进行后续分析。
1.3 统计学方法
SPSS 23.0和Graphpad 9.0软件进行统计学分析,结果以均数±标准差表示。两独立样本间的比较用t检验,P<0.05为差异有统计学意义。
2 结果
2.1 FLQ对MDA-MB-231细胞活力的抑制作用
为检测FLQ对MDA-MB-231细胞活性的影响,我们使用不同浓度的FLQ作用于MDA-MB-231细胞48 h后,CCK-8检测细胞活性。结果显示:FLQ可抑制MDA-MB-231细胞活性,并且药物浓度越大,抑制作用越强,呈现剂量依赖性,见图1;FLQ作用于MDA-MB-231的IC50为20.69 μmol/L,因此,采用20 μmol/L的FLQ浓度作用48 h进行后续实验。
2.2 FLQ对MDA-MB-231细胞增殖的抑制作用
与对照组相比,FLQ处理组克隆数量明显减少(P=0.023),说明FLQ可以抑制MDA-MB-231细胞增殖,图2。
2.3 FLQ诱导MDA-MB-231细胞凋亡
与对照组相比,FLQ处理组细胞凋亡显著,细胞凋亡率明显升高(P<0.001),说明FLQ可以诱导MDA-MB-231细胞凋亡,见图3。
2.4 FLQ促进MDA-MB-231细胞线粒体膜电位坍塌
线粒体膜电位下降是凋亡的早期表现,一旦线粒体膜电位损耗,细胞就会进入不可逆的凋亡过程。我们用JC-1染料检测了MDA-MB-231细胞线粒体膜电位的变化。流式细胞术检测结果显示:对照组细胞线粒体膜电位处于较高水平,FLQ处理组细胞线粒体膜电位处于较低水平,两组差异有统计学意义(P=0.003),见图4。提示FLQ对线粒体功能有不利影响,导致MDA-MB-231细胞线粒体膜电位坍塌。
2.5 FLQ促进MDA-MB-231细胞ROS生成
与对照组相比,FLQ处理组生成绿色DCFH荧光信号的细胞比例明显升高(P=0.034),见图5,表明FLQ促进MDA-MB-231细胞内ROS的生成。
2.6 FLQ通过靶向JAK2/STAT3信号通路促进MDA-MB-231细胞凋亡
Western blot检测JAK2/STAT3信号通路中相关蛋白t-JAK2、p-JAK2、t-STAT3、p-STAT3及凋亡相关蛋白Bcl2、Bcl-xL、Bax、Bak、Cyt C、Cleaved-Caspase-3表达。结果显示:与对照组相比,FLQ处理组p-JAK2、p-STAT3表达量明显降低(P<0.001),但t-JAK2、t-STAT3的表达量无明显变化;促凋亡蛋白Bax、Bak、Cyt C、Cleaved-Caspase-3表达量明显升高(P<0.001),而抗凋亡蛋白Bcl2、Bcl-xL表达量明显降低(P=0.037,0.028),见图6。
3 讨论
TNBC是雌激素受体、孕激素受体以及人表皮生长因子受体2均阴性的乳腺癌,约占所有乳腺癌的10%~15%。由于缺乏有效的治疗靶点,TNBC的治疗一直极具挑战性。尽管目前探索TNBC潜在治疗靶点的研究较多,但一直未有突破性进展。TNBC仍缺乏特异有效的治疗药物,整体预后较差[16]。近年来,中药在肿瘤治疗中因其高效低毒的特点受到了越来越多的关注。不断有研究证实中药单体成分可通过调节多种生物学过程,发挥抗肿瘤作用[17-18]。
槲皮素作为多种中药的黄酮类成份,具有多靶点和不易耐药的优势,可以通过调节多种信号通路靶点蛋白抑制肿瘤的发生和发展进程,还可逆转化疗耐药、增加放疗敏感性[19-20]。但槲皮素水溶性较差、代谢较快、半衰期较短,生物利用度较低的特点,限制了其在临床上的使用[21]。近年来,纳米靶向给药体系的研究发展迅速, 将传统的抗肿瘤药物分子以包埋、吸附、囊封或者共价键合的形式,结合在具有纳米尺度的载体上(如脂质体、胶束、纳米粒等),可以一定程度上提高药物溶解性,增加药物的靶向性,延长药物体内循环时间[22]。
基于肿瘤微环境对纳米载体进行有效的表面修饰,可进一步提高药物的靶向递送效率。叶酸是一种小分子维生素,具有无毒、无免疫原性、生物相容性好、结构稳定性高、易于合成与修饰等优点[23]。叶酸受体是一种N-糖基化蛋白,与叶酸有很高的结合亲和力,包括乳腺癌在内的许多肿瘤细胞表面高度表达,但在正常组织中表达水平非常低[24]。在肿瘤治疗中利用叶酸与其受体的特异性结合,能将药物聚集于肿瘤部位,同时减少对正常细胞的毒性,显著增加疗效[25]。
基于此,本研究将槲皮素包载在脂质体中,并用叶酸加以修饰,构建了FLQ,赋予其肿瘤靶向性,在提高其在体内的生物利用度的同时降低全身的不良反应[15]。不受控制的细胞增殖和逃避细胞凋亡是肿瘤的两大特征,抑制增殖和诱导凋亡成为治疗肿瘤的重要途径。本研究结果显示,FLQ可抑制TNBC细胞MDA-MB-231增殖,并呈浓度依赖性;还可促进MDA-MB-231细胞凋亡。
线粒体凋亡途径是细胞凋亡的主要分子途径,线粒体膜电位降低是其发生的特征性标志[17]。本研究中,FLQ可诱导MDA-MB-231细胞线粒体膜电位坍塌,并上调细胞内ROS水平,提示FLQ可能诱导线粒体凋亡途径。线粒体凋亡途径主要受Bcl-2家族蛋白调控。Bcl-2家族蛋白由促凋亡蛋白(Bax等)和抗凋亡蛋白(Bcl-2等)构成,Bcl-2与Bax构成异源二聚体,维持线粒体外膜的完整性,阻止线粒体凋亡反应。在凋亡信号刺激下,Bcl2/Bax比值的发生变化,导致线粒体膜电位降低及通透性增加,释放Cyt C,激活下游Caspase级联反应,启动线粒体凋亡途径[17]。本研究中,FLQ下调Bcl2/Bax比值以及上调Cyt C、Cleaved-Caspase-3蛋白表达,进一步说明FLQ通过诱导线粒体凋亡途径而发挥体外抗TNBC作用。
大量研究表明,JAK2/STAT3信号通路在多种肿瘤中异常活化,发挥其促进肿瘤生长、转移、增强耐药及免疫逃逸的作用。JAK2、STAT3是该通路主要效应子。胞外信号与受体胞外域结合后,激活JAK2并使之磷酸化,随后p-JAK2磷酸化其下游底物STAT3,p-STAT3发生二聚化并转移到细胞核,在细胞核内调节基因转录[26]。既往研究发现,抑制JAK2/STAT3信号通路可诱导肝癌细胞经线粒体途径凋亡,提示该通路参与调控线粒体凋亡通路[27]。本研究结果显示,FLQ显著降低JAK2、STAT3磷酸化水平,同时显著上调Bcl2表达而下调Bax表达,说明FLQ通过作用JAK2/STAT3信号通路而激活线粒体凋亡途径。
综上所述,本研究证实FLQ抑制TNBC细胞MDA-MB-231细胞增殖并诱导其凋亡,阐明FLQ通过靶向JAK2/STAT3信号通路而激活线粒体凋亡途径的分子机制,揭示了FLQ抗TNBC的科学内涵,为FLQ的药效发挥提供理论依据。
Competing interests: The authors declare that they have no competing interests.作者贡献:许恬:文章撰写、资料采集、随访及统计学分析杨露、袁芳琴:资料采集、随访何侠、尹丽:文章审校 -
表 1 结外鼻型NK/T细胞淋巴瘤患者的临床基线资料(n(%))
Table 1 Clinical baseline data of extranodal nasal-type natural killer/T-cell lymphoma (ENKTCL) patients (n(%))

表 2 早期ENKTCL患者OS和PFS单因素分析
Table 2 Univariate analysis of for OS and PFS of patients with early-stage ENKTCL

表 3 早期ENKTCL患者OS和PFS多因素分析
Table 3 Multivariate analysis of OS and PFS of patients with early-stage ENKTCL

-
[1] Wang L, Li LR, Zhang L, et al. The landscape of new drugs in extranodal NK/T-cell lymphoma[J]. Cancer Treat Rev, 2020, 89: 102065. doi: 10.1016/j.ctrv.2020.102065
[2] Tse E, Kwong YL. The diagnosis and management of NK/T-cell lymphomas[J]. J Hematol Oncol, 2017, 10(1): 85. doi: 10.1186/s13045-017-0452-9
[3] Yamaguchi M, Suzuki R, Oguchi M. Advances in the treatment of extranodal NK/T-cell lymphoma, nasal type[J]. Blood, 2018, 131(23): 2528-2540. doi: 10.1182/blood-2017-12-791418
[4] Huang Y, Rao H, Yan S, et al. Serum EBV EA-IgA and VCA-IgA antibodies can be used for risk group stratification and prognostic prediction in extranodal NK/T cell lymphoma: 24-year experience at a single institution[J]. Ann Hematol, 2017, 96(8): 1331-1342. doi: 10.1007/s00277-017-3013-y
[5] Ha JY, Cho H, Sung H, et al. Superiority of Epstein-Barr Virus DNA in the Plasma Over Whole Blood for Prognostication of Extranodal NK/T Cell Lymphoma[J]. Front Oncol, 2020, 10: 594692. doi: 10.3389/fonc.2020.594692
[6] Zhao Q, Fan S, Chang Y, et al. Clinical efficacy of cisplatin, dexamethasone, gemcitabine and pegaspargase (DDGP) in the initial treatment of advanced stage (stage Ⅲ-Ⅳ) extranodal NK/T-cell lymphoma, and its correlation with Epstein-Barr virus[J]. Cancer Manag Res, 2019, 11: 3555-3564. doi: 10.2147/CMAR.S191929
[7] Kim SJ, Yoon DH, Jaccard A, et al. A prognostic index for natural killer cell lymphoma after non-anthracycline-based treatment: a multicentre, retrospective analysis[J]. Lancet Oncol, 2016, 17(3): 389-400. doi: 10.1016/S1470-2045(15)00533-1
[8] Wang L, Wang H, Wang JH, et al. Post-treatment plasma EBV-DNA positivity predicts early relapse and poor prognosis for patients with extranodal NK/T cell lymphoma in the era of asparaginase[J]. Oncotarget, 2015, 6(30): 30317-30326. doi: 10.18632/oncotarget.4505
[9] Kwong YL, Pang AWK, Leung AYH, et al. Quantification of circulating Epstein-Barr virus DNA in NK/T-cell lymphoma treated with the SMILE protocol: diagnostic and prognostic significance[J]. Leukemia, 2014, 28(4): 865-870. doi: 10.1038/leu.2013.212
[10] Chen Y, Xin X, Cui Z, et al. Diagnostic Value of Serum Epstein-Barr Virus Capsid Antigen-IgA for Nasopharyngeal Carcinoma: a Meta-Analysis Based on 21 Studies[J]. Clin Lab, 2016, 62(6): 1155-1166. http://europepmc.org/abstract/med/27468579
[11] Lin N, Ku W, Song Y, et al. Genome-Wide Analysis of Epstein-Barr Virus Isolated from Extranodal NK/T-Cell Lymphoma, Nasal Type[J]. Oncologist, 2019, 24(9): e905-e913. doi: 10.1634/theoncologist.2017-0588
[12] Chen Y, Zheng X, Chen B, et al. The clinical significance of Epstein-Barr virus DNA in peripheral blood mononuclear cells in patients with non-Hodgkin lymphoma[J]. Leuk Lymphoma, 2017, 58(10): 2349-2355. doi: 10.1080/10428194.2017.1300894
[13] Wu T, Yang Y, Zhu SY, et al. Risk-adapted survival benefit of IMRT in early-stage NKTCL: a multicenter study from the China Lymphoma Collaborative Group[J]. Blood Adv, 2018, 2(18): 2369-2377. doi: 10.1182/bloodadvances.2018021311
[14] Wu RY, Liu K, Wang WH, et al. Patterns of Primary Tumor Invasion and Regional Lymph Node Spread Based on Magnetic Resonance Imaging in Early-Stage Nasal NK/T-cell Lymphoma: Implications for Clinical Target Volume Definition and Prognostic Significance[J]. Int J Radiat Oncol Biol Phys, 2017, 97(1): 50-59. doi: 10.1016/j.ijrobp.2016.09.013
[15] Qi SN, Xu LM, Yuan ZY, et al. Effect of primary tumor invasion on treatment and survival in extranodal nasal-type NK/T-cell lymphoma in the modern chemotherapy era: a multicenter study from the China Lymphoma Collaborative Group (CLCG)[J]. Leuk Lymphoma, 2019, 60(11): 2669-2678. doi: 10.1080/10428194.2019.1602265
[16] Ito Y, Kimura H, Maeda Y, et al. Pretreatment EBV-DNA copy number is predictive of response and toxicities to SMILE chemotherapy for extranodal NK/T-cell lymphoma, nasal type[J]. Clin Cancer Res, 2012, 18(15): 4183-4190. doi: 10.1158/1078-0432.CCR-12-1064
[17] Su YJ, Wang PN, Chang H, et al. Extranodal NK/T-cell lymphoma, nasal type: Clinical features, outcome, and prognostic factors in 101 cases[J]. Eur J Haematol, 2018, 101(3): 379-388. doi: 10.1111/ejh.13126
[18] Liang JH, Wang L, Gale RP, et al. Efficacy of pegaspargase, etoposide, methotrexate and dexamethasone in newly diagnosed advanced-stage extra-nodal natural killer/T-cell lymphoma with the analysis of the prognosis of whole blood EBV-DNA[J]. Blood Cancer J, 2017, 7(9): e608. doi: 10.1038/bcj.2017.88
[19] Wang XX, Li PF, Bai B, et al. Efficacy of significance of pre-, interim-, and post-treatment plasma Epstein-Barr virus DNA load in NK/T-cell lymphoma treated with P-GEMOX protocol[J]. Leuk Lymphoma, 2019, 60(8): 1917-1925. doi: 10.1080/10428194.2018.1563690
[20] Winter JR, Jackson C, Lewis JE, et al. Predictors of Epstein-Barr virus serostatus and implications for vaccine policy: A systematic review of the literature[J]. J Global Health, 2020, 10(1): 010404. doi: 10.7189/jogh.10.010404
[21] Rao D, Fu M, Chen Y, et al. A combination of two ELISA tests for nasopharyngeal carcinoma screening in endemic areas based on a case-control study[J]. PeerJ, 2020, 8: e10254. doi: 10.7717/peerj.10254
[22] Yao JJ, Lin L, Jin YN, et al. Prognostic value of serum Epstein-Barr virus antibodies in patients with nasopharyngeal carcinoma and undetectable pretreatment Epstein-Barr virus DNA[J]. Cancer Sci, 2017, 108(8): 1640-1647. doi: 10.1111/cas.13296
[23] Tan LP, Tan GW, Sivanesan VM, et al. Systematic comparison of plasma EBV DNA, anti-EBV antibodies and miRNA levels for early detection and prognosis of nasopharyngeal carcinoma[J]. Int J Cancer, 2020, 146(8): 2336-2347. doi: 10.1002/ijc.32656
-
期刊类型引用(1)
1. 闫红华. 能谱CT定量对肝脓肿和肝细胞癌的鉴别诊断价值分析. 影像研究与医学应用. 2025(08): 108-111 .  百度学术
百度学术
其他类型引用(0)




 下载:
下载: