Screening and Verification of TPM1 and CALD1 Related to Diagnosis and Prognosis of Bladder Cancer
-
摘要:目的
筛选及验证膀胱癌诊断与预后相关基因TPM1和CALD1。
方法利用TCGA和GEO数据库中的数据集分别得到414例和188例膀胱癌基因芯片表达数据,通过构建加权基因共表达网络(WGCNA)及识别肿瘤组织与正常组织间差异表达基因的方法,得到与膀胱癌高度相关的枢纽基因。使用STRING数据库构建蛋白互作网络,筛选出预后相关的枢纽基因。将郑州人民医院29例膀胱癌样本及HPA数据库中的免疫组织化学结果作为外部验证结果。
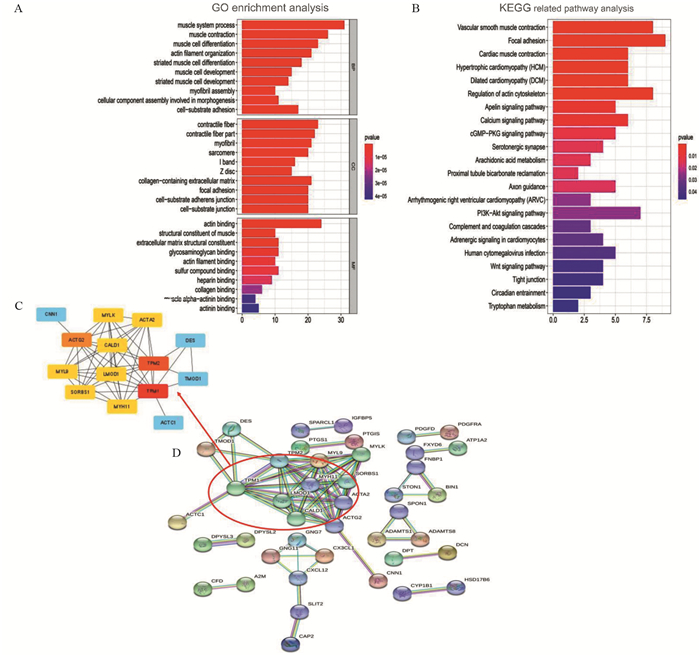
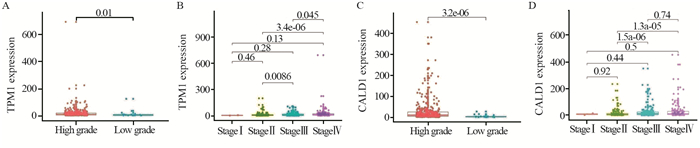
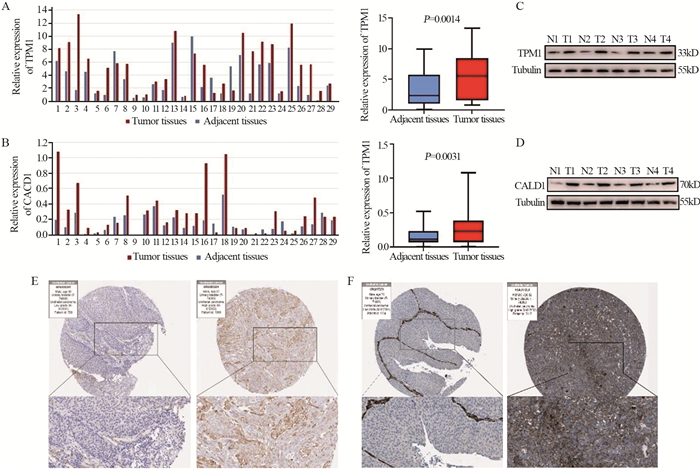
结果TCGA数据库中共筛选出915个差异表达基因,GSE13507中筛选出464个差异表达基因。通过WGCNA得到两个相关性最强的模块:蓝色模块(相关系数为0.60,P=1E-44)和青色模块(相关系数为0.52,P=7E-19),得到156个交集基因。通过蛋白质互作网络分析筛选出10个枢纽基因,其中TPM1和CALD1基因与膀胱癌生存的相关性最大,并得到了外部验证组验证。
结论TPM1和CALD1基因与膀胱癌预后紧密相关,也是促进肿瘤进展的枢纽基因。
Abstract:ObjectiveTo screen and verify hub genes TPM1 and CALD1 that can affect the diagnosis and prognosis of bladder cancer (BLCA).
MethodsWe obtained gene chip expression data of 414 and 188 cases of bladder cancer from TCGA and GEO, respectively. By constructing a weighted gene co-expression network analysis (WGCNA) and identifying differentially-expressed genes between tumor tissues and normal tissues, the pivotal genes that were highly associated with bladder cancer were obtained, and the STRING database was used to construct a protein interaction network to screen out prognostic-related pivotal genes. We took 29 cases of bladder cancer samples from People's Hospital of Zhengzhou as external verification results.
ResultsA total of 915 and 464 differentially-expressed genes were screened from the TCGA database and GSE13507, respectively. Two modules with the strongest correlation were obtained through WGCNA: the blue module (Pearson cor=0.60, P=1E-44) and the cyan module (Pearson cor=0.52, P=7E-19), and 156 intersection genes were obtained. Through protein interaction network analysis, 10 pivotal genes were screened out. TPM1 and CALD1 genes had the greatest correlation with the survival of bladder cancer patients, which was verified by external experimental verification group.
ConclusionTPM1 and CALD1 are closely related to the prognosis of bladder cancer patients. They are also pivotal genes to promote tumor progression.
-
0 引言
三阴性乳腺癌(triple-negative breast cancer, TNBC)恶性程度高,易出现早期复发和内脏转移,是乳腺癌中侵袭性最强,预后最差的亚型[1]。由于缺乏特异性治疗靶点,内分泌治疗和靶向治疗基本无效,化疗仍是晚期TNBC主要的治疗手段。TNBC早期对化疗相对敏感,但随着治疗推进,患者逐渐产生耐药,导致治疗失败及预后不良。接受常规化疗的转移性TNBC患者的中位总生存期仅9~12月[2]。此外,化疗带来的不良反应如心脏毒性、神经毒性、胃肠道反应、骨髓抑制等也不容小觑,严重影响患者生活质量[3]。因此,研发新型抗肿瘤药物是一个亟待解决的难题。
中医药是临床抗癌治疗的重要组成部分,具有多途径、多靶点、多通路的协同抗肿瘤特点,可逆转肿瘤化疗耐药、提高机体免疫功能、抑制肿瘤远处转移[4-5]。槲皮素是一种广泛存在于多种中草药(白花蛇舌草、黄芩、三七)中的黄酮类化合物,具有抗炎、抗氧化、抗病毒、抗肿瘤等药理作用[6-7]。研究表明,槲皮素可通过抑制肿瘤细胞增殖、转移及诱导凋亡等多种途径来发挥抗肿瘤作用[7]。其中,细胞凋亡是诸多抗肿瘤药物杀伤肿瘤细胞的重要途径。文献证实槲皮素在宫颈癌、肺癌、肝癌等多种肿瘤中可通过促进细胞凋亡发挥抗肿瘤作用[8-10]。槲皮素的促凋亡作用涉及多种分子和信号通路,如通过内质网应激途径诱导宫颈癌细胞凋亡[8];通过抑制磷脂酰肌醇3-激酶(phosphatidylinositide 3-kinases, PI3K)/丝氨酸/苏氨酸蛋白激酶B(RAC-α serine/threonine-protein kinase, AKT)信号通路促进肺腺癌细胞凋亡等[9]。TNBC中,槲皮素是否也通过诱导凋亡发挥抗肿瘤作用也是本研究探索的目的。
JAK2/STAT3信号通路是细胞内重要信号转导通路,通过影响下游多种效应分子的活化状态,参与调控肿瘤发生、发展等多个环节[11]。研究表明富含黄酮物质的中药可抑制JAK2/STAT3通路发挥抗肿瘤作用。甘草总黄酮抑制 JAK2/STAT3通路可减小异种移植乳腺癌肿瘤体积[12]。槲皮素可通过抑制JAK2/STAT3信号通路促进直肠癌细胞和卵巢癌细胞凋亡[13-14]。这些研究为我们深入探索槲皮素在TNBC中的促凋亡机制提供了新的思路。本课题组前期利用叶酸修饰构建脂质体槲皮素(folic acid-modified liposome quercetin, FLQ)[15],克服了槲皮素水溶性差、靶向性不足、生物利用度低等问题,旨在探索叶酸修饰脂质体槲皮素是否通过JAK2/STAT3信号通路促进TNBC细胞线粒体途径凋亡,为叶酸修饰脂质体槲皮素应用于临床TNBC治疗提供理论依据。
1 材料与方法
1.1 细胞系及主要试剂
人三阴性乳腺癌细胞系(MDA-MB-231)购自武汉普诺赛生命科技有限公司;DMEM试剂盒、胎牛血清、胰酶和青/链霉素均购自美国Gibco公司;细胞周期检测试剂盒、线粒体膜电位试剂盒和ROS检测试剂盒均购自上海碧云天生物技术有限公司;Annexin V-FITC/PI细胞凋亡试剂盒购自杭州联科生物;RIPA裂解液、PMSF蛋白酶抑制剂及5×蛋白上样缓冲液购自北京索莱宝科技有限公司;ECL发光试剂盒购自美国Advansta公司;JAK2抗体(74987)、STAT3抗体(30835)、p-JAK2抗体(4406)和p-STAT3抗体(9145)均购自美国Cell Signaling Technology公司;细胞色素C(Cytochrome C, Cyt C)抗体(ab133504)和Cleaved-Caspase-3抗体(ab2302)均购自英国Abcam公司;Bcl2抗体(68103-1-Ig)、Bcl-xL抗体(26967-1-AP)、Bax抗体(50599-2-Ig)、Bak抗体(29552-1-AP)、GAPDH抗体(60004-1-Ig)、辣根过氧化物酶标记的山羊抗鼠(SA00001-1)和山羊抗兔(SA00001-2)二抗均购自武汉三鹰生物技术有限公司。
1.2 实验方法
1.2.1 细胞培养
将人三阴性乳腺癌细胞系(MDA-MB-231)置于含10%胎牛血清、100 μg/ml链霉素和100 U/ml青霉素的DMEM培养基中,在含5%CO2、37℃恒温培养箱中培养,待细胞融合至80%~90%进行传代。
1.2.2 叶酸修饰脂质体槲皮素的制备
将槲皮素与卵磷脂、脑磷脂、胆固醇、聚乙二醇混合,再与氯仿混合后溶解于二甲基亚砜中,经真空干燥、水合反应、超声波破碎和微孔滤膜过滤,得到槲皮素脂质体,与N, N-羰基二咪唑和吡啶混合搅拌后加入三乙胺,避光反应6 h后加入含叶酸的二甲基亚砜溶液,再避光反应24 h后加入冰乙醚,抽滤得到滤饼后溶于丙酮,过滤再旋转蒸发至半干状,真空干燥备用,进行细胞实验室时用DMSO溶解,再用完全培养基稀释成需要的浓度。
1.2.3 CCK-8法检测FLQ对TNBC细胞活力的影响
取对数生长期的MDA-MB-231细胞,按3×103/孔接种于96孔板内,24 h后更换为不同浓度的FLQ(0、1、2、4、8、16、32、64、128 μmol/L),分别于FLQ处理后48 h,按照CCK-8试剂盒说明书,向每孔加入100 µl检测液,置于培养箱中孵育2 h,酶标仪检测450 nm处的吸光度值,选择合适的FLQ浓度进行后续实验。细胞活力(%)=(A实验孔-A空白孔)/(A对照孔-A空白孔)×100%。
1.2.4 克隆形成实验检测FLQ对TNBC细胞增殖能力的影响
取对数生长期的MDA-MB-231细胞消化离心(1 000 r/min, 5 min),按200个/孔接种于6孔板内,分为对照组和FLQ组,对照组用0.1%的DMSO处理,FLQ组用20 μmol/L的FLQ处理,置于细胞培养箱中连续培养14天,终止培养后,用甲醛固定后结晶紫染色,计数>50个细胞的克隆数。
1.2.5 流式细胞术检测FLQ对TNBC细胞凋亡的影响
取对数生长期的MDA-MB-231细胞消化离心,按3×105/孔接种于6孔板内,分为对照组和FLQ组,对照组用0.1%的DMSO处理,FLQ组用20 μmol/L的FLQ处理,置于细胞培养箱中培养48 h,收集细胞,预冷的PBS冲洗,1 200 r/min,离心5 min,弃上清液,100 μl Binding buffer制细胞悬液,依次加入Annexin V-FITC和PI染色液各5 μl,室温避光孵育15 min。加入400 μl Binding buffer混悬细胞后上流式细胞仪检测细胞凋亡率。
1.2.6 流式细胞术检测FLQ对TNBC细胞内ROS水平的影响
按照1.2.5分组给药处理细胞48 h,收集细胞,PBS冲洗,1 500 r/min,离心5 min,弃上清液,加入100 μl稀释好的DCFH-DA探针,37℃避光孵育20 min,流式细胞仪检测细胞内ROS水平。
1.2.7 流式细胞术检测FLQ对TNBC细胞线粒体膜电位的影响
按照1.2.5分组给药处理细胞48 h,收集细胞,PBS冲洗,每孔加入1 ml培养基+1 ml JC-1工作液,充分混匀后37℃孵育20 min,1 500 r/min,离心5 min,弃上清液,1×JC-1染色缓冲液洗涤,最后加入适量JC-1染色缓冲液冲悬后,流式细胞仪检测线粒体膜电位。
1.2.8 Western blot检测JAK2/STAT3信号通路及凋亡相关蛋白的表达
取对数生长期的MDA-MB-231细胞以4×105个/孔接种于6孔板内,分为对照组和FLQ组,对照组用0.1%的DMSO处理,FLQ组用20 μmol/L的FLQ处理,48 h后提取总蛋白,BCA定量法定量后,加入5×蛋白上样缓冲液,100℃水浴使蛋白变性。每孔20 μg进行蛋白凝胶电泳,湿法转至PVDF膜,5%脱脂奶粉封闭,TBST洗膜,一抗4℃孵育过夜,TBST洗涤后加入二抗,室温下孵育1 h,TBST洗膜,加入ECL发光液,凝胶成像采集系统采集凝胶图像,Image J软件进行后续分析。
1.3 统计学方法
SPSS 23.0和Graphpad 9.0软件进行统计学分析,结果以均数±标准差表示。两独立样本间的比较用t检验,P<0.05为差异有统计学意义。
2 结果
2.1 FLQ对MDA-MB-231细胞活力的抑制作用
为检测FLQ对MDA-MB-231细胞活性的影响,我们使用不同浓度的FLQ作用于MDA-MB-231细胞48 h后,CCK-8检测细胞活性。结果显示:FLQ可抑制MDA-MB-231细胞活性,并且药物浓度越大,抑制作用越强,呈现剂量依赖性,见图1;FLQ作用于MDA-MB-231的IC50为20.69 μmol/L,因此,采用20 μmol/L的FLQ浓度作用48 h进行后续实验。
2.2 FLQ对MDA-MB-231细胞增殖的抑制作用
与对照组相比,FLQ处理组克隆数量明显减少(P=0.023),说明FLQ可以抑制MDA-MB-231细胞增殖,图2。
2.3 FLQ诱导MDA-MB-231细胞凋亡
与对照组相比,FLQ处理组细胞凋亡显著,细胞凋亡率明显升高(P<0.001),说明FLQ可以诱导MDA-MB-231细胞凋亡,见图3。
2.4 FLQ促进MDA-MB-231细胞线粒体膜电位坍塌
线粒体膜电位下降是凋亡的早期表现,一旦线粒体膜电位损耗,细胞就会进入不可逆的凋亡过程。我们用JC-1染料检测了MDA-MB-231细胞线粒体膜电位的变化。流式细胞术检测结果显示:对照组细胞线粒体膜电位处于较高水平,FLQ处理组细胞线粒体膜电位处于较低水平,两组差异有统计学意义(P=0.003),见图4。提示FLQ对线粒体功能有不利影响,导致MDA-MB-231细胞线粒体膜电位坍塌。
2.5 FLQ促进MDA-MB-231细胞ROS生成
与对照组相比,FLQ处理组生成绿色DCFH荧光信号的细胞比例明显升高(P=0.034),见图5,表明FLQ促进MDA-MB-231细胞内ROS的生成。
2.6 FLQ通过靶向JAK2/STAT3信号通路促进MDA-MB-231细胞凋亡
Western blot检测JAK2/STAT3信号通路中相关蛋白t-JAK2、p-JAK2、t-STAT3、p-STAT3及凋亡相关蛋白Bcl2、Bcl-xL、Bax、Bak、Cyt C、Cleaved-Caspase-3表达。结果显示:与对照组相比,FLQ处理组p-JAK2、p-STAT3表达量明显降低(P<0.001),但t-JAK2、t-STAT3的表达量无明显变化;促凋亡蛋白Bax、Bak、Cyt C、Cleaved-Caspase-3表达量明显升高(P<0.001),而抗凋亡蛋白Bcl2、Bcl-xL表达量明显降低(P=0.037,0.028),见图6。
3 讨论
TNBC是雌激素受体、孕激素受体以及人表皮生长因子受体2均阴性的乳腺癌,约占所有乳腺癌的10%~15%。由于缺乏有效的治疗靶点,TNBC的治疗一直极具挑战性。尽管目前探索TNBC潜在治疗靶点的研究较多,但一直未有突破性进展。TNBC仍缺乏特异有效的治疗药物,整体预后较差[16]。近年来,中药在肿瘤治疗中因其高效低毒的特点受到了越来越多的关注。不断有研究证实中药单体成分可通过调节多种生物学过程,发挥抗肿瘤作用[17-18]。
槲皮素作为多种中药的黄酮类成份,具有多靶点和不易耐药的优势,可以通过调节多种信号通路靶点蛋白抑制肿瘤的发生和发展进程,还可逆转化疗耐药、增加放疗敏感性[19-20]。但槲皮素水溶性较差、代谢较快、半衰期较短,生物利用度较低的特点,限制了其在临床上的使用[21]。近年来,纳米靶向给药体系的研究发展迅速, 将传统的抗肿瘤药物分子以包埋、吸附、囊封或者共价键合的形式,结合在具有纳米尺度的载体上(如脂质体、胶束、纳米粒等),可以一定程度上提高药物溶解性,增加药物的靶向性,延长药物体内循环时间[22]。
基于肿瘤微环境对纳米载体进行有效的表面修饰,可进一步提高药物的靶向递送效率。叶酸是一种小分子维生素,具有无毒、无免疫原性、生物相容性好、结构稳定性高、易于合成与修饰等优点[23]。叶酸受体是一种N-糖基化蛋白,与叶酸有很高的结合亲和力,包括乳腺癌在内的许多肿瘤细胞表面高度表达,但在正常组织中表达水平非常低[24]。在肿瘤治疗中利用叶酸与其受体的特异性结合,能将药物聚集于肿瘤部位,同时减少对正常细胞的毒性,显著增加疗效[25]。
基于此,本研究将槲皮素包载在脂质体中,并用叶酸加以修饰,构建了FLQ,赋予其肿瘤靶向性,在提高其在体内的生物利用度的同时降低全身的不良反应[15]。不受控制的细胞增殖和逃避细胞凋亡是肿瘤的两大特征,抑制增殖和诱导凋亡成为治疗肿瘤的重要途径。本研究结果显示,FLQ可抑制TNBC细胞MDA-MB-231增殖,并呈浓度依赖性;还可促进MDA-MB-231细胞凋亡。
线粒体凋亡途径是细胞凋亡的主要分子途径,线粒体膜电位降低是其发生的特征性标志[17]。本研究中,FLQ可诱导MDA-MB-231细胞线粒体膜电位坍塌,并上调细胞内ROS水平,提示FLQ可能诱导线粒体凋亡途径。线粒体凋亡途径主要受Bcl-2家族蛋白调控。Bcl-2家族蛋白由促凋亡蛋白(Bax等)和抗凋亡蛋白(Bcl-2等)构成,Bcl-2与Bax构成异源二聚体,维持线粒体外膜的完整性,阻止线粒体凋亡反应。在凋亡信号刺激下,Bcl2/Bax比值的发生变化,导致线粒体膜电位降低及通透性增加,释放Cyt C,激活下游Caspase级联反应,启动线粒体凋亡途径[17]。本研究中,FLQ下调Bcl2/Bax比值以及上调Cyt C、Cleaved-Caspase-3蛋白表达,进一步说明FLQ通过诱导线粒体凋亡途径而发挥体外抗TNBC作用。
大量研究表明,JAK2/STAT3信号通路在多种肿瘤中异常活化,发挥其促进肿瘤生长、转移、增强耐药及免疫逃逸的作用。JAK2、STAT3是该通路主要效应子。胞外信号与受体胞外域结合后,激活JAK2并使之磷酸化,随后p-JAK2磷酸化其下游底物STAT3,p-STAT3发生二聚化并转移到细胞核,在细胞核内调节基因转录[26]。既往研究发现,抑制JAK2/STAT3信号通路可诱导肝癌细胞经线粒体途径凋亡,提示该通路参与调控线粒体凋亡通路[27]。本研究结果显示,FLQ显著降低JAK2、STAT3磷酸化水平,同时显著上调Bcl2表达而下调Bax表达,说明FLQ通过作用JAK2/STAT3信号通路而激活线粒体凋亡途径。
综上所述,本研究证实FLQ抑制TNBC细胞MDA-MB-231细胞增殖并诱导其凋亡,阐明FLQ通过靶向JAK2/STAT3信号通路而激活线粒体凋亡途径的分子机制,揭示了FLQ抗TNBC的科学内涵,为FLQ的药效发挥提供理论依据。
Competing interests: The authors declare that they have no competing interests.作者贡献赵阳:实验设计、实施及论文撰写常富江:实验数据分析葛雷、张楠:实验设计及指导单中杰:实验设计及论文审校 -
表 1 引物序列
Table 1 Primer sequences

-
[1] Siegel RL, Miller KD, Jemal A. Cancer statistics, 2020[J]. CA Cancer J Clin, 2020, 70(1): 7-30. doi: 10.3322/caac.21590
[2] von der Maase H, Hansen SW, Roberts JT, et al. Gemcitabine and cisplatin versus methotrexate, vinblastine, doxorubicin, and cisplatin in advanced or metastatic bladder cancer: results of a large, randomized, multinational, multicenter, phase Ⅲ study[J]. J Clin Oncol, 2000, 18(17): 3068-3077. doi: 10.1200/JCO.2000.18.17.3068
[3] Roberts JT, von der Maase H, Sengeløv L, et al. Long-term survival results of a randomized trial comparing gemcitabine/cisplatin and methotrexate/vinblastine/doxorubicin/cisplatin in patients with locally advanced and metastatic bladder cancer[J]. Ann Oncol, 2006, 17 Suppl 5: v118-v122. http://www.ncbi.nlm.nih.gov/pubmed/16034041
[4] Can T. Introduction to bioinformatics[J]. Methods Mol Biol, 2014, 1107: 51-71.
[5] Langfelder P, Horvath S. WGCNA: an R package for weighted correlation network analysis[J]. BMC Bioinformatics, 2008, 9: 559. doi: 10.1186/1471-2105-9-559
[6] Zhang B, Horvath S. A general framework for weighted gene co-expression network analysis[J]. Stat Appl Genet Mol Biol, 2005, 4: Article17. http://genetics.ucla.edu/labs/horvath/GeneralFramework/WeightedNetworkTalkHorvath2005C.pdf
[7] Szklarczyk D, Gable AL, Lyon D, et al. STRING v11: protein-protein association networks with increased coverage, supporting functional discovery in genome-wide experimental datasets[J]. Nucleic Acids Res, 2019, 47(D1): D607-D613. doi: 10.1093/nar/gky1131
[8] Shannon P, Markiel A, Ozier O, et al. Cytoscape: a software environment for integrated models of biomolecular interaction networks[J]. Genome Res, 2003, 13(11): 2498-2504. doi: 10.1101/gr.1239303
[9] Chin CH, Chen SH, Wu HH, et al. cytoHubba: identifying hub objects and sub-networks from complex interactome[J]. BMC Syst Biol, 2014, 8 Suppl 4: S11 http://www.onacademic.com/detail/journal_1000039001218510_5568.html
[10] Tang Z, Kang B, Li C, et al. GEPIA2: an enhanced web server for large-scale expression profiling and interactive analysis[J]. Nucleic Acids Res, 2019, 47(W1): W556-W560. doi: 10.1093/nar/gkz430
[11] Chen W, Zheng R, Baade PD, et al. Cancer statistics in China, 2015[J]. CA Cancer J Clin, 2016, 66(2): 115-132. doi: 10.3322/caac.21338
[12] Jacobs BL, Lee CT, Montie JE. Bladder cancer in 2010: how far have we come?[J]. CA Cancer J Clin, 2010, 60(4): 244-272. doi: 10.3322/caac.20077
[13] Petrova DT, Asif AR, Armstrong VW, et al. Expression of chloride intracellular channel protein 1 (CLIC1) and tumor protein D52 (TPD52) as potential biomarkers for colorectal cancer[J]. Clin Biochem, 2008, 41(14-15): 1224-1236. doi: 10.1016/j.clinbiochem.2008.07.012
[14] Ku BM, Ryu HW, Lee YK, et al. 4'-Acetoamido-4-hydroxychalcone, a chalcone derivative, inhibits glioma growth and invasion through regulation of the tropomyosin 1 gene[J]. Biochem Biophys Res Commun, 2010, 402(3): 525-530. doi: 10.1016/j.bbrc.2010.10.068
[15] Yager ML, Hughes JAI, Lovicu FJ, et al. Functional analysis of the actin-binding protein, tropomyosin 1, in neuroblastoma[J]. Br J Cancer, 2003, 89(5): 860-863. doi: 10.1038/sj.bjc.6601201
[16] Alaiya AA, Oppermann M, Langridge J, et al. Identification of proteins in human prostate tumor material by two-dimensional gel electrophoresis and mass spectrometry[J]. Cell Mol Life Sci, 2001, 58(2): 307-311. doi: 10.1007/PL00000858
[17] Tang HY, Beer LA, Tanyi JL, et al. Protein isoform-specific validation defines multiple chloride intracellular channel and tropomyosin isoforms as serological biomarkers of ovarian cancer[J]. J Proteomics, 2013, 89: 165-178. doi: 10.1016/j.jprot.2013.06.016
[18] Zare M, Jazii FR, Soheili ZS, et al. Downregulation of tropomyosin-1 in squamous cell carcinoma of esophagus, the role of Ras signaling and methylation[J]. Mol Carcinog, 2012, 51(10): 796-806. doi: 10.1002/mc.20847
[19] Thorsen K, Sørensen KD, Brems-Eskildsen AS, et al. Alternative splicing in colon, bladder, and prostate cancer identified by exon array analysis[J]. Mol Cell Proteomics, 2008, 7(7): 1214-1224. doi: 10.1074/mcp.M700590-MCP200
[20] Pawlak G, Mcgarvey TW, Nguyen TB, et al. Alterations in tropomyosin isoform expression in human transitional cell carcinoma of the urinary bladder[J]. Int J Cancer, 2004, 110(3): 368-373. doi: 10.1002/ijc.20151
-
期刊类型引用(1)
1. 闫红华. 能谱CT定量对肝脓肿和肝细胞癌的鉴别诊断价值分析. 影像研究与医学应用. 2025(08): 108-111 .  百度学术
百度学术
其他类型引用(0)




 下载:
下载: