Identification of Drug-resistance Core Genes and Drug Targets in Lung Adenocarcinoma Patients Harboring ALK Fusion Gene
-
摘要:目的
探讨ALK融合基因阳性肺腺癌患者原发灶及转移灶基因表达谱的差异,从而探索转移灶耐药机制及相应的药物靶点分析。
方法GEO数据库中选取GSE125864,根据肿瘤组织取材部位不同分为原发灶组和转移灶组。首先,比较两组患者之间显著差异基因的表达,并分析这些显著差异基因在生物学功能和富集信号通路等方面的不同;其次,对显著差异基因进行蛋白-蛋白互作网络分析及关键模块、核心基因分析。最后,基于TCGA和癌症治疗反应门户数据库对筛选的10个关键核心进行预后、药物靶点预测等分析。
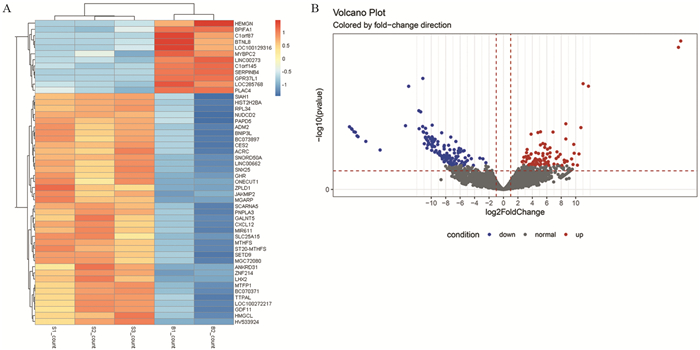
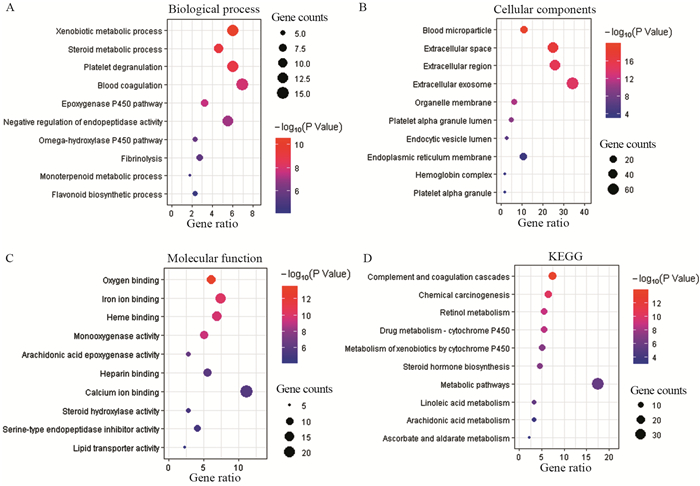
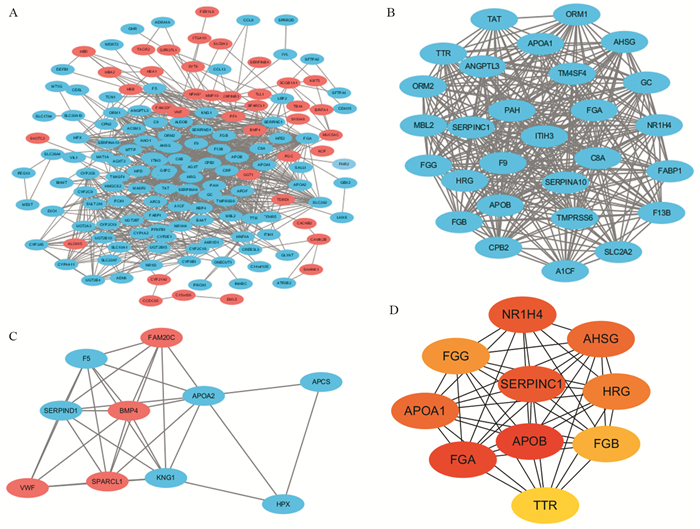
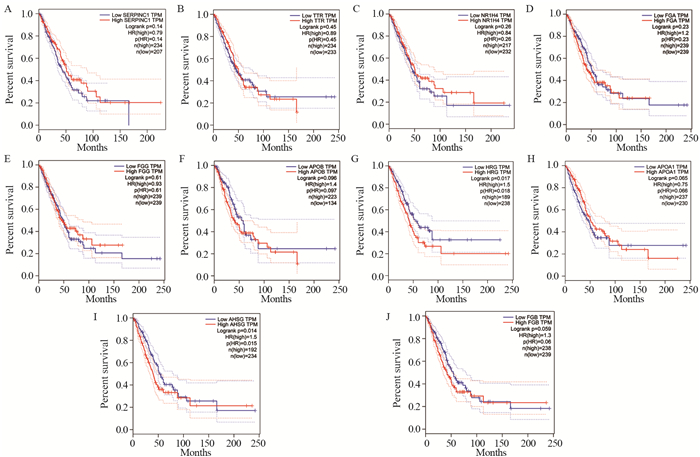
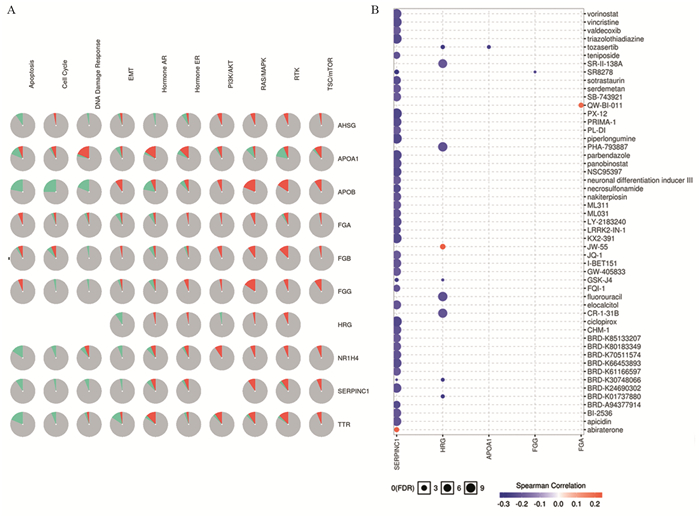
结果共筛选出227个差异基因,以肺腺癌原发灶为对照组,转移灶中共发现134个上调基因,93个下调差异基因;GO和KEGG富集分析显示,这些差异基因的功能主要涉及补体和凝血级联、化学致癌作用、视黄醇的新陈代谢等信号通路;通过蛋白-蛋白互作网络分析,筛选了10个核心基因,其中HRG、AHSG基因表达与肺腺癌不良预后相关,SERPINC1、HRG、APOA1、FGA、FGG等与多种潜在的小分子药物有一定相关性。
结论显著差异基因涉及的分子功能及信号通路可能引起ALK阳性肺腺癌患者转移灶耐药。
Abstract:ObjectiveTo compare DEGs between primary and metastatic lesions in lung adenocarcinoma patients with positive ALK fusion gene, and to explore the mechanism of drug-resistance and the potential drug targets in metastatic lesions of lung adenocarcinoma patients.
MethodsGSE125864 was obtained from GEO database. According to the different sampling sites of tumor tissue, two groups were divided: primary tumor lesions group and metastatic tumor lesions group. The DEGs between the two groups were compared, and the differences in biological functions and enrichment signaling pathways of these DEGs were analyzed. The protein-protein interaction network was constructed and applied to screen hub genes. Based on TCGA and cancer treatment response portal database, the prognosis and drug target prediction of the 10 key cores were analyzed.
ResultsIn total, 227 DEGs were identified, with 134 upregulated DEGs and 93 downregulated DEGs in the metastatic tumor lesions group, compared with primary tumor lesions group. GO and KEGG enrichment analyses showed that the functions of these DEGs were mainly involved in complement and coagulation cascade, chemical carcinogenesis and retinol metabolism pathways. The top 10 hub genes with the highest degree were analyzed in the protein-protein interaction network. The expression of HRG and AHSG genes were associated with poor prognosis of lung adenocarcinoma patients, and SERPINC1, HRG, ApoA1, FGA and FGG genes were correlated with a variety of potential small molecule drugs.
ConclusionThe molecular functions and signaling pathways involved in DEGs may induce drug-resistance in metastatic ALK-positive lung adenocarcinoma patients.
-
Key words:
- Lung adenocarcinoma /
- Positive ALK fusion gene /
- Bioinformatics /
- Heterogeneity /
- Drug targets
-
0 引言
滑膜肉瘤(Synovial sarcoma, SS)作为间叶组织来源的高度恶性软组织肿瘤(Soft tissue sarcoma, STS),以四肢的大关节为好发部位,也可发生于前臂、大腿、腰背部的肌膜和筋膜上,多发于20~40岁的青壮年,男性多于女性[1]。其主要临床症状以局部肿胀、肿块、疼痛,活动受限为主,约占原发性软组织恶性肿瘤的10%[2-3]。目前,伴有转移SS的治疗暂时没有标准方案,手术切除是SS患者的主要治疗手段,放疗主要用于SS的局部控制或预防复发。对于晚期患者,通常采取化疗进行辅助治疗[4-6]。近年来,随着治疗手段的提高,尤其有潜力的治疗靶点被不断发现,可选择的靶向药越来越多,如阿帕替尼、培唑帕尼等,SS的5年和10年生存率有较大幅度的提升,分别达到了40%~75%和11%~50%[7-8]。作为多靶点酪氨酸激酶抑制剂(Tyrosine kinase inhibitors, TKIs),培唑帕尼通过抑制血管内皮生长因子受体实现抑制肿瘤浸润和转移的作用。目前,国内少见培唑帕尼应用于晚期滑膜肉瘤的临床文献报道。因此,本文旨在讨论晚期滑膜肉瘤患者应用培唑帕尼(Pazopanib)联合常规化疗药物的临床疗效和药物安全性。
1 资料与方法
1.1 一般资料
收集本院2018年1月至2023年12月收治的滑膜肉瘤患者的所有资料。纳入标准:(1)初诊病理检查或SS18-SSX染色体融合基因检测明确诊断为滑膜肉瘤;(2)初诊时未出现器官转移。排除标准:(1)美国东部肿瘤协作组(Eastern Cooperative Oncology Group, ECOG)评分>1分;(2)初诊后未发生器官转移;(3)未接受培唑帕尼联合化疗方案治疗;(4)患者失访。经筛选共有64例患者纳入本研究,其中男性患者40例,女性患者24例,中位发病年龄40岁(95%CI: 35.128~44.872),原发于四肢24例,躯干26例,头颈14例,转移部位主要以肺部(34例)和淋巴结(18例)为主,其他转移部位包括肾上腺(3例)、胸膜(2例)、精索(2例)及骨(5例)等,所有患者此前均接受过手术治疗,其中50例患者曾接受过放疗。所有对象均接受培唑帕尼联合化疗治疗的方案,采取一线化疗方案26例、二线化疗方案19例、三线化疗方案19例。所有患者从开始培唑帕尼治疗后随访至出现疾病进展或死亡,通过后续复查资料及电话随访获得患者的生存状态,随访截至2024年2月20日,患者随访时间为1.2~69.2个月,中位随访时间33.25个月(95%CI:29.83~36.67)。所有入选患者均有病理学及影像学检查资料,至少有1个可测量病灶。该研究获得本院伦理委员会审核批准(批准函号:2024-084-16)和受试对象或其亲属的知情同意;符合2013年修订的《赫尔辛基宣言》。主要特征见表1。
表 1 晚期滑膜肉瘤患者的一般特征(N=64)Table 1 Characteristics of patients with advanced synovial sarcoma (N=64)Characteristics n (%) Gender Male 40 (62.5) Female 24 (37.5) Age (years) ≥40 27 (42.2) <40 37 (57.8) ECOG 0 42 (65.6) 1 22 (34.4) Primary tumor sites Head-neck 14 (21.9) Limbs 24 (37.5) Trunk 26 (40.6) Metastasis sites Lung 34 (53.1) Lymph node 18 (28.1) Bone 5 (7.8) Adrenal gland 3 (4.7) Spermatic cord 2 (3.1) Intestinal tract 2 (3.1) Chemotherapy regimen First line 26 (40.6) Second line 19 (29.7) Third line 19 (29.7) Treatment Surgery 64 (100.0) Radiotherapy 50 (78.1) Chemotherapy 64 (100.0) 1.2 治疗方案
一线化疗药物有蒽环类药物和异环磷酰胺,二、三线化疗药物有长春新碱、多西他赛、吉西他滨、顺铂和达卡巴嗪等。其中培唑帕尼给药方式为800 mg/d,持续给药,直至出现疾病进展或者出现患者无法耐受的不良反应。
连续服药6周后,对治疗效果进行一次评估。在整个治疗期间,持续跟踪患者的用药情况和不良反应。用药过程中一旦出现漏服,将根据距离下次用药时间是否超过12小时来判断是否补充服药;如果不超过12小时,则不需要补服。对于不良反应,如果出现Ⅲ级不良事件,降低药物剂量至600 mg/d;如果出现Ⅳ级不良事件,停止给药,给予对症治疗,待症状缓解后,再恢复给药并降级给药。治疗将持续至肿瘤出现进展、患者死亡或失访。
1.3 评价指标
以实体肿瘤的疗效评价标准(RECIST)1.1版为依据对患者肿瘤情况进行统计。主要研究指标为肿瘤无进展生存期(Progression-free survival, PFS),即用药开始至疾病进展或死亡的时间。次要研究指标为客观缓解率(Objective response rate, ORR)和疾病控制率(Disease control rate, DCR),且对患者用药后的不良事件发生情况进行统计。
1.4 统计学方法
采用SPSS 22.0软件进行统计学分析,采用Kaplan-Meier法进行生存函数分析和Log-rank检验进行组间生存比较。采用Cox回归构建多因素回归模型,分析PFS的预后影响因素,P<0.05为差异具有统计学意义。
2 结果
2.1 疗效评价
所有患者的中位PFS为7.55个月(95%CI: 6.320~8.780),见图1。部分缓解(Partial response, PR)33例(51.6%),疾病稳定(Stable disease, SD)12例(18.8%),疾病进展(Progression disease, PD)19例(29.7%);客观缓解率(ORR)为51.6%(33/64),疾病控制率(DCR)为70.3%(45/64)。其中,采用一线方案治疗的26例患者ORR为65.4%(17/26),DCR为73.1%(19/26),中位PFS为9.167个月(95%CI:6.362~11.971);采用二线方案的19例患者ORR为47.4%(9/19),DCR为73.7%(14/19),中位PFS为7.55月(95%CI:6.054~9.046),采用三线方案的19例患者ORR为36.8%(7/19),DCR为63.2%(12/19),中位PFS为6.09月(95%CI:3.158~9.022)。接受培唑帕尼联合一线化疗方案的患者较接受培唑帕尼联合二、三线方案的患者PFS延长(P=0.006),不同化疗方案PFS对比曲线见图2。患者的PFS时间与患者的性别(P=0.723)、年龄(P=0.844)、是否肺转移(P=0.161)无显著相关性,患者不同性别、不同年龄、是否肺转移的PFS对比曲线见图3。纳入性别、年龄、肺转移等预后相关因素进行多因素Cox回归分析同样证实了化疗方案是患者PFS的独立预测因子(P=0.001),见表2。
表 2 滑膜肉瘤患者生存预后相关因素分析结果Table 2 Analysis results of prognostic factors related to survival of synovial sarcoma patientsVariable Survival Univariate analysis Multivariate analysis PFS (months) 95%CI χ2 P HR 95%CI P Chemotherapy regimen First line 9.167 6.362–11.971 10.395 0.006 Ref Second line 7.550 6.054–9.046 1.604 0.815–3.160 0.172 Third line 6.090 3.158–9.022 4.020 1.721–9.396 0.001 Gender Female 7.770 6.127–9.413 0.125 0.723 0.836 Ref Male 7.230 5.841–8.619 0.445–1.569 0.576 Age (years) <40 7.430 5.735–9.125 0.039 0.844 0.981 Ref ≥40 7.550 5.627–9.473 0.547–1.761 0.949 Lung metastasis No 9.767 5.616–13.918 1.969 0.161 1.575 Ref Yes 6.660 4.951–8.369 0.868–2.858 0.135 2.2 不良反应
不良反应主要包括乏力、肝功能损害、高血压、发色改变、造血系统毒性、腹泻及手足综合征等,均以Ⅰ/Ⅱ级为主,Ⅲ/Ⅳ级不良事件占比较少。在治疗过程中,共有16例(25%)患者出现了Ⅲ/Ⅳ级不良事件以及患者主观不能耐受原剂量用药反应,遂对其进行了药量调整和暂时停药,经过对症处理后,不良反应均可被缓解,截至随访结束,无死亡事件发生,见表3。
表 3 所有接受治疗的滑膜肉瘤患者不良反应汇总(n(%))Table 3 Summary of adverse events in all treated patients with synovial sarcoma (n(%))Adverse events Grade Ⅰ/Ⅱ Grade Ⅲ/Ⅳ Total Fatigue 20 (31.25) 2 (3.13) 22 (34.38) Hand-foot syndrome 11 (17.19) 2 (3.13) 13 (20.31) Nausea/vomiting 14 (21.88) 0 (0.00) 14 (21.88) Diarrhea 23 (35.93) 5 (7.81) 28 (43.75) Stomatitis 8 (12.50) 0 (0.00) 8 (12.50) Hypertension 14 (21.88) 0 (0.00) 14 (21.88) Edema 5 (7.81) 0 (0.00) 5 (7.81) Lightening of skin color 8 (12.50) 0 (0.00) 8 (12.50) Change in hair color 34 (53.13) 0 (0.00) 34 (53.13) Leucopenia 23 (35.94) 2 (3.13) 25 (39.06) Thrombocytopenia 26 (40.63) 5 (7.81) 31 (48.44) Anemia 29 (45.31) 0 (0.00) 29 (45.31) Liver function impairment 14 (21.88) 0 (0.00) 14 (21.88) Kidney function impairment 8 (12.50) 0 (0.00) 8 (12.50) Hypothyroidism 11 (17.19) 0 (0.00) 11 (17.19) 3 讨论
对于滑膜肉瘤的治疗,化疗是最常见的治疗手段。相较于其他STS,滑膜肉瘤对异环磷酰胺、蒽环类药物以及曲贝替定等化疗药物的敏感性较高,蒽环类药物作为一线化疗选择,其有效率为16%~27%,特别是针对SS而言,研究表明晚期SS患者对异环磷酰胺的敏感性更高,其有效性已得到广泛认可[9-14]。在国内,常用的SS化疗方案为阿霉素(Adriamycin)与异环磷酰胺(Ifosfamide)(AI)组合,其有效率为25%~60%[15]。目前,国内对于进展期的SS没有标准的二线及以上的化疗方案,吉西他滨、多西他赛和达卡巴嗪等药物作为二线化疗方案在STS的治疗中有一定的效果[16-17]。有研究显示,对于进展期的STS患者应用二线化疗方案,其疗效并不理想,患者的PFS通常只有6个月左右,而中位OS也仅在1年左右[18-20]。因此,过去的化疗研究更多地关注STS整体,缺少针对SS的大样本随机试验证据。对于滑膜肉瘤的治疗,临床上迫切需要进一步的研究和探索。
近年来,随着新兴分子靶向药物的研究进展,其在SS上也有所应用,并展示出不错的效果。作为应用较多的分子靶向药物,以抑制血管内皮生长因子受体(Vascular endothelial growth factor receptor, VEGFR)为靶点的TKIs类的靶向药对SS患者具有一定疗效,如安罗替尼、阿帕替尼和培唑帕尼等[21-24]。其中,培唑帕尼作为多靶点抗血管生成药物,于2012年4月27日首次被美国食品药品监督管理局(Food and Drug Administration, FDA)批准用于除脂肪肉瘤(Liposarcoma, LPS)和胃肠道间质瘤(Gastrointestinal stromal tumors, GIST)外非特指STS的二线治疗。在国内,培唑帕尼获批的适应证是晚期肾细胞癌患者的一线治疗,以及曾接受细胞因子治疗的晚期肾细胞癌患者的治疗,迄今未获批治疗STS的适应证,因此,目前尚缺乏培唑帕尼用于晚期滑膜肉瘤临床数据。
国际上,培唑帕尼在治疗滑膜肉瘤、平滑肌肉瘤和腺泡状软组织肉瘤等多种STS时,患者的PFS、ORR和DCR均有提高[25]。有研究表明培唑帕尼联合异环磷酰胺的Ⅰ期临床试验报道了两例SS患者获得部分缓解[26]。Sleijfer等[27]发现培唑帕尼用于治疗软组织肉瘤的Ⅱ期研究中,41例接受治疗的平滑肌肉瘤患者在用药12周时的无进展生存率(Progression-free rate, PFR)为44%。作为二线或三线治疗药物,使用培唑帕尼治疗的平滑肌肉瘤组的临床获益率超过40%,非子宫平滑肌肉瘤患者OS为12.9个月,子宫平滑肌肉瘤患者OS则达到了16.5个月[28]。一项Ⅱ期临床研究显示培唑帕尼对于脂肪肉瘤治疗有一定效果,41例脂肪肉瘤患者以800 mg/d、28 d为一个疗程给予培唑帕尼治疗,用药24周后,PR和SD的比率为44%,中位PFS和中位OS分别为4.4个月和12.6个月[29]。土耳其和韩国分别进行的多中心回顾性研究结果均显示帕唑帕尼在治疗STS方面有效且耐受性良好[30-31]。
本研究开展了培唑帕尼应用于滑膜肉瘤的疗效分析,所有患者采用培唑帕尼联合化疗的治疗方案。其中位PFS为7.55个月(95%CI:6.320~8.780),相较于国外PALETTE的Ⅲ期临床试验[32]中接受培唑帕尼治疗的患者的无进展生存时间有显著改善(7.55 vs. 4.6个月),说明培唑帕尼联合化疗的治疗效果优于培唑帕尼单用效果,而联合一线化疗方案PFS为9.167个月(95%CI:6.362~11.971),较二线方案PFS 7.55月(95%CI:6.054~9.046)、三线方案PFS 6.09月(95%CI:3.158~9.022)有所延长(P=0.006)。性别、年龄、肺转移与生存预后无统计学差异(P>0.05)。同时,在药物安全性方面,也对不良反应进行了统计,观察到的主要不良反应涵盖乏力(34.38%)、血小板减少(48.44%)、肝功能受损(21.88%)、腹泻(43.75%)和甲状腺功能减退(17.19%)等。值得注意的是,Ⅲ/Ⅳ级的不良事件较为罕见,这些不良反应的情况与文献[33-34]中报道的相似。针对不良事件,在经过适当处理后都能够有效缓解。
综上所述,培唑帕尼与化疗联合应用于晚期SS的治疗,患者的中位PFS有所改善,同时不良反应的情况可以接受,可以为后续晚期SS的治疗起到一定的指导作用。本研究作为单中心回顾性研究,样本数量较少,且不同治疗方案间影响因素较多,研究存在一定的局限性,因此,未来需扩大样本量,进一步开展深入的前瞻性研究。
Competing interests: The authors declare that they have no competing interests.作者贡献:祁春艳:课题思路设计、数据分析及文章撰写吴涛:数据筛选和分析齐晓光:文章思路设计、审阅文章数据及校对工作 -
-
[1] Woo CG, Seo S, Kim SW, et al. Differential protein stability and clinical responses of EML4-ALK fusion variants to various ALK inhibitors in advanced ALK-rearranged non-small cell lung cancer[J]. Ann Oncol, 2017, 28(4): 791-797. doi: 10.1093/annonc/mdw693
[2] Cancer Genome Atlas Research Network. Comprehensive molecular profiling of lung adenocarcinoma[J]. Nature, 2014, 511(7511): 543-550. doi: 10.1038/nature13385
[3] Neumann MP, González MV, Pitiot AS, et al. TP53 p. R72P genotype is a marker of poor prognosis in lung cancer[J]. Cancer Biomark, 2018, 21(4): 747-754. doi: 10.3233/CBM-170230
[4] Kuroda H, Yoshida T, Arimura T, et al. Contribution of smoking habit to the prognosis of stage I KRAS-mutated non-small cell lung cancer[J]. Cancer Biomark, 2018, 23(3): 419-426. doi: 10.3233/CBM-181483
[5] Chen XL, Xie KX, Yang ZL, et al. Expression of FXR and HRG and their clinicopathological significance in benign and malignant pancreatic lesions[J]. Int J Clin ExpPathol, 2019, 12(6): 2111-2120. http://www.ncbi.nlm.nih.gov/pubmed/31934033
[6] Bogoevska V, Wolters-Eisfeld G, Hofmann BT, et al. HRG/HER2/HER3 signaling promotes AhR-mediated Memo-1 expression and migration in colorectal cancer[J]. Oncogene, 2017, 36(17): 2394-2404. doi: 10.1038/onc.2016.390
[7] Fogarty FM, O'Keeffe J, Zhadanov A, et al. HRG-1 enhances cancer cell invasive potential and couples glucose metabolism to cytosolic/extracellular pH gradient regulation by the vacuolar-H+ ATPase[J]. Oncogene, 2014, 33(38): 4653-4663. doi: 10.1038/onc.2013.403
[8] Niu L, Song X, Wang N, et al. Tumor-derived exosomal proteins as diagnostic biomarkers in non-small cell lung cancer[J]. Cancer Sci, 2019, 110(1): 433-442. doi: 10.1111/cas.13862



 下载:
下载: