Comparison of Efficiency and Safety Between Radiofrequency Ablation and Stereotactic Body Radiotherapy on Primary Small Hepatocellular Carcinoma
-
摘要:目的
比较射频消融术(radiofrequency ablation, RFA)和立体定向放射治疗(stereotactic body radiotherapy, SBRT)对原发性小肝癌患者的临床疗效及安全性。
方法回顾性分析2013年6月至2015年3月河南省肿瘤医院收治的肝癌患者86例,RFA组49例、SBRT组37例。比较两组近期疗效、不良反应发生情况以及随访2年总生存率和肿瘤病灶局部控制率。
结果两组患者基线资料差异无统计学意义。RFA组患者近期治疗有效率为81.9%,疾病控制率达到95.9%;SBRT组近期有效率为83.8%,疾病控制率达到91.9%,两组差异无统计学意义。两组治疗后均未出现严重并发症。RFA组治疗后1年和2年总生存率为95.9%和85.7%,SBRT组分别为91.9%和83.8%,两组差异无统计学意义。
结论RFA介入治疗与SBRT治疗对肿瘤直径≤5 cm的单发肝癌患者具有较好的近期和远期疗效,对于不适合手术切除的肝癌患者,立体定向放疗可以作为射频消融术治疗的一种替代手段。
Abstract:ObjectiveTo compare the clinical efficiency and safety between radiofrequency ablation (RFA) and stereotactic body radiotherapy(SBRT) on primary small hepatocellular carcinoma patients with tumor diameter ≤5 cm.
MethodsWe retrospectively analyzed the clinical data of 86 patients with hepatocellular carcinoma in He'nan Province Tumor Hospital from June 2013 to March 2015, 49 cases in RFA group and 37 cases in SBRT group. The short-term clinical efficiency and adverse effects were compared. The 2-year overall survival(OS) and local control(LC) rate were followed up.
ResultsThere was no significant difference in the baseline characteristics between two groups. Short-term efficiency and the local control rate were 81.9% and 95.9% in RFA group, while 83.8% and 91.9% in SBRT group, with no significant difference. No severe complications occurred in any patients after treatment. The 1-and 2-year overall survival rates were 95.9% and 85.7% in RFA group, while 91.9% and 83.8% in SBRT group, with no significant difference.
ConclusionRFA has comparable short-and long-term effects as SBRT on single hepatocellular carcinoma with tumor diameter ≤5 cm, and SBRT may serve as an alternative option of RFA on hepatocellular carcinoma patients who were unavailable for surgical resection.
-
0 引言
肝细胞癌(hepatocellular carcinoma, HCC)约占肝癌的90%,是死亡率第三位的癌症[1]。肝癌的发生具有地区差异,慢性肝炎、肝硬化是肝癌发生的高危因素。近年来对高危人群的定期筛查促使更多的小肝癌被确诊[2]。射频消融术(radiofrequency ablation, RFA)作为一种安全微创的局部介入治疗方法已逐步成为早期HCC的根治性治疗方案,对于合并肝硬化或术后复发无法行切除术的HCC患者具有重要意义[3]。立体定向放射治疗(stereotactic body radiotherapy, SBRT)对肿瘤部位进行精准定位而选择性地对肿瘤部位进行高剂量照射而减少对周围正常组织的损伤[4]。SBRT被认为是不能进行手术切除、肝移植和RFA的小肝癌患者的治疗选择。本研究回顾性分析86例初治或复发的小肝细胞癌患者的临床资料,并比较两种方法的临床效果和安全性。
1 资料与方法
1.1 研究资料
回顾性分析2013年6月至2015年3月在河南省肿瘤医院肿瘤介入和放射治疗中心行立体定向放射治疗或射频消融术的初治或复发的86例HCC患者的临床资料,按照治疗方法分为RFA组和SBRT组。病例纳入标准:CT、MRI等影像学手段及肝穿刺病理学检查等确诊为HCC;单发肿瘤,最大直径≤5 cm;无血管、淋巴管和肝外转移灶;不适或拒绝手术切除治疗;肝功能分级Child-Pugh A或B,或经内科治疗达到该标准;无RFA或SBRT临床禁忌证,治疗前签署知情同意书。符合入选标准患者共计86例,其中RFA组49例、SBRT组37例。两组患者治疗期间均给予保肝降酶等治疗,对HBV定量高的患者进行抗病毒治疗。
1.2 射频消融术治疗
所有RFA治疗的患者均在CT或经皮超声诊断仪引导穿刺下进行,射频消融术采用美国Radio TherapeuticsTM RF2000型射频治疗仪和冷循环电极针。根据患者肝内病灶的位置选取平卧位或侧卧位,拟定最佳穿刺点、穿刺路径及消融电极,单次手术时不同病灶尽量选择同一穿刺点,并在患者体表标记。0.2%利多卡因局部麻醉,超声引导下将电极针穿入肝肿瘤深面进行穿刺,针尖穿透肿瘤达到对侧边缘外0.5~1.0 cm,启动冷循环泵,在此张开电极开始消融。RFA设置为手动档,根据肿瘤的阻抗变换,输出功率在80~200 W范围内自动调节,每次消融时间12 min。对肿瘤较大者行多方位布针、多点多针多角度反复治疗,以保证消融范围达到整个瘤灶连同周围0.5~1.0 cm的肝组织完全灭活。
1.3 立体定向放射治疗
为了控制患者治疗过程中的呼吸频率,入组患者在SBRT计划实施前均进行呼吸运动的训练以达到呼吸浅慢的目的,治疗过程中并采用Body Pro-LokTM系统进行压腹,使肝脏的运动幅度控制在5 mm以内。所有患者采用伽玛射线立体定向体部放射治疗系统(KLF-A型,武汉康桥公司)。根据病灶位置治疗体位分别采用仰卧位或俯卧位,螺旋CT以3~5 mm层距连续扫描病变区域,扫描资料上传至计划治疗系统,靶区重建,然后由两名经验丰富的医师对大体肿瘤体积(gross tumor volume, GTV)和重要器官进行确认和输入,以确定计划靶区体积(planning target volume, PTV)并避开重要器官。PTV在GTV基础上外放1.0 cm。调整照射野,50%~60%处方等剂量曲线包绕PTV,每天每次4~5 Gy,每周5次,共照射10次,总剂量40~50 Gy。
1.4 疗效评价和随访
所有患者在RFA或SBRT治疗结束后1~3月复查血常规、肝功能、甲胎蛋白AFP并行CT或MRI等影像学检查。观察临床症状的改善,参照美国肝脏疾病研究协会制定的改良版实体瘤近期疗效评价标准(mRECIST)评价治疗后的病灶局部缓解率。完全缓解(complete response, CR)指所有目标病灶动脉期增强显影均消失;部分缓解(partial response, PR)指动脉增强显影示目标病灶直径缩小总和≥30%;稳定(stable disease, SD)指目标病灶直径缩小<30%或增加<20%;疾病进展(progressive disease, PR)指目标病灶直径增加≥20%,或出现新病灶。治疗有效包括CR和PR,疾病控制包括CR、PR和SD;根据CTCAE4.0标准评价放射性损伤后不良反应的发生率等。定期随访3~24月,复查AFP值,记录12月和24月患者生存率(overall survival, OS)和局部控制率(local control, LC)。局部控制率指影像学显示肿瘤直径无增大的患者总数的比例。
1.5 统计学方法
采用SPSS22.0软件进行统计分析,计数资料以百分比表示,卡方检验比较组间差异,计量资料采用平均数±标准差(x±s)表示,t检验比较两组间差异,ANOVA比较两组以上差异。生存分析采用Kaplan-Meier法。P<0.05为差异有统计学意义。
2 结果
2.1 一般临床资料
接受RFA治疗的患者49例,其中男36例(73.5%)、女13例(26.5%),中位年龄56岁(36~79岁),并发肝硬化患者46例(93.9%)。术前AFP平均水平为(659.3±143.6)mmol/L。接受SBRT治疗的患者37例,其中男26例、女11例,中位年龄为58岁(34~82岁),并发肝硬化患者34例(91.9%)。术前AFP水平为(616.4±132.6)mmol/L。两组患者基本临床特征,如合并肝病类型、Child-Pugh评分、术前肝功能生化指标、肿瘤大小差异均无统计学意义(均P>0.05),见表 1。
表 1 RFA和SBRT组患者基本临床特征Table 1 Baseline characteristics of patients in RFA and SBRT group
2.2 近期疗效
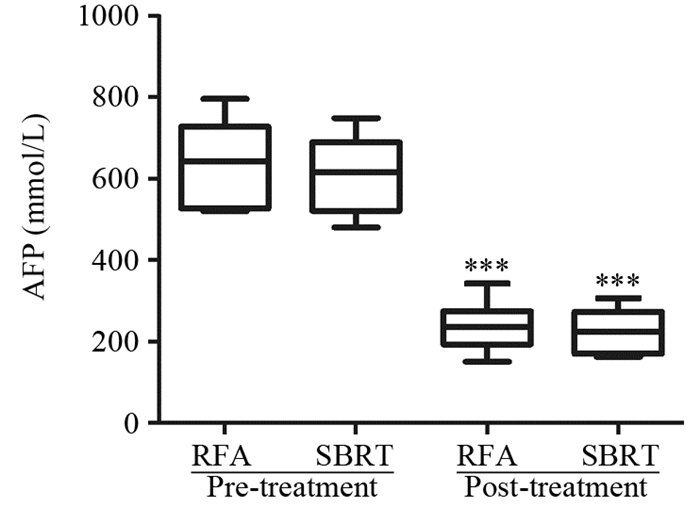
RFA组患者在接受治疗3月后,CR为24例(48.9%),PR为16例(32.7%),SD为7例(14.3%),PD为2例(4.1%),治疗有效率为81.6%,疾病控制率达95.9%。SBRT患者治疗3月后,CR为15例(40.6%),PR为16例(43.2%),SD为3例(8.1%),PD为3例(8.1%),治疗有效率为83.8%,疾病控制率达91.9%。两组患者治疗有效率相比,差异无统计学意义(χ2=0.068, P=0.795)。疾病控制率差异亦无统计学意义(χ2=0.624, P=0.430)。治疗3月后,两组患者治疗后较治疗前,AFP含量均下降,采用配对t检验分析,差异均有统计学意义(RFA组:t=11.51, P<0.001;SBRT组:t=11.78, P<0.001);但治疗后两组患者血清AFP含量差异无统计学意义(t= 0.467, P=0.648),见图 1。
2.3 治疗后不良反应发生率
RFA组患者术后6例出现恶心;18例(36.7%)患者于术后第2~3天开始发热,其中5例体温超过38.5℃,给予抗感染、退热等治疗后,3~5天好转;15例(30.6%)患者出现肝区疼痛,31例出现转氨酶升高,经对症治疗和保肝治疗一周后均得到有效缓解。无手术死亡、出血、针道转移、周围脏器损伤、胆瘘等3级以上严重并发症发生。SBRT组患者主要的放疗后急性不良反应为肝区不适28例(75.7%)、厌食呕吐25例(67.6%)、转氨酶升高12例(32.4%)以及血小板下降14例(37.8%),所有患者对症治疗1周左右逐渐缓解。SBRT术后无3级以上严重胃肠道并发症发生,如出血和胃肠穿孔等,见表 2。
表 2 RFA和SBRT组治疗后不良反应的发生情况Table 2 Adverse events in RFA and SBRT groups after treatment based on CTCAE 4.0
2.4 随访和远期疗效
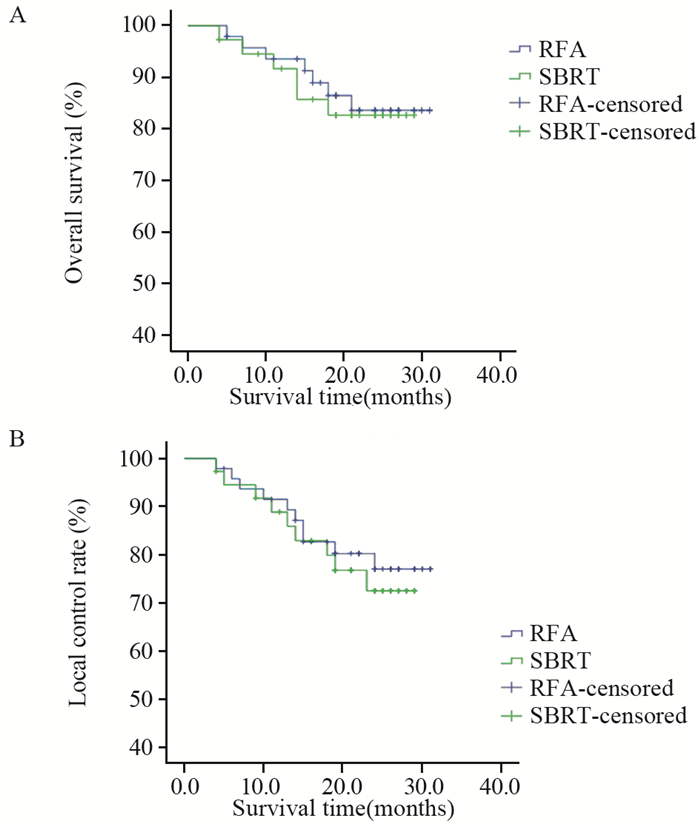
RFA组中位随访时间为25月(5~31月),治疗后1年和2年的OS分别为95.9%和85.7%,局灶控制率分别为91.8%和79.6%。共7例患者死亡,其中死于肝功能衰竭3例,肝肾综合征2例,上消化道出血2例。SBRT组中位随访时间为26月(4~29月),治疗后1年和2年OS分别为91.9%和83.8%,局灶控制率分别为89.1%和75.7%。共6例患者死亡,其中胆道梗阻1例、肝功能衰竭2例、肝肾综合征2例、上消化道出血1例。Kaplan-Meier生存分析表明治疗后2年,两组患者总体OS和局灶控制率差异无统计学意义(Log Rank=0.049, P=0.826; Log Rank=0.192, P=0.661),见图 2。
3 讨论
肝癌是一种恶性程度很高的癌症,慢性肝炎、肝硬化是导致肝癌发生的高危因素。目前,对高危人群的定期甲胎蛋白筛查和超声监测促使更多直径≤5 cm的HCC被发现。虽然手术切除仍然是肝癌治疗最为有效的手段,但肝癌独特的肝硬化背景、多中心发生、易转移和易复发等特性限制了肝癌根治性切除的应用,肝癌总体切除率只有30%左右[5]。因此,目前射频消融术因其损伤小、可直接杀灭肿瘤的特性而成为合并肝硬化和易于复发、不适手术切除患者的选择。立体定向放射治疗作为一种新兴的精准放疗方法,被认为是不能进行手术切除、肝移植术和RFA的小肝癌患者的治疗选择[6]。SBRT在治疗小肝癌中的疗效和安全性受到关注。
射频消融术是20世纪90年代中期开始应用于临床的一种物理的热消融技术,通过将针形电极插入肿瘤组织内部导入高频电流并形成局部电场,组织内离子产生快速振动而使局部组织中蛋白质变性,最终导致肿瘤组织和细胞以及周边血管凝固[7]。近年来,众多研究表明局部消融治疗是一种安全微创、疗效显著的HCC治疗方法,可用于直径小于3 cm小肝癌、不能耐受手术切除的患者或作为移植术前的过渡[8]。据报道RFA治疗小肝癌1年、3年和5年生存率分别为90%~100%、65%~90%和50%~70%[4]。本研究中RFA组1年、2年生存率分别为95.9%和85.7%,与文献报道相近。最近,一项大型回顾性临床研究分析了1 894例接受RFA、手术切除和肝移植的患者生存率,结果表明,尽管目前RFA被推荐作为直径小于5 cm的肝癌的一线治疗方案,但是对于直径大于3 cm的HCC,RFA的治疗效果均劣于其他两种治疗方法[9]。另外,对于邻近肝门、胆管和腹腔内重要器官的肿瘤,RFA治疗时容易损伤上述器官。对于肝包膜下的肿瘤,RFA治疗时容易引起出血,而对于邻近大血管的肿瘤,RFA的疗效会有不同程度的降低。
放射疗法在实体肿瘤的治疗中已广泛应用,但肝脏耐受放疗剂量较低,而大范围肝照射达不到治疗效果,导致放射治疗HCC疗效不佳。随着定向放射治疗技术的应用和发展,其在提高控制率、降低并发症和改善患者耐受性等方面显现出较大优势[10]。Sanuki等[11]报道了185例SBRT治疗效果,随访3年患者的局部控制率达到91%,总生存率为70%,放射治疗剂量为35 Gy或40 Gy患者的生存率差异无统计学意义,同时两种剂量对直径≤5 cm的HCC患者均是安全有效的。另一项临床研究发现:局限性HCC或转移性肝癌SBRT治疗后2年的控制率分别达到(74.8 ± 6.3)%和(64.2 ± 9.5)%,两者相较差异无统计学意义。而SBRT对于直径小于3 cm的肿瘤的疗效则明显优于肿瘤直径更大的患者[12]。在本研究中,SBRT治疗患者的2年的总生存率和局灶控制率分别达到83.8%和75.7%,且无SBRT相关的严重不良反应,与上述文献报道相符。Wahl等[13]回顾性地比较了SBRT和RFA治疗HCC的疗效,结果显示,RFA治疗HCC的2年生存率为53%,SBRT为46%。同时该研究结果也支持RFA在控制小肝癌(直径<2 cm)方面具有优势,而SBRT则在控制直径大于2 cm的HCC中占有优势。此外,张弢等[4]认为SBRT可以作为不适合手术治疗的肝癌(单个、直径≤5 cm)的替代治疗。由于HCC直径是影响RFA和SBRT治疗效果的重要因素之一,因此有必要对HCC直径与治疗效果的关系进行进一步的分层分析,以确定两种治疗手段的优劣,这也需要将来更多的前瞻性研究和更大的样本量来得出可靠的结论。
本文中RFA和SBRT治疗后常见的不良反应为CTCEA4.0标准界定的1~2级肝区疼痛、发热、胃肠道反应、转氨酶升高和血小板降低,经对症治疗均得到缓解,无3级以上严重反应,两种治疗方案的安全性较高。Wahl等[13]研究中:RFA组3级以上急性不良反应发生率为11%,SBRT组为5%,这可能是由于该研究中部分患者含有2个或2个以上的HCC病灶,且有的病灶直径较大,在治疗过程中肿瘤对邻近组织器官产生挤压或促使正常组织高剂量暴露引起的损伤反应。
总之,本研究回顾性地分析和比较了RFA和SBRT在治疗小肝癌患者的近期和远期疗效以及不良反应的发生率,结果显示RFA和SBRT均是HCC局部治疗的安全和有效方案,二者近期和远期疗效相当,同时治疗相关的严重不良反应发生率低。因此,对于不适合手术切除的肝癌患者,立体定向放疗可以作为射频消融术治疗的替代疗法。但由于本研究入组病例较少以及随访时间较短,因此本研究结果需要更大样本量的前瞻性、随机研究来证实。
-
表 1 RFA和SBRT组患者基本临床特征
Table 1 Baseline characteristics of patients in RFA and SBRT group

表 2 RFA和SBRT组治疗后不良反应的发生情况
Table 2 Adverse events in RFA and SBRT groups after treatment based on CTCAE 4.0

-
[1] Lee LH, Hwang JI, Cheng YC, et al. Comparable Outcomes of Ultrasound versus Computed Tomography in the Guidance of Radiofrequency Ablation for Hepatocellular Carcinoma[J]. PLoS One, 2017, 12(1): e0169655. doi: 10.1371/journal.pone.0169655
[2] Louis C, Dewas S, Mirabel X, et al. Stereotactic radiotherapy of hepatocellular carcinoma: preliminary results[J]. Technol Cancer Res Treat, 2010, 9(5): 479-87. doi: 10.1177/153303461000900506
[3] 卢景宁, 杨红, 彭民浩, 等.人工腹水辅助超声引导射频消融治疗膈顶部原发性肝癌[J].肿瘤防治研究, 2015, 42(5): 493-7. doi: 10.3971/j.issn.1000-8578.2015.05.016 Lu JN, Yang H, Peng MH, et al. Percutaneous Ultrasound-guided Radiofrequency Ablation with Artificial Ascites for Hepatocellular Carcinoma in Hepatic Dome[J]. Zhong Liu Fang Zhi Yan Jiu, 2015, 42(5): 493-7. doi: 10.3971/j.issn.1000-8578.2015.05.016
[4] 张弢, 谢辉, 孙静, 等.立体定向放射治疗与射频消融治疗肝癌的临床对比研究[J].传染病信息, 2016, 29(4): 222-7. http://www.doc88.com/p-3761523106610.html Zhang T, Xie H, Sun J, et al. Clinical comparison of stereotactic body radiotherapy and radiofrequency ablation in the treatment of liver cancer[J]. Chuan Ran Bing Xin Xi, 2016, 29(4): 222-7. http://www.doc88.com/p-3761523106610.html
[5] Ueno M, Hayami S, Shigekawa Y, et al. Prognostic impact of surgery and radiofrequency ablation on single nodular HCC 5 cm: Cohort study based on serum HCC markers[J]. J Hepatol, 2015, 63(6): 1352-9. doi: 10.1016/j.jhep.2015.07.013
[6] Su TS, Lu HZ, Cheng T, et al. Long-term survival analysis in combined transarterial embolization and stereotactic body radiation therapy versus stereotactic body radiation monotherapy for unresectable hepatocellular carcinoma > 5 cm[J]. BMC Cancer, 2016, 16(1): 834. doi: 10.1186/s12885-016-2894-9
[7] 殷晓煜, 吕明德.小肝癌的治疗:手术切除与局部消融治疗的选择[J].中国实用外科杂志, 2010, 30(7): 523-5. http://www.cqvip.com/QK/90965A/201007/34509111.html Ying XY, Lv MD. Treatment of small hepatocellular carcinoma: choice of surgical resection or local ablation[J]. Zhongguo Shi Yong Wai Ke Za Zhi, 2010, 30(7): 523-5. http://www.cqvip.com/QK/90965A/201007/34509111.html
[8] 刘倚河, 毕建民, 吴秀艳, 等.超声引导下经皮肝穿射频消融治疗肝癌的临床疗效观察[J].临床军医杂志, 2014, 42(7): 697-700. http://kns.cnki.net/KCMS/detail/detail.aspx?filename=jygz201407013&dbname=CJFD&dbcode=CJFQ Liu YH, Bi JM, Wu XY, et al. Clinical curative effect of ultrasound guided percutaneous radiofrequency ablation on hepatocellular carcinoma[J]. Lin Chuang Jun Yi Za Zhi, 2014, 42(7): 697-700. http://kns.cnki.net/KCMS/detail/detail.aspx?filename=jygz201407013&dbname=CJFD&dbcode=CJFQ
[9] Kutlu OC, Chan JA, Aloia TA, et al. Comparative effectiveness of first-line radiofrequency ablation versus surgical resection and transplantation for patients with early hepatocellular carcinoma[J]. Cancer, 2017, 123(10): 1817-27. doi: 10.1002/cncr.v123.10
[10] Takeda A, Sanuki N, Tsurugai Y, et al. Phase 2 study of stereotactic body radiotherapy and optional transarterial chemoembolization for solitary hepatocellular carcinoma not amenable to resection and radiofrequency ablation[J]. Cancer, 2016, 122(13): 2041-9. doi: 10.1002/cncr.v122.13
[11] Sanuki N, Takeda A, Oku Y, et al. Stereotactic body radiotherapy for small hepatocellular carcinoma: a retrospective outcome analysis in 185 patients[J]. Acta Oncol, 2014, 53(3): 399-404. doi: 10.3109/0284186X.2013.820342
[12] Yamashita H, Onishi H, Matsumoto Y, et al. Local effect of stereotactic body radiotherapy for primary and metastatic liver tumors in 130 Japanese patients[J]. Radiat Oncol, 2014, 9: 112. doi: 10.1186/1748-717X-9-112
[13] Wahl DR, Stenmark MH, Tao Y, et al. Outcomes After Stereotactic Body Radiotherapy or Radiofrequency Ablation for Hepatocellular Carcinoma[J]. J Clin Oncol, 2016, 34(5): 452-9. doi: 10.1200/JCO.2015.61.4925
-
期刊类型引用(1)
1. 贾蕊,郭雪君,乔晓芳. TENM3在胃癌组织中的表达及与其预后的相关性研究. 实用癌症杂志. 2024(10): 1588-1591 .  百度学术
百度学术
其他类型引用(1)



 下载:
下载: