Relationship of LncRNA AC010145.4 Expression with Prognosis and Chemoresistance of Small Cell Lung Cancer
-
摘要:目的
探讨LncRNA AC010145.4在小细胞肺癌患者组织中的表达及其与患者化疗敏感度和预后的关系。
方法应用实时荧光定量PCR法检测67例SCLC、27例癌旁及40例正常肺组织中LncRNA AC010145.4的表达,采用χ2检验分析LncRNA AC010145.4表达与SCLC患者临床病理特征的关系,Kaplan-Meier法分析LncRNA AC010145.4表达与SCLC患者生存时间的关系,单因素及多因素分析影响SCLC预后的因素。
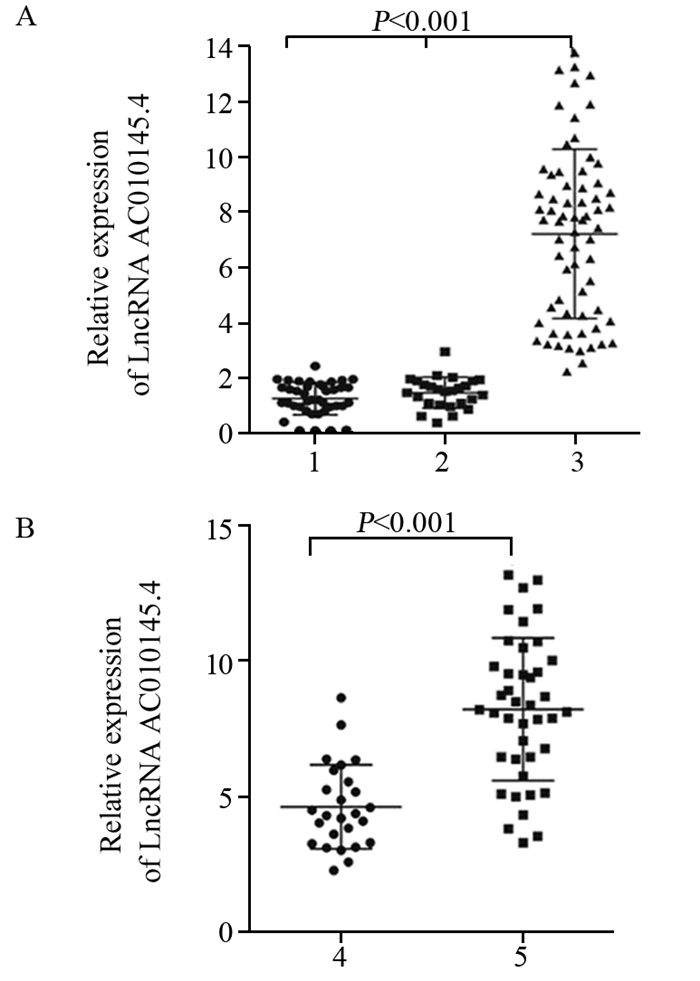
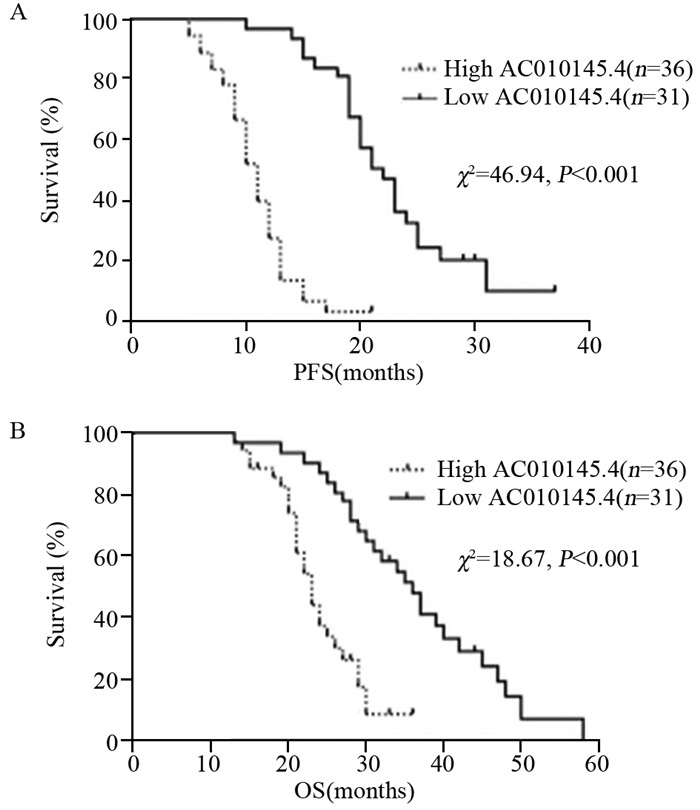
结果SCLC组织中LncRNA AC010145.4的表达水平明显高于癌旁组织及正常肺组织(均P < 0.001)。LncRNA AC010145.4在化疗耐药患者中的表达明显高于化疗敏感者(P < 0.05);LncRNA AC010145.4表达与SCLC患者的性别、年龄无关,而与疾病分期、淋巴结转移、远处转移、化疗耐药相关(均P < 0.05)。高表达LncRNA AC010145.4患者的总生存时间及无进展生存时间均短于低表达者(均P < 0.001)。单因素及多因素分析发现LncRNA AC010145.4表达、疾病分期、远处转移是SCLC患者独立的预后因素(均P < 0.05)。
结论LncRNA AC010145.4参与调节SCLC的发生和发展,可能是潜在的SCLC患者预后评估的生物标志物。
-
关键词:
- 小细胞肺癌 /
- 长链非编码RNA /
- LncRNA AC010145.4 /
- 预后
Abstract:ObjectiveTo investigate the expression of long non-coding RNA AC010145.4 (LncRNA AC010145.4) and its relationship with prognosis and chemoresistance of small cell lung cancer (SCLC) patients.
MethodsThe expression of LncRNA AC010145.4 in 67 cases of SCLC tissues, 27 cases of para-cancerous tissues and 40 cases of normal lung tissues were detected by real-time fluorescent quantitative PCR. The relationship of LncRNA AC010145.4 expression with clinicopathological characteristics was analysed by χ2 test. The relationship between AC010145.4 expression and survival time of SCLC patients were analyzed by Kaplan-Meier analysis. Univariate and multivariate analysis were used to analyze prognosis factor of SCLC.
ResultsThe expression level of LncRNA AC010145.4 in SCLC tissues was higher than those in para-cancerous tissues and normal lung tissues (all P < 0.001). The expression of LncRNA AC010145.4 was significantly higher in chemoresistance patients than that in chemosensitive patients (P < 0.05). LncRNA AC010145.4 expression was positively correlated with disease stage, lymph node metastasis, distant metastasis, chemosensitivity (all P < 0.05). The overall survival time and progression-free survival time of the patients with high LncRNA AC010145.4 expression were shorter than those with low LncRNA AC010145.4 expression (all P < 0.001). LncRNA AC010145.4 expression, disease stage and distant metastasis were independent prognostic factors (all P < 0.05).
ConclusionLncRNA AC010145.4 is involved in the occurrence and development of SCLC, and may be used as a molecular marker for the prognosis evaluation of SCLC patients.
-
Key words:
- Small cell lung cancer /
- Lnc RNA /
- LncRNA AC010145.4 /
- Prognosis
-
0 引言
肝癌是全球常见的恶性肿瘤之一,病理类型有肝细胞癌(hepatocellular carcinoma, HCC)、肝内胆管细胞癌、混合癌,其中肝细胞癌占85%~90%[1]。根据2020年癌症全球人数统计,肝癌是全球第三大癌症死亡原因,死亡人数占癌症总死亡人数的8.3%,是中国癌症死亡人数的第2名[2]。我国肝癌5年生存率不足15%[3]。甲胎蛋白(alpha-fetoprotein, AFP)是筛查HCC的常用指标,术后AFP升高常提示HCC复发,但约30%的患者AFP没有升高或不表达,延误治疗最佳时机[4]。临床上需要联合有效的指标协助判断患者预后,提高生存质量。
血清乳酸脱氢酶/白蛋白比值(lactate dehydrogenase to albumin ratio, LAR)是判断恶性肿瘤预后的血清学检测指标之一。在多种癌症的研究中显示,血清乳酸脱氢酶(LDH)水平是肿瘤缺氧、新生血管生成和预后不良的间接标志[5]。术前低蛋白血症是营养不良的指标,与胃癌和肝癌等患者的总体存活率低和复发率高有关[5-6]。LAR在胃癌和鼻咽癌等癌症中的不良预后作用已被验证,而在HCC中研究较少。本研究回顾性分析106例HCC患者临床资料,评价患者术前外周血LAR与预后的关系,并将LAR联合AFP来评估HCC患者预后的价值,以期为HCC的临床判断提供一定的参考。
1 资料与方法
1.1 一般资料
回顾性分析2015年1月—2019年12月在兰州大学第一医院普外科行根治性手术的106例HCC患者的临床资料,其中男81例(76.4%),女25例(23.6%);年龄26~78(54.5±10.1)岁。临床分期按照2018年修改的AJCC第8版分期系统。纳入标准:(1)18~80岁;(2)术中肿瘤根治性切除;(3)术后病理证实为HCC;(4)无严重的心、肺、脑、肾严重功能障碍及血液系统疾病;(5)患者临床及随访资料完整。排除标准:(1)不可切除或非根治性切除的肝癌;(2)术后病理证实非HCC;(3)既往有其他恶性肿瘤病史者;(4)拒绝签署知情同意书及随访过程中失访者。本研究通过本院伦理委员会审批(批准号:LDYYLL2021-348)。
1.2 数据收集
收集患者的基本信息:性别、年龄、体重指数;术前1周内的血常规检查:肝炎病毒抗原、白蛋白(ALB)、LDH、AFP;影像学检查;疾病信息:肿瘤T分期、N分期、临床分期、术后有无介入手术治疗等。
1.3 随访情况
采用住院或门诊就诊、电话等方式进行随访,每3月随访一次,末次随访时间为2021年5月。总生存期(overall survival, OS)是从患者术后第1日开始至末次随访或死亡的时间;无病生存期(disease-free survival, DFS)是患者手术后第1日至疾病复发或(因任何原因)死亡之间的时间[7]。随访时间为0~77月,中位随访时间为28月。106例随访病例复发75例(70.8%),死亡30例(28.3%),1例未复发。
1.4 统计学方法
采用SPSS26.0软件进行统计学分析。根据中位数以LAR为4.58进行分层(LAR≥4.58和LAR < 4.58)。计数资料用例数和百分比表示,两组间比较采用χ2或Fisher精确检验,等级变量采用秩和检验。使用Kaplan-Meier绘制生存曲线并采用Log rank检验。利用Cox风险回归模型进行单多因素回归分析,判断影响HCC患者预后的危险因素;对LAR和AFP联合分组进行检验,并绘制Kaplan-Meier生存曲线。P < 0.05为差异有统计学意义。
2 结果
2.1 术前LAR水平与HCC患者临床、病理特征的关系
106例患者中,1年的DFS为49.1%,3年的DFS为9.4%,1年的OS为81.1%,3年的OS为22.6%。根据既往研究结果,取AFP截断值为400 μg/L,以LAR=4.58为阈值分层,单因素分析显示两组间T分期和临床分期比较差异有统计学意义(均P < 0.05),见表 1。
表 1 HCC患者的临床资料与LAR相关性分析(n(%))Table 1 Correlation between clinical data and LAR of HCC patients (n(%))
2.2 LAR、AFP与HCC患者预后的关系
高LAR组(LAR≥4.58, n=53),低LAR组(LAR < 4.58, n=53);高AFP组(AFP≥400 μg/L, n=24),低AFP组(AFP < 400 μg/L, n=82)。Log rank检验单因素分析显示,高LAR组和高AFP组的DFS和OS显著短于低LAR组和低AFP组,差异有统计学意义(P < 0.05),Kaplan-Meier生存曲线见图 1。
2.3 影响HCC患者术后DFS和OS的Cox单多因素回归分析
按照中位数患者被分为高LAR组(LAR≥4.58, n=53)和低LAR组(LAR < 4.58, n=53)。根据既往文献对T分期进行分类(T1~T2/T3~T4),将HCC患者性别、年龄、BMI、肝炎病毒抗原、LAR、AFP、T分期、N分期和术后介入治疗等因素纳入Cox单因素回归分析,结果表明LAR、AFP、T分期与DFS相关(P < 0.05),LAR、AFP、T分期、术后介入治疗与OS相关(P < 0.05)。将单因素分析中有临床意义的变量纳入多因素回归分析,结果显示高LAR、高AFP和T3~T4期是HCC患者DFS和OS的独立危险因素(P < 0.05),术后行介入手术治疗可延长HCC患者的OS,见表 2。
表 2 HCC患者DFS和OS的Cox单多因素回归分析Table 2 Cox univariate and multivariate regression analyses of DFS and OS in HCC patients
2.4 血清LAR联合AFP与HCC患者术后DFS和OS的关系
结果显示高LAR且高AFP组(LAR≥4.58且AFP≥400 μg/L, n=12)的DFS和OS最短,低LAR且低AFP组(LAR < 4.58且AFP < 400 μg/L, n=41)的DFS和OS最长(P < 0.05),见图 2。
3 讨论
肝癌是我国第四大常见恶性肿瘤[8],据2018年世界卫生组织(WHO)统计,我国肝癌人数占全球肝癌病例总数的46.7%[9]。肝癌主要的危险因素有慢性乙型病毒性肝炎、慢性丙型病毒性肝炎、酗酒、代谢性肝病等。目前AFP作为临床最常用的血液学检测方法对HCC进行筛查和预后监测,但其敏感度较低,为25%~65%[1]。因此需联合简单可行的血液学检测方法对HCC预后进行判断,早期实施干预措施,改善HCC预后。
高LDH和低ALB水平提示恶性肿瘤的不良预后,LAR将LDH与ALB结合可在肿瘤血管生成、细胞存活和机体营养状况等方面综合判断肿瘤预后,准确性较单个指标更高,其不良预后作用在结直肠癌、食管癌等多种肿瘤中得到验证[10-11]。Gan等[6]对1 041例原发性肝癌患者进行分析,发现LAR是原发性肝癌患者OS和无进展生存期(progression-free survival, PFS)的准确预测因子。本研究发现术前LAR与肿瘤的T分期和临床分期相关,与以往研究结果一致,高LAR是HCC的独立不良预后因素,高LAR水平的HCC患者,术后复发风险比低LAR组高约1.606倍。
LDH是一种参与无氧糖酵解的代谢酶[11],高LDH与肿瘤血管生成、细胞存活和肿瘤形成相关[12],是胃癌、胰腺癌等恶性肿瘤的不良预后因素[10-11, 13]。Wu等[14]研究显示LDH是原发性肝癌患者OS和PFS的独立预后因素。高LDH提示不良预后的可能原因有:(1)肿瘤细胞增殖活跃、肿瘤微环境氧耗增加[15]、缺氧诱导因子-1(HIF-1)的异常激活可上调肿瘤细胞中的LDH-A,确保肿瘤细胞在低氧条件下进行糖酵解代谢并且减少对氧气的需求[16];(2)PI3K/Akt/mTOR通路是肿瘤中最常被激活的信号通路之一,可通过调节LDH促进肿瘤细胞增殖、生长[17];(3)异常激活的热休克蛋白通过其转录调节因子热休克因子(HSF-1),调节葡萄糖代谢和增加乳酸脱氢酶(LDH-A)的表达[18],促进肿瘤细胞的增值、侵袭和转移。ALB作为肝脏合成的糖蛋白,是判断肝功能是否损伤的早期重要指标[19]。Fox等[20]通过分析2 918例患者的临床资料发现术前低蛋白血症为原发性肝癌不良预后的重要因素。术前白蛋白水平较低的原因可能有:肝功能障碍引起白蛋白合成、分泌较少;肿瘤相关的炎性反应引起蛋白分解加速[5]。LAR为LDH和ALB值之比,LAR升高不仅可以反应LDH升高,也可反应ALB降低。本研究通过对106例患者分析发现高LAR组患者的DFS和OS短于低LAR组患者,且差异有统计学意义(P < 0.05),与上述研究结果基本一致。
本研究发现,LAR和AFP均与HCC的不良预后密切相关,LAR和AFP均升高的组预后最差,对HCC患者术后DFS和OS的判断有统计学意义。本研究为单中心、小样本的回顾性研究,存在一定的局限性,未来需进行多中心、大样本的前瞻性研究,进一步了解影响肝癌预后的危险因素,提高对肝癌预后判断的准确性,及时干预治疗,延长DFS和OS,提高患者生存质量。
-
表 1 LncRNA AC010145.4表达与小细胞肺癌患者临床病理特征间的关系
Table 1 Relationship between LncRNA AC010145.4 expression and clinicopathological characteristics of small cell lung cancer (SCLC) patients

表 2 单因素和多因素分析影响小细胞肺癌患者OS的临床病理因素
Table 2 Univariate and multivariate analysis of clinicopathological features for OS of SCLC patients

-
[1] Butler KM, Rayens MK, Wiggins AT, et al. Association of smoking in the home with lung cancer worry, perceived risk, and synergistic risk[J]. Oncol Nurs Forum, 2017, 44(2):E55-63.
[2] Caswell G, Seymour J, Crosby V, et al. Lung cancer diagnosed following an emergency admission:exploring patient and carer perspectives on delay in seeking help[J]. Support Care Cancer, 2017, 25(7):2259-66. doi: 10.1007/s00520-017-3633-8
[3] Huang J, Peng J, Guo L. Non-coding RNA:a new tool for the diagnosis, prognosis, and therapy of small cell lung cancer[J]. J Thorac Oncol, 2015, 10(1):28-37. doi: 10.1097/JTO.0000000000000394
[4] Park S, Lee E, Rhee S, et al. Correlation between semi-quantitative (18) F-FDG PET/CT parameters and Ki-67 expression in small cell lung cancer[J]. Nucl Med Mol Imaging, 2016, 50(1):24-30. doi: 10.1007/s13139-015-0363-z
[5] Xiao F, Bai Y, Chen Z, et al. Downregulation of HOXA1 gene affects small cell lung cancer cell survival and chemoresistance under the regulation of miR-100[J]. Eur J Cancer, 2014, 50(8):1541-54. doi: 10.1016/j.ejca.2014.01.024
[6] Haixia P, Yifeng B, and Honglin H. Role and clinical significance of RLIP76 in regulation of multi-drug resistance of small cell lung cancer[J]. Zhonghua Zhong Liu Za Zhi, 2015, 37(4):266-71. http://www.ncbi.nlm.nih.gov/pubmed/26462890
[7] Luo S, Bai Y, Lan H. Influence of interference of WIG-1 on the multi-drug resistance in small cell lung cancer[J]. Zhonghua Zhong Liu Za Zhi, 2014, 36(10):733-8. http://www.ncbi.nlm.nih.gov/pubmed/25567302
[8] Williamson L, Saponaro M, Boeing S, et al. UV Irradiation Induces a Non-coding RNA that Functionally Opposes the Protein Encoded by the Same Gene[J]. Cell, 2017, 168(5):843-55. doi: 10.1016/j.cell.2017.01.019
[9] Zhuo C, Hou W, Hu L, et al. Genomic editing of non-coding rna genes with crispr/cas9 ushers in a potential novel approach to study and treat schizophrenia[J]. Front Mol Neurosci, 2017, 10:28. doi: 10.3389/fnmol.2017.00028/full
[10] Jin Y, Cui Z, Li X, et al. Upregulation of long non-coding RNA PlncRNA-1 promotes proliferation and induces epithelial-mesenchymal transition in prostate cancer[J]. Oncotarget, 2017, 8(16):26090-9. http://www.ncbi.nlm.nih.gov/pmc/articles/PMC5432240/
[11] Li H, Jiang X, Niu X. Long Non-Coding RNA Reprogramming (ROR) Promotes Cell Proliferation in Colorectal Cancer via Affecting P53[J]. Med Sci Monit, 2017, 23:919-28. doi: 10.12659/MSM.903462
[12] Qi X, Shao M, Sun H, et al. Long non-coding RNA SNHG14 promotes microglia activation by regulating miR-145-5p/PLA2G4A in cerebral infarction[J]. Neuroscience, 2017, 348:98-106. doi: 10.1016/j.neuroscience.2017.02.002
[13] Huang NS, Chi YY, Xue JY, et al. Long non-coding RNA metastasis associated in lung adenocarcinoma transcript 1(MALAT1) interacts with estrogen receptor and predicted poor survival in breast cancer[J]. Oncotarget, 2016, 7(25):37957-65. doi: 10.18632/oncotarget.v7i25
[14] Zhou C, Ye L, Jiang C, et al. Long noncoding RNA HOTAIR, a hypoxia-inducible factor-1alpha activated driver of malignancy, enhances hypoxic cancer cell proliferation, migration, and invasion in non-small cell lung cancer[J]. Tumour Biol, 2015, 36(12):9179-88. doi: 10.1007/s13277-015-3453-8
[15] Qiu M, Xu Y, Yang X, et al. CCAT2 is a lung adenocarcinoma-specific long non-coding RNA and promotes invasion of non-small cell lung cancer[J]. Tumour Biol, 2014, 35(6):5375-80. doi: 10.1007/s13277-014-1700-z
[16] Shi X, Sun M, Liu H, et al. A critical role for the long non-coding RNA GAS5 in proliferation and apoptosis in non-small-cell lung cancer[J]. Mol Carcinog, 2015, 54(Suppl 1):E1-12. http://www.ncbi.nlm.nih.gov/pubmed/24357161
[17] Niu Y, Ma F, Huang W, et al. Long non-coding RNA TUG1 is involved in cell growth and chemoresistance of small cell lung cancer by regulating LIMK2b via EZH2[J]. Mol Cancer, 2017, 16(1):5. doi: 10.1186/s12943-016-0575-6
[18] Huang C, Liu S, Wang H, et al. LncRNA PVT1 overexpression is a poor prognostic biomarker and regulates migration and invasion in small cell lung cancer[J]. Am J Transl Res, 2016, 8(11):5025-34. https://www.ncbi.nlm.nih.gov/pmc/articles/PMC5126345/



 下载:
下载: