Methylation Status of MGMT Gene Promoter in Patients with Adenocarcinoma of Esophagogastric Junction and Its Relationship with Prognosis
-
摘要:目的
检测食管胃交界部腺癌组织中O6-甲基鸟嘌呤-DNA甲基转移酶(O6-methylguanine-DNA methyltransferase, MGMT)基因启动子区甲基化状态以及蛋白表达情况,评价其与临床参数及预后的关系。
方法选取107例食管胃交界部腺癌患者,应用甲基化特异性聚合酶链反应(methylmion specific PCR, MSP)检测MGMT基因甲基化情况,免疫组织化学法检测MGMT蛋白表达情况,分析两者与临床特征及生存时间的关系。
结果癌组织中MGMT基因启动子区甲基化率显著高于癌旁正常组织;癌组织中MGMT蛋白阳性率显著低于癌旁正常组织。Spearman等级相关分析表明MGMT基因启动子区甲基化与MGMT蛋白表达呈负相关。MGMT基因启动子甲基化及蛋白表达与淋巴结转移、pTNM分期之间具有相关性。多因素Cox回归分析,MGMT基因启动子区甲基化、MGMT蛋白表达及pTNM分期是影响患者生存的独立预后因素。
结论MGMT基因启动子甲基化、MGMT蛋白表达与pTNM分期是影响食管胃交界部腺癌患者预后的独立影响因素。
-
关键词:
- 食管胃交界部腺癌 /
- MGMT基因 /
- 甲基化特异性聚合酶链反应 /
- 免疫组织化学
Abstract:ObjectiveTo detect the methylation status of O6-methylguanine-DNA methyltransferase (MGMT) promoter and its protein expression in adenocarcinoma of esophagogastric junction (AEJ) tissues. The relationship of MGMT methylation status and its protein expression with clinical features and survival were also analyzed.
MethodsThe methylation status of MGMT promoter was detected by methylation specific polymerase chain reaction (MSP) in 107 AEJ cases. Immunohistochemistry staining was used to detect protein expression in the same group of specimen. Then, the relationship of MGMT methylation with clinical features and prognosis were analyzed.
ResultsThe promoter methylation rate of MGMT in cancerous specimen was higher than that in adjacent normal group. However, the MGMT expression rate was opposite. A correlation between promoter methylation of MGMT and protein expression were established by Spearman correlation analysis. MGMT promoter methylation and its protein expression had significant correlation with lymph node metastasis and pTNM stage. The Cox multivariate regression analysis indicated that MGMT promoter methylation, MGMT protein expression and pTNM stage were significant risk factors.
ConclusionThe promoter methylation of MGMT, MGMT protein expression and pTNM stage might be significant influence factors for 5 years survival time of AEJ patients.
-
0 引言
食管胃交界部腺癌(adenocarcinoma of esophagogastric junction, AEJ)是临床常见的恶性肿瘤,预后不良[1]。目前研究认为,外界致癌因子导致的DNA损伤在恶性肿瘤发生、发展过程中起着关键作用,因此,DNA损伤修复机制的研究日益受到关注。O6-甲基鸟嘌呤-DNA甲基转移酶(O6-methylguanine-DNA methyltransferase, MGMT)是细胞中一种高效的DNA烷基化损伤修复酶,能将6-氧-甲基鸟嘌呤分子上的甲基转移到自身的半胱氨酸残基上,修复鸟嘌呤损伤,从而修复损伤的DNA序列。然而MGMT基因启动子区CpG岛的过甲基化会影响基因的转录,导致其蛋白的表达缺失,从而诱发肿瘤[2]。已有研究证实,MGMT表达减少或缺失可能与胸腺瘤[2]、宫颈癌[3]、食管癌[4]、恶性胶质瘤[5]、结直肠癌[6]等多种肿瘤的发生相关,但是对于食管胃交接部腺癌的研究很少。
本研究通过用甲基化特异性PCR法检测食管胃交界部腺癌和癌旁正常组织MGMT基因启动子区甲基化状态,用免疫组织化学SP法分析MGMT蛋白表达情况,以探讨MGMT基因甲基化及蛋白表达与食管胃交界部腺癌临床特征及预后的关系。
1 资料与方法
1.1 临床资料
选择2011年1月至2011年12月河北医科大学第四医院胸外科住院的107例食管胃交界部腺癌患者进行研究,全部经病理确诊并具有可以保证研究需要的石蜡保存标本。癌组织和癌旁组织均取自本组患者的石蜡切片。排除标准:(1)术前行放化疗的患者;(2)蜡块组织少无法满足实验需要者;(3)临床数据及随访资料不全者;(4)其他情况无法参与该研究者。
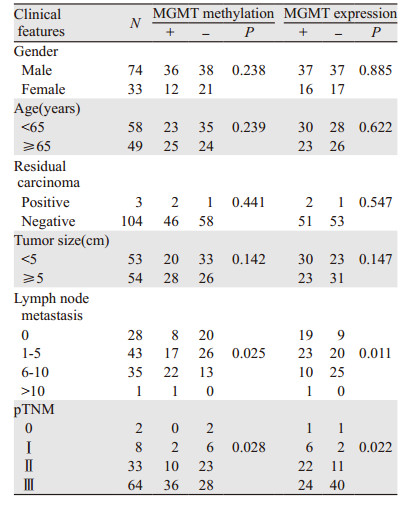
选取食管胃交界部腺癌患者中,男74例、女33例;年龄50~75岁,平均年龄(63.40±6.64)岁;肿瘤大小 < 5 cm者53例,≥5 cm者54例;残端阴性104例、阳性3例;无淋巴结转移28例、1~5枚淋巴结转移43例、6~10枚淋巴结转移35例、> 10枚淋巴结转移1例;pTNM分期0期2例、Ⅰ期8例、Ⅱ期33例、Ⅲ期64例,见表 1。
表 1 MGMT基因启动子区甲基化和MGMT蛋白表达与临床特征的相关性Table 1 Relationship of MGMT methylation and its expression with clinical features
1.2 检测方法
1.2.1 DNA的提取与DNA亚硫酸盐修饰
严格按照石蜡包埋组织DNA快速提取试剂盒(离心柱)(北京天根生化科技公司货号:DP330-02)的说明书进行操作。DNA浓度的测量采用核酸检测仪进行检测,并记录检测结果。DNA亚硫酸盐修饰严格按照DNA重亚硫酸盐转化试剂盒(离心柱形)(北京天根生化科技公司货号:DP215-02)说明书进行操作。在200 μl离心管中配制重亚硫酸盐反应体系,将反应体系置于PCR仪中,进行重亚硫酸盐转化,具体程序如下:95 ℃ 10 min,64 ℃ 30 min,4 ℃保持。
1.2.2 修饰后的DNA进行PCR扩增
MGMT引物序列,产物大小及退火温度,见表 2。PCR反应体系为20 μl:包括Primer 1(上游引物)1 μl,Primer 2(下游引物)1 μl,dNTPs 1.6 μl,MSP DNA Polymerase 1 μl,10×MSP PCR Buffer 2 μl,ddH2O补至20 μl。PCR发生环境预定为95 ℃,预变性10 min,95 ℃变性45 s,甲基化58 ℃/非甲基化63 ℃,退火45 s,72 ℃延伸50 s,共35个循环,末次循环后于72 ℃终延伸7 min,4 ℃保存。琼脂糖凝胶电泳法分离扩增产物。
表 2 MGMT引物序列、产物大小及退火温度Table 2 Primer sequence, product size and annealing temperature of MGMT
1.2.3 MSP反应的对照选择
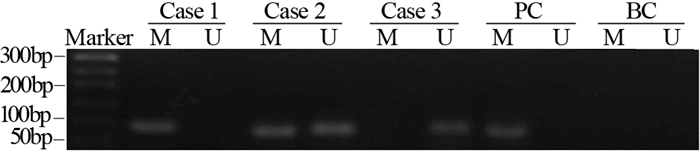
抽取健康者外周血,提取DNA后经SssⅠ甲基化酶处理作为甲基化的阳性对照,用未经SssⅠ甲基化酶处理的健康者外周血DNA作为非甲基化的阴性对照,灭菌双蒸水取代反应体系中的DNA模板作为空白对照。
1.2.4 甲基化结果判定
经SssⅠ甲基化酶处理过的DNA用甲基化特异引物(M)可扩增出目的条带,而空白对照用甲基化特异引物(M)无目的条带,则表示所用试剂与引物正确可信。
1.3 免疫组织化学IHC检测
1.3.1 采用SP法进行免疫组织化学染色
一抗(购自英国Abcam公司)工作浓度为1:350,其余试剂均购于北京中杉金桥生物科技公司,并根据说明书严格执行相关操作。
1.3.2 免疫组织化学结果判定
MGMT阳性表达部位主要在腺体细胞的胞浆中,采用半定量积分法判断结果,阳性细胞百分比 < 5%为0分,5%~25%为1分,25%~50%为2分,50%~75%为3分,≥75%为4分;免疫组织化学显色强度以多数细胞呈色反应为准,淡黄色记为1分,棕黄色记为2分,棕褐色记为3分。将两积分相乘,0分为阴性(-),1~4分为弱阳性(+),5~8分为阳性(++),9~12分为强阳性(+++),将阴性与弱阳性视为阴性表达,阳性与强阳性视为阳性表达。
1.4 查阅病例和患者随访
查阅患者的病历资料,记录其性别、年龄、术后病理、肿瘤大小、阳性淋巴结数及长、下残性质等数据。通过电话、书信及门诊调查问卷等方式对患者进行随访,随访时间截至为2016年12月。
1.5 统计学方法
应用SPSS21.0软件进行统计学分析,两样本率的比较采用χ2检验和Wilcoxon符号秩检验,相关性分析用Spearman相关分析,采用Kaplan-Meier法计算患者生存曲线,组间比较用Log rank检验,多因素采用Cox回归分析法,P < 0.05为差异有统计学意义。
2 结果
2.1 随访情况
107例入组患者,9例失访,失访率为8.4%。
2.2 MGMT基因启动子区甲基化和表达
MSP及IHC结果见图 1、2。107例癌组织中,48例出现甲基化、59例为非甲基化;癌旁组织中,18例出现甲基化、89例为非甲基化。107例癌组织中53例出现阳性表达、54例阴性表达;癌旁组织中87例出现阳性表达、20例阴性表达。癌组织MGMT基因启动子区甲基化率为44.8%(48/107)显著高于癌旁组织中该基因甲基化率16.8%(18/107),差异有统计学意义(Z=-4.022, P < 0.01);癌组织MGMT蛋白阳性率为49.5%(53/107),显著低于癌旁组织中该蛋白阳性率81.3%(87/107),差异有统计学意义(Z=-4.627, P < 0.01)。
2.3 MGMT基因启动子区甲基化状态与MGMT蛋白表达的相关性
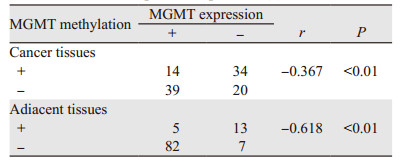
48例MGMT基因启动子区出现甲基化的腺癌组织中14例(29.2%)MGMT蛋白表达,59例MGMT基因启动子区非甲基化的腺癌组织中39例(66.1%)MGMT蛋白表达,两组对比差异有统计学意义(P < 0.01),见表 3。
表 3 MGMT基因启动子区甲基化状态与MGMT蛋白表达的相关性 (n)Table 3 Correlation between promoter methylation of MGMT and MGMT protein expression (n)
2.4 MGMT基因启动子甲基化与表达与临床参数的关系
MGMT基因启动子甲基化与性别(χ2=1.392, P=0.238)、年龄(χ2=1.387, P=0.239)、上下残(χ2=0.593, P=0.441)、肿瘤大小(χ2=2.155, P=0.142)差异均无统计学意义。MGMT基因启动子甲基化与淋巴结转移(χ2=9.308, P=0.025)、pTNM分期(χ2=9.086, P=0.028)差异存有统计学意义,且阳性淋巴结数越多、pTNM分期越晚,甲基化所占比例程度越高,见表 1。
MGMT蛋白与性别(P=0.885)、年龄(P=0.622)、上下残(P=0.547)、肿瘤大小(P=0.147)差异无统计学意义。MGMT蛋白与淋巴结转移(P=0.011)、pTNM分期(P=0.022)差异有统计学意义,且阳性淋巴结数越多、pTNM分期越晚,蛋白失表达所占比例程度越高,见表 1。
2.5 影响食管胃交界部腺癌术后患者5年生存时间的相关分析
入组患者中位生存时间44月,MGMT基因启动子区甲基化患者中位生存时间29月(95% CI: 23.527~34.473),明显低于未甲基化组患者的44月(95% CI: 38.195~49.805),差异有统计学意义(P < 0.05)。MGMT蛋白表达组中位生存时间46月(95% CI: 29.209~62.791),高于未甲基化组患者的28月(95% CI: 23.130~32.870),差异有统计学意义(P < 0.05)。
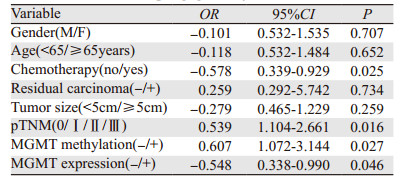
多因素Cox回归分析结果显示:性别(P=0.707)、年龄(P=0.652)、肿瘤大小(P=0.259)不能影响食管胃交界部腺癌术后患者5年生存时间,而MGMT基因启动子区甲基化(P=0.027)、MGMT蛋白表达(P=0.046)及pTNM分期(P=0.016)均可影响患者生存时间,见表 4。
表 4 影响食管胃交界部腺癌术后患者预后的相关分析Table 4 Prognosis-related factors in patients with adenocarcinoma of esophagogastric junction
3 讨论
食管胃交界部腺癌是常见的消化系统恶性肿瘤之一,其病因迄今尚未完全阐明。近年来研究发现,表观遗传学在基因表达调控中发挥着重要的作用,特别是DNA甲基化。目前关于基因甲基化的研究主要集中于抑癌基因,抑癌基因甲基化可导致抑癌基因转录沉默而失去抑癌功能[7]。
MGMT基因属于抑癌基因,是迄今发现的人类细胞中的唯一修复O6-mG(O6-methylguanine)烷基化损伤的甲基转移酶。它定位于人类染色体10q26,全长约170 kb,含有5个外显子和4个内含子,作为一种高效的DNA直接修复酶,MGMT能够在不借助任何辅助因子的情况下特异修复DNA序列中的O6-烷基鸟嘌呤受损的烷基,维持基因组的精确性和完整性,从而防止烷基化合物诱导的致癌作用。因此,MGMT蛋白表达的缺失导致O6-甲基鸟嘌呤蓄积,与胸腺嘧啶错配,发生G:C→A:T突变,导致癌基因激活,若进一步发展则可产生肿瘤[8-11]。
本研究结果显示,MGMT基因启动子区甲基化有可能是其编码蛋白表达缺失的机制之一,MGMT基因启动子区甲基化及MGMT蛋白参与了食管胃交界部腺癌的发生发展。Kitajima等[12]采集135例不同分期的胃癌组织,用免疫组织化学SP法对不同分期胃癌患者MGMT蛋白进行检测,指出在早期胃癌和进展期胃癌中MGMT蛋白缺失均与预后相关,进展期胃癌MGMT蛋白失表达率(91.3%)显著高于早期(37.5%)(P=0.0004)。Yousuf等[13]实验的结果也支持这一结论。本研究在MGMT基因启动子区甲基化组织中同样检测到了MGMT蛋白的表达,原因可能是MGMT蛋白的表达与其基因甲基化程度有关。有研究指出,只有甲基化的比例大于60%时,DNA的表达才会受到抑制,而甲基化比例小于60%时DNA的转录、表达则会降低[14]。
本研究显示,MGMT基因启动子区甲基化、MGMT蛋白表达及pTNM分期均可影响患者生存时间。提示它们可能参与食管胃交界部腺癌的发生发展的过程,与食管胃交界部腺癌的侵袭性、恶性程度有关,其原因可能为MGMT启动子区甲基化导致其蛋白表达下降或失表达,MGMT蛋白表达下降或失表达致使其修复烷基化损伤的能力减弱甚至消失。若人体细胞内MGMT基因启动子区甲基化蓄积,则会导致肿瘤的形成。研究中还发现,MGMT基因启动子区甲基化患者中位生存时间为29月,明显低于未甲基化组患者中位生存时间44月。MGMT蛋白表达患者中位生存时间44月,高于蛋白失表达患者中位生存时间26月。淋巴结转移虽与MGMT基因启动子区甲基化及蛋白表达存在相关性,但不能单独作为判断患者预后的因素。残端阳性患者样本量较少(3/107)是残端性质与预后不相关的主要原因,若增加残端阳性患者样本量后可能会找出残端性质与预后的联系。
本研究提示,MGMT基因启动子区甲基化及蛋白表达与食管胃交界部腺癌侵袭性和恶性程度有关,并影响患者的生存时间。MGMT基因启动子区甲基化状态和蛋白的表达有望成为食管胃交界部腺癌诊断和预后分析方面的候选基因。
-
表 1 MGMT基因启动子区甲基化和MGMT蛋白表达与临床特征的相关性
Table 1 Relationship of MGMT methylation and its expression with clinical features

表 2 MGMT引物序列、产物大小及退火温度
Table 2 Primer sequence, product size and annealing temperature of MGMT

表 3 MGMT基因启动子区甲基化状态与MGMT蛋白表达的相关性 (n)
Table 3 Correlation between promoter methylation of MGMT and MGMT protein expression (n)

表 4 影响食管胃交界部腺癌术后患者预后的相关分析
Table 4 Prognosis-related factors in patients with adenocarcinoma of esophagogastric junction

-
[1] Shapiro J, van Lanschot JJ, Hulshof MC, et al. Neoadjuvant chemoradiotherapy plus surgery versus surgery alone for oesophageal or junctional cancer (CROSS): long-term results of a randomised controlled trial[J]. Lancet Oncol, 2015, 16(9): 1090-8. doi: 10.1016/S1470-2045(15)00040-6
[2] Mokhtar M, Kondo K, Namura T, et al. Methylation and expression profiles of MGMT gene in thymic epithelial tumors[J]. Lung Cancer, 2014, 83(2): 279-87. doi: 10.1016/j.lungcan.2013.12.004
[3] Banzai C, Nishino K, Quan J, et al. Promoter methylation of DAPK1, FHIT, MGMT, and CDKN2A genes in cervical carcinoma[J]. Inter J Clin Oncol, 2013, 19(1): 127-32. doi: 10.1007/s10147-013-0530-0
[4] 孟庆山, 王建军, 李振芬, 等.食管癌中DNA修复基因MGMT启动子区CpG岛过甲基化研究[J].肿瘤, 2006, 26(8): 761-4. http://www.cnki.com.cn/Article/CJFDTOTAL-ABJB200902010.htm Meng QS, Wang JJ, Li ZF, et al. Hypermethylation of CpG island in promoter region of DNA repair gene MGMT in esophageal carcinoma[J]. Zhong Liu, 2006, 26(8): 761-4. http://www.cnki.com.cn/Article/CJFDTOTAL-ABJB200902010.htm
[5] Kreth S, Thon N, Eigenbrod S, et al. O6-methylguanine-DNA methyltransferase (MGMT) mRNA expression predicts outcome in malignant glioma independent of MGMT promoter methylation[J]. PLoS One, 2011, 6(2): e17156. doi: 10.1371/journal.pone.0017156
[6] Ogino S, Hazra A, Tranah GJ, et al. MGMT germline polymorphism is associated with somatic MGMT promoter methylation and gene silencing in colorectal cancer[J]. Carcinogenesis, 2007, 28(9) : 1985-90. doi: 10.1093/carcin/bgm160
[7] Geutjes EJ, Bajpe PK, Bernards R, et al. Targeting the epigenome for treatment of cancer[J]. Oncogene, 2012, 31(34): 3827-44. doi: 10.1038/onc.2011.552
[8] Chen C, Yin B, Wei Q, et al. Aberrant DNA methylation in thymic epithelial tumors[J]. Cancer Invest, 2009, 27: 582-91. doi: 10.1080/07357900802620869
[9] 郭晓波, 于颖彦.胃癌相关基因启动子甲基化的研究进展[J].诊断学理论与实践, 2009, 8(1): 93-6. http://cdmd.cnki.com.cn/Article/CDMD-10392-2006170216.htm Guo XD, Yu YY. Advances in the study of promoter methylation in gastric cancer related gene[J]. Zhen Duan Xue Li Lun Yu Shi Jian, 2009, 8(1): 93-6. http://cdmd.cnki.com.cn/Article/CDMD-10392-2006170216.htm
[10] 朱凌冬, 蔡景龙, 远里美. O6-甲基鸟嘌呤-DNA-甲基转移酶的研究进展[J].肿瘤防治研究, 2005, 32(12): 802-4. doi: 10.3971/j.issn.1000-8578.2218 Zhu LD, Cai JL, Yuan LM. Progress on O6-methylguanine-DNA methyltransferase[J]. Zhong Liu Fang Zhi Yan Jiu, 2005, 32(12): 802-4. doi: 10.3971/j.issn.1000-8578.2218
[11] Esteller M. Epigenetics in cancer[J]. N Engl J Med, 2008, 358(11): 1148-59. doi: 10.1056/NEJMra072067
[12] Kitajima Y, Miyazaki K, Matsukura S, et al. Loss of expression of DNA repair enzymes MGMT, hMLH1, and hMSH2 during tumor progression in gastric cancer[J]. Gastric Cancer, 2003, 6(2): 86-95. doi: 10.1007/s10120-003-0213-z
[13] Yousuf A, Bhat MY, Pandith AA, et al. MGMT gene silencing by promoter hypermethylation in gastric cancer in a high incidence area[J]. Cell Oncol (Dordr), 2014, 37(4): 245-52. doi: 10.1007/s13402-014-0179-3
[14] 陈祥锦, 张惠灏, 郑炜, 等.肝细胞癌p16基因甲基化及其对mRNA表达的影响[J].中国癌症杂志, 2005, 15(6): 569-71. http://www.cnki.com.cn/Article/CJFDTOTAL-ZGAZ200506020.htm Chen XR, Zhang HH, Zheng W, et al. p16 gene methylation status of and its effect on mRNA expression in hepatocellular carcinoma[J]. Zhongguo Ai Zheng Za Zhi, 2005, 15(6): 569-71. http://www.cnki.com.cn/Article/CJFDTOTAL-ZGAZ200506020.htm



 下载:
下载: