GDF11 is Involved in Human Hepatic Carcinoma Cells SMMC-7721 Proliferation and Sensitivity to DDP
-
摘要:目的
研究GDF11(growth differentiation factor 11)过表达对肝细胞癌SMMC-7721细胞体外增殖能力及顺铂敏感度的影响。
方法前期成功构建GDF11过表达的SMMC-7721细胞,同时以空载体感染细胞组及野生型细胞组为对照。CCK-8法检测细胞增殖能力,平板克隆形成实验检测细胞克隆形成能力。CCK-8法检测GDF11过表达对细胞顺铂药物敏感度的影响。
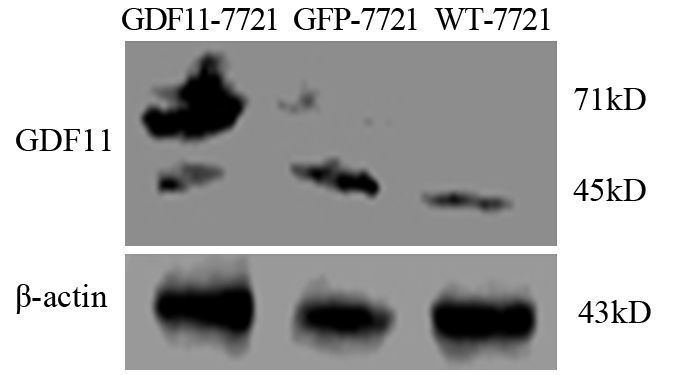
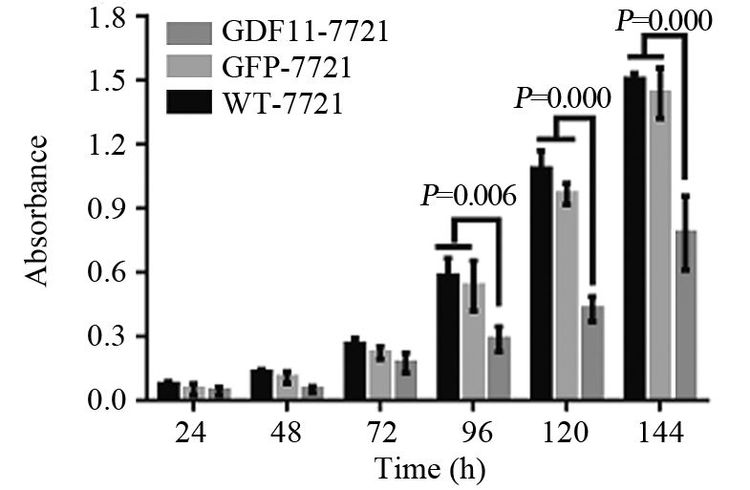
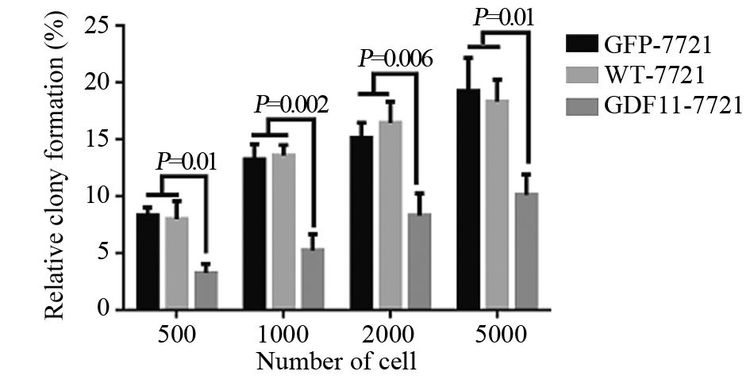
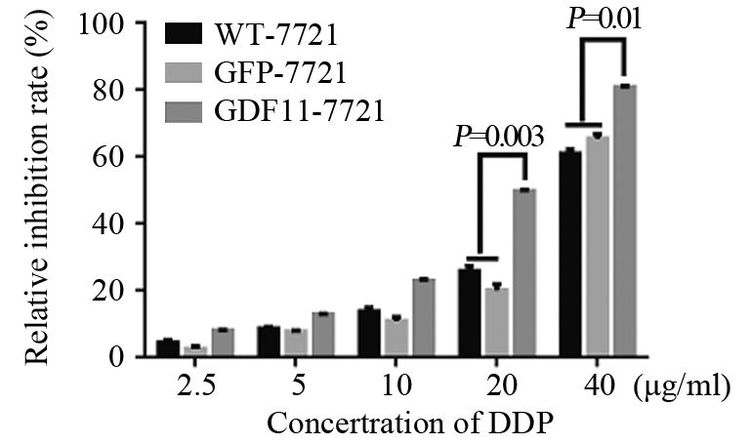
结果Western blot结果验证,已成功构建GDF11过表达的SMMC-7721细胞。GDF11过表达可明显抑制SMMC-7721细胞的体外增殖能力,在96、120及144 h时抑制作用最显著(P<0.05),且实验组细胞较对照组克隆形成能力明显减弱(P<0.05)。GDF11过表达能够增强肝细胞癌SMMC-7721细胞对顺铂的敏感度,顺铂浓度取20 μg/ml及40 μg/ml时,与对照组相比差异有统计学意义(P<0.05)。
结论肝细胞癌SMMC-7721细胞过表达GDF11蛋白后,其体外增殖及克隆形成能力明显降低,对化疗药物顺铂的敏感度增强。
Abstract:ObjectiveTo explore the influence of growth differentiation factor 11 (GDF11) overexpression on hepatic carcinoma cells SMMC-7721 proliferation ability and sensitivity to DDP in vitro.
MethodsPrevious study had successfully built SMMC-7721 cells with GDF11 over-expression. Meanwhile, empty vector infected cells and wild-type cells were treated as controls. Cells proliferation ability was examined by CCK-8 assay, and the proliferation curve was calculated. Colony formation assay was adopted to evaluate colony formation ability. The SMMC-7721 cells were treated with various concentrations of DDP, then the cell viability was measured using CCK-8 assay.
ResultsWestern blot showed SMMC-7721 cells with GDF11 over-expression had successfully built. The overexpression of GDF11 could significantly inhibit the proliferation of SMMC-7721 cells in vitro, and the effect were significant at 96, 120, 144h (P<0.05) . Meanwhile GDF11 over-expression group had lower ability of colony formation than control groups(P<0.05) . The over-expression of GDF11 made SMMC-7721 cells more sensitive to DDP, and the effect were significant at 20 and 40μg/ml DDP (P<0.05) .
ConclusionThe over-expression GDF11 could inhibit the proliferation and colony formation abilities of SMMC-7721 cells, and enhance its sensitivity to DDP.
-
Key words:
- Hepatic carcinoma /
- GDF11 /
- Proliferation /
- DDP /
- Sensitivity
-
0 引言
肺癌是全球范围内最常见的恶性肿瘤之一,占癌症死亡总数的18.7%[1]。靶向治疗以其有效率高、不良反应小的优势成为临床研究热点,有关表皮生长因子受体(Epidermal growth factor receptor, EGFR)突变阳性晚期NSCLC患者一线治疗的多个随机对照研究显示,靶向治疗对比化疗均可显著改善患者的PFS,但接受EGFR-TKI治疗的患者PFS差异较大,大部分患者在15个月左右出现耐药[2-3]。因此,在非小细胞肺癌EGFR突变患者中,选择新型的生物标志物筛选出优势人群成为研究的焦点。
液体活检是指从体液中获得来源于组织的生物标志物,通过分析得到其来源组织的相关信息[4]。目前已知的关键标志物有循环肿瘤细胞(Circulating tumor cells, CTCs)、循环肿瘤DNA(Circulating tumor DNA, ctDNA)、细胞外囊泡(Extracellular vesicles, EVs)和循环RNA(miRNA)。CTCs指从原发性肿瘤或转移灶脱落并释放入血液的肿瘤细胞,少数CTCs可逃逸机体的免疫作用在血液循环中存活并播种新的转移灶[5]。ctDNA是指由肿瘤细胞分泌和肿瘤细胞凋亡或坏死后释放入血液中的特异性DNA片段,大小为120~160 bp,通常携带有与原发肿瘤相同的遗传特征,如基因突变、拷贝数变异、甲基化等,在晚期癌症患者中,肿瘤可能是血液中大部分ctDNA的来源[6]。不同于组织活检的大创伤性、难以解决肿瘤异质性问题,液体活检可以在治疗期间的不同时间采集血样,因此可以实时监测EGFR-TKI的治疗反应。
目前国内外开展了较多外周血CTCs和ctDNA等作为NSCLC生物标志物与肺癌筛查、治疗、预后相关性的研究[7-10]。但针对不同种类的液体活检方式检验效能评估的研究较少,本研究以RECIST1.1疗效评估标准为金标准,通过相关性分析、无进展生存时间影响因素等分析,比较接受一线EGFR-TKI治疗的非小细胞肺癌患者血清CEA、CTCs和ctDNA对预后效果的影响,从而评价血液CEA、CTCs和ctDNA检测对晚期肺癌EGFR-TKI预后的指导意义。
1 资料与方法
1.1 临床资料
选取2019年1月至2020年11月109例接受一线EGFR-TKI治疗的ⅢB期或Ⅳ期非小细胞肺癌并明确有EGFR敏感突变的患者(治疗药物主要是1代EGFR-TKI,少部分患者使用3代药物,脑转移患者在治疗1月内未接受脑部放疗)。纳入标准:(1)经组织学或细胞学证实携带EGFR突变的NSCLC;(2)分期为ⅢB期或Ⅳ期;(3)年龄≥18岁;(4)预计生存期≥3个月;(5)无心脏、肝脏、肾脏、血液系统等严重疾病。入组前实验室检查必须符合以下条件:白细胞WBC≥3.5×109/L,血红蛋白Hgb≥90 g/L,血小板≥100×109/L,胆红素≤1.5 ULN,碱性磷酸酶(ALP)、天门冬氨酸转氨酶(AST)和丙氨酸转氨酶(ALT)均≤2.5 ULN,INR≤1.5,肌酐≤1.5 ULN;(6)根据RECIST1.1标准,有可测量病灶;(7)患者自愿参加本研究,并在入组前签署知情同意书。排除标准:(1)已接受相关化疗药物治疗的患者;(2)合并其他恶性肿瘤患者;(3)心电图检查异常者;(4)不配合研究或中途退出者。本研究经同济大学附属上海市肺科医院伦理委员会批准(批准号:K20-050Y)。患者在基线检查时和治疗1月后进行胸部CT检查和血清CEA CTCs及ctDNA检测。本研究数据随访PFS至2021年12月31日,中位随访时间为14.6个月。现场就诊随访或电话随访。
1.2 检测方法
1.2.1 血清CEA检测
从外周静脉抽取1管8 ml血液,3 500 r/min离心15 min分离血清,置于−80℃冰箱冷冻保存,检测血清CEA水平,试剂盒购自上海酶联生物科技有限公司,严格按照试剂说明书进行操作。采用全自动电化学发光仪[罗氏诊断产品(上海)有限公司,e-601型]进行检测。CEA的截断值在各研究中有所不同,大多数研究结果显示CEA的截断值为10 ng/ml或更低[11],本研究参照说明书的诊断标准确定最终的截断值。
1.2.2 ctDNA检测方法
从外周静脉抽取1管10 ml血液,分离出4 ml血浆,利用循环游离DNA提取试剂盒(Qiagen公司,中国)提取样本DNA。基于数字PCR检测系统(南京科维斯)检测血浆ctDNA水平,根据入组患者初始基因状态分别检测EGFR 19 Del、EGFR L858R基因。简要步骤如下:配置14.5 μl反应液,包括数字PCR反应液7.25 μl、检测反应液0.72 μl和样本DNA 6.53 μl;将配好的反应液上样至数字PCR通用芯片(分割液滴),记录芯片编号,并检查密封的数字PCR通用芯片是否有泄漏、气泡,以及盖子方向是否正确;将制备好的数字PCR通用芯片加载至PCR仪中,设定扩增条件,运行程序如下:96℃ 10 min,预变性;60℃ 2 min退火和延伸,98℃ 30 s变性,共39个循环数;60℃ 2 min终延伸;10℃保温。将数据导入分析软件,进行结果分析,得到EGFR 19Del、EGFR L858R基因的信号比值,我们参考使用同样试剂盒检测的临床研究方法[7,12],用免疫组织化学检测(IHC)结果作为参考,在一系列可能的阈值范围内比较真阳性、真阴性、假阳性、假阴性的数量,研究发现当阈值为0.021时,真阳性和真阴性加起来占比100%,没有假阳性和假阴性,则以信号比值0.021为界将该结果判定为阳性和阴性。
1.2.3 CTCs检测方法
从外周静脉抽取两管7.5 ml血样,收集到10 ml BD Vacutainer® EDTA管中(美国新泽西州贝克顿迪金森公司)。采集后,将试管倒置几次,使样本与抗凝剂充分混合。离心血液样本(1 000 g,5 min),丢弃血浆层。其余进行红细胞溶解术。离心后,将有核细胞重新悬浮在含有1% BSA的PBS plus中,并放置在FlowCell® CTCs富集系统(Polaris Biology,中国上海)上,以清除大部分残余红细胞(RBC)和白细胞(WBC)。将富集的细胞与Cy5结合的抗CD45抗体在37°C、不含葡萄糖的RPMI1640培养基中培养40 min。将所有细胞暴露于浓度为0.5 g/ml的0.4 mmol/L 2-脱氧-2-[(7-硝基-2,1,3-苯并恶二唑-4-基)氨基]d-葡萄糖(2-NBDG)和Hoechst3342中20 min。冷PBS广泛冲洗,用高含量筛选系统扫描并成像离心(1 000 g,5 min)到玻璃上的所有细胞,EVOS FL Auto 2(美国马萨诸塞州Invitrogen)有三种荧光颜色(DAPI: Nucleus,2-NBDG: CTCs,CY5: CD45)。利用计算算法分析图像,并确定了具有活力和高糖摄取的候选肿瘤细胞,然后由经验丰富的技术人员进行审查。
1.3 统计学方法
定量资料符合正态分布采用均值±标准差表述,不符合正态分布采用中位数(四分位间距)描述;定性资料采用中位数(百分比)描述。两两比较,满足t检验条件采用两独立样本t检验,不满足t检验采用符号秩和检验。针对频数或率的比较采用卡方检验,两两比较采用分割卡方检验,借助R软件的rcompanion包。采用Spearman相关分析,检验不同变量之间的关联性。采用R软件的survival包进行疾病复发无进展生存分析绘制Kaplan-Meier生存曲线。采用多因素Cox回归分析,探究影响疾病复发的联合暴露风险因素。所有统计分析均采用R软件进行,P<0.05为差异有统计学意义。
2 结果
2.1 患者临床特征
共纳入109例ⅢB期或Ⅳ期非小细胞肺癌并明确有EGFR敏感突变的患者,基线特征见表1。基线期平均年龄为61岁,大多数(58.7%)患者为女性,腺癌占比为81.7%,EGFR-19Del突变占比为65.1%,Ⅳ期患者占比85.3%,其中脑转移患者占比72.5%。
表 1 接受一线EGFR-TKI治疗的ⅢB期或Ⅳ期非小细胞肺癌并明确有EGFR敏感突变的患者临床基线特征Table 1 Clinical baseline characteristics of stage ⅢB or Ⅳ NSCLC patients with EGFR mutations receiving first-line EGFR-TKI treatmentClinical characteristics Number (n=109) Gender (n(%)) Male 45(41.3) Female 64(58.7) Age (mean±s, years) 61±10 Smoking history (n(%)) Never 70(64.2) Current/former 39(35.8) Histology type (n(%)) Adenocarcinoma 89(81.7) Non-Adenocarcinoma 20(18.3) Brain metastases (n(%)) Yes 79(72.5) No 30(27.5) Type of mutation EGFR19 71(65.1) EGFR21 38(34.9) Disease stage (n(%)) Ⅲ 16(14.7) Ⅳ 93(85.3) 截至随访结束,根据RECICST标准,79例患者(72.5%)部分缓解(PR),26例患者(23.9%)稳定(SD),4例患者(3.6%)完全缓解(CR)。
2.2 血清CEA、CTCs和ctDNA对患者生存获益的评估
通过Kaplan-Meier生存分析探究治疗前后患者血清CEA、CTCs和ctDNA差值对患者生存获益的评估价值。血清CEA、CTCs和ctDNA分别以10 μg/L、60个/7.5 ml(低风险)、信号比值定性结果[12]作为截断值,将患者分为不同的亚组。在基线检查时,血清CEA值正常范围内的患者在14.6个月时的生存概率为55%,而检查指标异常增高的患者为33%(P=0.044),见图1A。血清ctDNA值正常范围内的患者在14.6个月时的生存概率为50%,而检查指标异常增高的患者为27%(P=0.044),见图1B。CTCs患者基线检查指标无显著差异,但外周血CTCs治疗前后差值分析显示,治疗后CTCs计数增高的患者14.6个月的生存率为65%,而降低的患者为23%(P=0.027 1),见图1C。
多因素Cox回归分析结果显示,ctDNA异常患者的复发风险高于正常患者(HR=1.93, 95%CI: 1.01~3.68, P=
0.0459 );CEA检测获得类似的结果(HR=1.52, 95%CI: 1.01~2.31, P=0.0456 ),但复发风险在两组之间差异无统计学意义,可能归因于研究人群样本量限制,存在混杂因素。治疗前后CTCs计数上升患者的复发风险低于正常患者(HR=0.369, 95%CI: 0.148~0.918, P=0.0321 );在接受EGFR-TKI一线治疗的非小细胞肺癌患者中,SD亚组患者复发风险高于PR或CR的患者(HR=15.8, 95%CI: 2.12~117,P=0.0071 ),见图2。2.3 血清标志物评估SD亚组患者的生存获益
在SD亚组中,诊断时没有脑转移的患者中位PFS为11个月,而发生脑转移患者中位PFS只有4个月(P=0.037),见图3A;与Ⅲ期患者相比,Ⅳ期患者中位无进展生存期显著缩短(P=0.031),见图3B。上述结果表明,在SD亚组患者中,脑转移、分期较晚是患者病情进展的危险因素。
3 讨论
随着基础研究和国内外临床试验的开展,晚期肺癌的治疗方式得到不断优化,5年生存率显著升高,目前临床上晚期非小细胞肺癌EGFR-TKI治疗PFS为15.8个月, 疾病进展风险显著降低了32%[13]。为进一步提高治疗有效率,延长PFS,需要依据患者自身情况采取个体化的治疗方案,筛选出进展风险较高的患者群体采取联合治疗模式。基因突变患者的联合治疗模式,即在靶向治疗的基础上加入抗血管生成药物治疗、化疗、放疗等治疗手段能否延长无病进展生存期,是临床上研究的热点。JO25567研究中A+T治疗模式(联合抗血管生成药物)延长中位PFS达6.3个月[14]。一项EGFR-TKI联合化疗一线治疗晚期非小细胞肺癌临床研究NEJ009结果显示,吉非替尼联合化疗组和吉非替尼单药组的ORR分别为84%和67%,联合治疗组的PFS明显长于吉非替尼单药组(20.9月 vs. 11.2月),但联合用药组3级及以上不良反应发生率对比吉非替尼单药组较高(65.1% vs. 31.4%)[15]。因此,联合治疗不能盲目地应用在所有基因突变患者中,对EGFR-TKI的治疗反应明显的患者应采用单纯的靶向治疗,而加入其他治疗手段会增加不良反应,降低生活质量,加重患者的负担。但对EGFR-TKI的治疗反应欠佳的患者,如果早期应用联合治疗模式,会带来更长的生存期。因此,临床工作中寻找新的预后指标和预测因素对基因突变患者进行分层,筛选出对EGFR-TKI的治疗反应欠佳的患者具有重要意义。
液体活检是一种非侵入性检测,已有临床研究验证了液体活检在肺癌诊断、预测疗效及预后中的意义。深度测序检测ctDNA在肺癌筛查和预后中的研究显示,ctDNA诊断肿瘤早于影像学5.2个月,检测复发率的准确度达到94%[16]。但ctDNA含量低,约占整个循环DNA的1%,分离不当导致背景值过高会影响检测的敏感度[17]。CTCs检测在肺癌诊断中具有较好的敏感度,可以检测直径<0.1 cm的肿瘤,且较传统影像学早6~9周检测到肿瘤[18]。因此多项血清检测指标的联合应用成为研究热点。
卡方分析中,基线期三项联合指标诊断有效率高于任何单一检测手段,这与多项临床研究的结果相一致[7,19]。但由于检测成本高昂在临床应用中存在局限性,在所有患者中开展联合检测成本较高。在单因素分析中,基线期CEA、ctDNA检测异常的患者具有更高的复发率,治疗后外周血CTCs降低提示更高的复发率。治疗1月后,ctDNA计数降低,PFS越长,而CTCs计数升高,PFS越长。在靶向治疗期间,ctDNA计数降低的患者PFS越长,尽管这在统计学上并不显著,但具有临床意义,很多临床研究也证明了这一趋势[20]。而研究观察到治疗后CTCs计数的下降预示更高的复发风险,多因素Cox回归分析进一步证实了这一结论,与之前的一项关于cfDNA和CTCs在接受一线化疗的NSCLC患者预后的预测作用研究结果一致,该研究观察到基线CTCs中位数与OS之间呈正比关系[21]。这可能与它们从肿瘤释放到循环血液中的不同机制有关,cfDNA主要通过被动机制(肿瘤细胞死亡)释放,而CTCs通过主动过程(肿瘤侵袭性)传播。另一方面,需要通过加大样本量、增加检测手段等方式验证这一结论。通过Cox多元回归模型评估各临床特征与预后(PFS)之间的关系,在接受靶向治疗的NSCLC患者中,疗效评估为SD的患者复发风险高于PR或CR的患者,疗效分类具有独立的预后作用。因此,建议将CTCs和ctDNA检测应用到SD亚组患者中。
临床上单纯依据RECIST1.1疗效评估标准,筛选出的SD患者异质性高,无法精准地区分复发风险。有研究试图将液体活检与RECIST疗效评估标准相结合,以期更加精准地反映治疗效果,但结论尚未统一[22-23]。本研究SD亚组分析显示,诊断时没有脑转移的患者中位PFS为11个月,而发生脑转移患者只有4个月;分期越晚,中位无进展生存期越短;在SD患者亚群中,脑转移、分期较晚、较高的ctDNA和较低的CTCs计数可能使一线EGFR-TKI治疗患者具有较高的复发风险。
本研究存在一定的局限性:首先,患者血液指标个体差异较大,受生活习惯、素体差异等多重因素的影响,存在液体活检不同检测指标的同质化问题;其次,需要通过加大样本量、增加检测手段等方式,更大规模的前瞻性研究验证本临床试验的结论。
综上所述,在基线和治疗期间对ctDNA和CTCs的纵向分析可以指导治疗并帮助预测患者预后,血清标志物CTCs和ctDNA可以作为CEA的补充用于评估临床非小细胞肺癌患者的预后;将CTCs和ctDNA检测应用到SD亚组患者中,更好的筛选出对EGFR-TKI的治疗反应欠佳的患者,及早采取联合治疗模式,同时可能避免不必要的治疗以及相关成本和不良反应,为患者带来更长的生存获益。
-
-
[1] EI-serag HB, Rudolph KL. Hepatocellular carcinoma:epidemiology and molecular carcinogenesis[J]. Gastroenterology, 2007, 132(7): 25 57-76. [1] EI-serag HB, Rudolph KL. Hepatocellular carcinoma:epidemiology and molecular carcinogenesis[J]. Gastroenterology, 2007, 132(7) : 2557-76.
[2] Ng KK, Lo CM, Liu CL, et al. Survival analysis of patients with transplantable recurrent hepatocellular carcinoma: implications for salvage liver transplantt[J]. Arch Surg, 2008, 143(1) : 68-74.
[2] Ng KK, Lo CM, Liu CL, et al. Survival analysis of patients with transplantable recurrent hepatocellular carcinoma: implications for salvage liver transplantt[J]. Arch Surg, 2008, 143(1): 68-74. [3] Kim do Y, Paik YH, Ahn SH, et al. PIVKA-II is a useful tumor marker for recurrent hepatocellular carcinoma after surgical resection[J]. Oncology, 2007, 72 Suppl 1: 52-7.
[3] Kim do Y, Paik YH, Ahn SH, et al. PIVKA-II is a useful tumor marker for recurrent hepatocellular carcinoma after surgical resection[J]. Oncology, 2007, 72 Suppl 1: 52-7. [4] McPherron AC. Metabolic Functions of Myostatin and Gdf11[J]. Immunol Endocr Metab Agents Med Chem, 2010, 10(4) : 217-31.
[4] McPherron AC. Metabolic Functions of Myostatin and Gdf11[J]. Immunol Endocr Metab Agents Med Chem, 2010, 10(4): 217-31. [5] Sinha M, Jang YC, Oh J, et al. Restoring systemic GDF11 levels reverses age-related dysfunction in mouse skeletal muscle[J]. Science, 2014, 344(6184): 649-52. [5] Sinha M, Jang YC, Oh J, et al. Restoring systemic GDF11 levels reverses age-related dysfunction in mouse skeletal muscle[J]. Science, 2014, 344(6184) : 649-52.
[6] Shi Y, Liu JP. Gdf11 facilitates temporal progression of neurogenesis in the developing spinal cord[J]. J Neurosci, 2011, 31 (3): 883-93. [6] Shi Y, Liu JP. Gdf11 facilitates temporal progression of neurogenesis in the developing spinal cord[J]. J Neurosci, 2011, 31(3) : 883-93.
[7] Katsimpardi L, Litterman NK, Schein PA, et al. Vascular and neurogenic rejuvenation of the aging mouse brain by young systemic factors[J]. Science, 2014, 344(6184) : 630-4.
[7] Katsimpardi L, Litterman NK, Schein PA, et al. Vascular and neurogenic rejuvenation of the aging mouse brain by young systemic factors[J]. Science, 2014, 344(6184): 630-4. [8] Zhang Y, Shao J, Yang T, et al. Growth differentiation factor 11 is a protective factor for osteoblastogenesis by targeting PPAR gamma[J]. Gene, 2015, 557(2): 209-14. [8] Zhang Y, Shao J, Yang T, et al. Growth differentiation factor 11 is a protective factor for osteoblastogenesis by targeting PPAR gamma[J]. Gene, 2015, 557(2) : 209-14.
[9] Zarzynska JM. Two faces of TGF-beta1 in breast cancer[J]. Mediators Inflamm, 2014, 2014: 141747.
[9] Zarzynska JM. Two faces of TGF-beta1 in breast cancer[J]. Mediators Inflamm, 2014, 2014: 141747. [10] Heldin CH, Landström M, Moustakas A. Mechanism of TGF-β signaling to growth arrest, apoptosis, and epithelialmesenchymal transition[J]. Curr Opin Cell Biol, 2009, 21(2) : 166-76.
[10] Heldin CH, Landström M, Moustakas A. Mechanism of TGF-β signaling to growth arrest, apoptosis, and epithelialmesenchymal transition[J]. Curr Opin Cell Biol, 2009, 21(2): 166-76. [11] Moses H, Barcellos-Hoff MH. TGF-β biology in mammary development and breast cancer[J]. Cold Spring Harb Perspect Biol, 2011, 3(1) : a003277.
[11] Moses H, Barcellos-Hoff MH. TGF-β biology in mammary development and breast cancer[J]. Cold Spring Harb Perspect Biol, 2011, 3(1): a003277. [12] Massagué J. TGF-β in cancer[J]. Cell, 2008, 134(2) : 215-30.
[12] Massagué J. TGF-β in cancer[J]. Cell, 2008, 134(2): 215-30. [13] Finkenzeller G, Stark GB, Strassburg S. Growth differentiation factor 11 supports migration and sprouting of endothelial progenitor[J]. J Surg Res, 2015, 198(1): 50-6. [13] Finkenzeller G, Stark GB, Strassburg S. Growth differentiation factor 11 supports migration and sprouting of endothelial progenitor[J]. J Surg Res, 2015, 198(1) : 50-6.



 下载:
下载: