Predictive Value of Pan-immune-inflammation Value for Prognosis of Patients with Resectable Colorectal Cancer
-
摘要:目的
探讨泛免疫炎症值(PIV)与可切除结直肠癌患者预后的相关性并建立相关的预测模型。
方法纳入753例接受原发病灶切除术且病理学诊断为结直肠癌的患者。将其随机分为训练(n=527)和测试(n=226)队列。通过时间依赖性受试者操作特征(ROC)曲线确定PIV的最佳截断值,将患者分为高水平组和低水平组,分析PIV高、低水平组与患者临床病理特征及生存情况之间的关系。卡方检验、Kaplan-Meier生存分析和Cox回归分析来评估预后。C指数和Brier评分评估模型的准确性。
结果在总生存期(OS)的单变量模型中,高(> 231)基线PIV(HR=1.627; 95%CI: 1.155~2.292, P=0.005)提示PIV水平可能是OS的独立预后因素。依据PIV绘制的诺模图C指数为0.823。其校准曲线显示1年和3年OS率的预测和观察结果之间具有良好的一致性,OS的Brier评分分别为0.035和0.068。
结论PIV可作为可切除结直肠癌患者预后的依据,我们成功建立了一个指导结直肠癌患者临床决策的新型预后模型。
Abstract:ObjectiveTo explore the correlation of the pan-immune-inflammation value (PIV) and the prognosis of patients with resectable colorectal cancer (CRC) and establish a predictive model.
MethodsA total of 753 patients who underwent primary lesion resection and were pathologically diagnosed with CRC were enrolled. They were randomly divided into training (n=527) and test (n=226) cohorts. The best cutoff value of PIV was determined by the time-dependent receiver operator characteristics curve, and patients were divided into high- and low-level groups to analyze the relationship between the high- and low-level groups of PIV and the clinicopathological characteristics and survival of patients. Chi-square test, Kaplan-Meier survival analysis, and Cox regression analysis were used to evaluate the prognosis. The accuracy of the model was evaluated by C index and Brier score.
ResultsIn the univariate model of overall survival (OS), high (> 231) baseline PIV (HR=1.627; 95%CI: 1.155-2.292, P=0.005) suggested that PIV level might be an independent prognostic factor for OS. The nomogram plotted according to PIV had a C index of 0.823. Its calibration curve showed good agreement between predicted and observed outcomes for one- and three-year OS probabilities, with Brier score of 0.035 and 0.068 for OS, respectively.
ConclusionPIV can be used as a prognostic marker in patients with resectable CRC, and a novel prognostic model to guide clinical decision-making in CRC is successfully established.
-
Key words:
- Colorectal cancer /
- Pan-immune-inflammation value /
- Prognosis /
- Nomogram
-
0 引言
结直肠癌是全球发病率和死亡率较高的恶性肿瘤之一,占所有诊断癌症的13%。2021年美国癌症统计数据表明,结直肠癌无论是肿瘤发病率还是死亡率,均位居前三[1]。虽然结直肠癌总体发病率逐年缓慢下降,然而 < 65岁成年人的发病率仍在增加[2]。结肠癌通常起病隐匿,出现明显的症状时大多已到了中晚期,严重影响患者的生存及生活质量。Vijayalekshmi首次提出炎性反应与肿瘤之间的关联性,认为慢性炎性反应刺激可以诱导肿瘤发生[3]。目前已知,炎性反应在肿瘤发生发展中起着重要作用[4-5]。相关研究表明,炎性反应生物标志物是结直肠癌患者的有用预测因素。单核细胞淋巴细胞比值(monocyte to lymphocyte ratio, MLR)、中性粒细胞与淋巴细胞比率(neutrophil to lymphocyte ratio, NLR)、全身性免疫炎性反应指数(systemic immune inflammation index, SII)等相关炎性反应指标被证实是预测结直肠癌患者生存的良好指标[6-9]。然而,即便这些指标已经进入分子选择的时代,由于单一生物标志物的鉴别能力低,在临床实践中仍存在不可忽视的局限性。
新发现的一种免疫炎性反应生物标志物——泛免疫炎症值(pan-immune-inflammation value, PIV),它主要由中性粒细胞计数、血小板计数、单核细胞计数和淋巴细胞计数得出,由于PIV具有全面揭示全身免疫和癌症相关炎性反应状态的潜在能力,PIV被视为晚期癌症患者临床结果的可靠预测指标。因此,基于我们目前对PIV的相关认知及研究,本研究拟探索结直肠癌患者生存结局更有价值的预后标志物,并建立结直肠癌患者的预后模型。
1 资料与方法
1.1 研究人群
本研究共纳入2013年1月—2016年12月在湖北省肿瘤医院接受原发病灶切除术的753例经组织病理学证实的结直肠癌患者。主要分析患者的年龄、性别、结直肠癌家族史、吸烟和饮酒史、TNM分期、肿瘤分化程度、部位、神经浸润、环周切缘和脉管内瘤栓等指标。所有患者均在术前一周检测了血小板、中性粒细胞、单核细胞、淋巴细胞、CEA和CA19-9水平。纳入标准:(1)年龄≥18岁;(2)原发性结直肠癌患者;(3)接受根治性手术的患者。排除标准:(1)合并其他癌症;(2)临床数据缺失的患者。本研究得到了湖北省肿瘤医院伦理委员会和机构审查委员会的批准。此外,所有患者均签署知情同意书。
1.2 研究方法
1.2.1 血液样本分析
术前1周内进行常规血液检查,统计患者的中性粒细胞、单核细胞、血小板及淋巴细胞计数。PIV计算方法如下:中性粒细胞×单核细胞×血小板/淋巴细胞[10]。单因素Cox绘制ROC曲线,根据曲线中对应的灵敏度和特异性,通过(灵敏度+特异性-1)公式获得最大值作为PIV水平的最佳临界值,根据该值将患者分为高水平组和低水平组。将总样本随机分为训练队列(70%)和测试队列(30%)。训练组用于确定PIV截断值并建立预测模型,而验证组用于测试新指标和预测模型的性能。
1.2.2 随访方法
患者定期随访至死亡或2019年9月30日,根据第7版TNM-UICC/AJCC大肠癌分类系统(建议前2年每3~6个月随访一次,第3~5年每6个月随访一次)。DFS定义为从患者接受原发病灶切除术到有影像学证据证明复发的时间,死亡但无进展的患者不接受DFS评估。OS定义:(1)死亡患者的总生存期;(2)未死亡患者为手术至随访结束时间。通过电话、社交软件及患者就诊病例获得随访数据。
1.3 统计学方法
卡方检验或Fisher精确检验比较各组间的差异。通过ROC曲线分析获得PIV截断值,将连续变量转换为分类变量。Kaplan-Meier法建立生存曲线,用对数秩检验分析各组间的差异。多因素Cox回归分析以确定独立的预后因素。C指数和Brier评分用于评估模型的疗效。绘制与时间相关的ROC曲线、校准曲线和列线图,以可视化模型的性能。双尾P < 0.05为差异有统计学意义。通过R3.6.0的“生存ROC”、“时间ROC”、“pec”和“regplot”生成ROC曲线、校准曲线和诺模图。
2 结果
2.1 训练队列
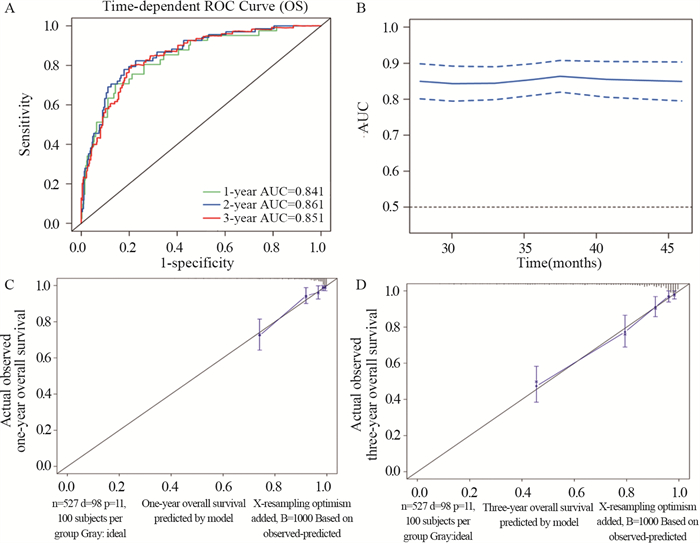
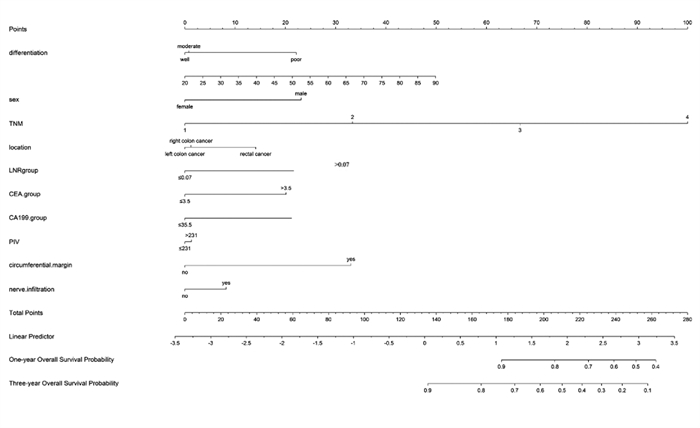
训练队列包括527例患者,根据ROC曲线,将231定为PIV的截断值,将患者分为高水平组(n=255)和低水平组(n=272)。PIV与淋巴结比率、TNM分期、肿瘤部位、CEA和CA19-9水平相关,见表 1。单因素回归分析中发现PIV、年龄、淋巴结比率、分化程度、TNM分期、肿瘤部位、神经浸润、切缘状态、CEA和CA19-9水平可能是OS的独立预后因素。将上述指标纳入多因素回归分析,发现年龄、淋巴结比率、TNM分期、CEA是结直肠癌患者的独立预后因素,见表 2。将上述重要指标和一些基线指标添加到列线图中,最后建立了基于PIV的OS预测模型。
表 1 结直肠癌患者的人口学和肿瘤特征Table 1 Demographic and tumor characteristics of patients with colorectal cancer 表 2 Cox比例风险模型对影响结直肠癌患者总生存率因素的单因素和多因素分析Table 2 Univariate and multivariate analyses of the factors affecting colorectal cancer patients's OS by Cox proportional hazard model
表 2 Cox比例风险模型对影响结直肠癌患者总生存率因素的单因素和多因素分析Table 2 Univariate and multivariate analyses of the factors affecting colorectal cancer patients's OS by Cox proportional hazard model
列线图包括肿瘤分化、性别、TNM分期、肿瘤部位、LNR、CEA和CA19-9水平、PIV、切缘状态、神经浸润等相关指标。在训练队列中,基于年龄、性别、TNM分期、切缘状态、脉管内瘤栓、神经浸润、肿瘤分化程度、PIV、淋巴结比率、肿瘤部位、CEA和CA19-9水平,OS的预测模型的C指数为0.823(95%CI: 0.78~0.87)。基于年龄、性别、TNM分期、切缘状态、神经浸润状态、分化程度、PIV、淋巴结转移率、肿瘤位置、CEA和CA19-9水平,我们用1年和3年的时间相关ROC曲线,以确定这个模型的性能,见图 1A。训练集1年OS曲线下面积(AUC)为0.841,3年OS AUC为0.851。此外,这个模型的AUC值(95%CI)稳定,见图 1B,校准曲线显示1年和3年OS具有良好的一致性,OS的Brier评分分别为0.035和0.068,见图 1C~D。OS列线图,见图 2。
2.2 测试队列
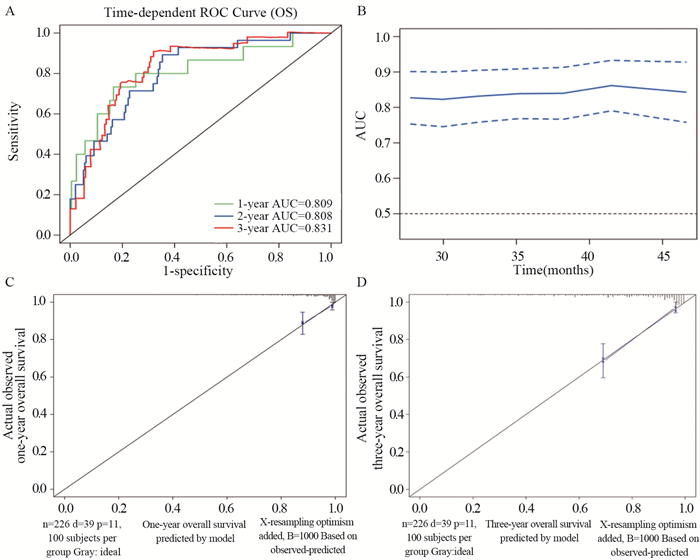
测试队列一共包括226例患者。1年和3年的时间相关ROC曲线用于验证模型的性能,见图 3A。同时,在测试队列中,1年和3年OS率的AUC值分别为0.809和0.831,见图 3B。校准曲线显示1年和3年OS率的预测和观察结果之间具有良好的一致性,OS的Brier评分分别为0.023和0.065,见图 3C~D。
2.3 结直肠癌根治术后患者生存分析
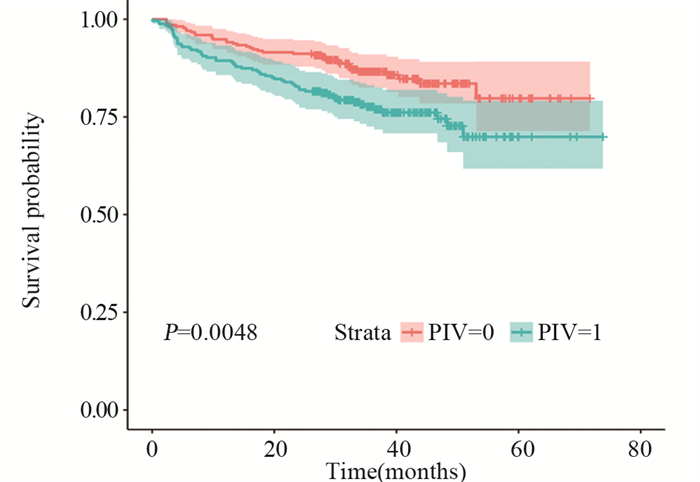
随访时间为0.1~73.8个月,中位随访时间36.9个月。Kaplan-Meier法和对数秩检验结果显示,PIV高水平组患者的OS明显短于PIV低水平组(P=0.0048),见图 4。
3 讨论
本研究发现,PIV与OS相关,是大肠癌患者OS的有效预测因子。更重要的是,使用此指标和其他基线指标创建的预测模型对OS具有很高的预测性能。Fucà等的一项回顾性研究发现,PIV可以指导黑色素瘤的治疗决策过程和新一线治疗策略的开发,与其他基于全血细胞计数(CBC)的生物标志物相比,PIV在预测黑色素瘤患者预后中具有显著优势[10]。在小细胞肺癌及乳腺癌患者中也发现,PIV在这些患者的预后中亦有其不可替代的价值,可指导小细胞肺癌及乳腺癌患者治疗决策,帮助临床医生筛选治疗的优势人群,进一步提高癌症患者治疗的个体化及精确化[11-13]。
肿瘤微环境的特点是持续炎性反应,通常被称为“无法愈合的肿胀”[14]。中性粒细胞具有表型和功能可塑性,根据细胞不同的功能,分为N1/N2中性粒细胞、肿瘤相关中性粒细胞和多形核中性粒细胞髓细胞衍生抑制细胞(neutrophils and polymorphonucler myeloid-derived suppressor cells, PMN-MDSC)等,通过对组织微环境和其他免疫细胞成分的差异调节来提供促进肿瘤和抗肿瘤功能,主要通过重塑细胞外基质(ECM)、促进血管生成以及介导与上皮、基质和免疫细胞等其他细胞类型的相互作用发挥作用[15-17]。肿瘤微环境中的淋巴细胞主要包括CD8+ T细胞、CD4+ T细胞、B细胞等。1986年Rosenberg研究组首先报道了肿瘤浸润淋巴细胞(TILs)[18],各个淋巴细胞亚群的位置、聚集、相互作用是成功抗肿瘤免疫反应必需的。在临床实践中,特别是在免疫检查点阻断(ICB)治疗中[19],TIL是潜在的预后和治疗生物标志物。血小板可以保护肿瘤细胞免受剪切力和NK细胞的攻击,释放溶菌磷酸(LPA)来增强肿瘤细胞的侵入性和血管通透性,还可以表达P-选择素促进肿瘤生长和血管生成等,血小板ITAM和半ITAM(hemITAM)也参与了肿瘤细胞的转移[20-21]。单核细胞可以通过诱导免疫耐受性、血管生成和增加肿瘤细胞传播的各种机制影响肿瘤微环境。同时,单核细胞也可以产生抗肿瘤效应并激活抗原呈递细胞发挥抗肿瘤作用[22]。近年来,大量基于外周血炎性反应指标与肿瘤患者预后关联的研究证实,炎性反应生物标志物是肿瘤患者在多个治疗线上的疾病预后和治疗反应的有用预测因素。
目前,我们发现的新生物标志物PIV,结合了中性粒细胞、淋巴细胞、血小板及单核细胞这四个炎性反应指标,具有全面揭示全身免疫和癌症相关炎性反应状态的潜在能力,更为综合地反映了机体炎性反应及免疫反应状态。骨髓来源抑制细胞(MDSCs)是病理激活的中性粒细胞和单核细胞,主要分为单核细胞系来源的单核细胞MDSCs(M-MDSCs)和粒细胞系来源的粒细胞/多形核细胞MDS(PMN-MDSCs)两种亚型,通过表达S100A8/A9、信号转导和转录激活因子3(STAT3)表达上调、表达精氨酸酶1等发挥抑制免疫应答的作用,可以反映较差的癌症生存结局,且PMN-MDSCs和M-MDSCs的基因特征之间有很多部分重叠,提示中性粒细胞和单核细胞都具有免疫抑制作用[23-24]。PIV具有MDSCs两种组分的免疫抑制作用,表明PIV和癌症预后具有较强的关联性。
目前相关研究表明,结直肠癌患者预后与多个因素相关。韩晶等[25]发现组织学类型、TNM分期是接受结直肠癌根治性切除术患者预后的独立影响因素,而年龄与此类患者预后不相关。李程等[26]对化疗结直肠癌患者研究发现,肿瘤分化程度、T分期、淋巴结转移、化疗后ctDNA水平均是结直肠癌预后的独立影响因素,而组织学类型与预后无相关性。本研究提示PIV水平可能是OS的独立预后因素。依据PIV绘制的诺模图C指数为0.823,其校准曲线显示1年和3年OS率的预测和观察结果之间具有良好的一致性,OS的Brier评分分别为0.035和0.068,客观说明该预测模型较为可靠。Fucà等[27]研究发现,PIV是预测结直肠癌患者生存结果的有力指标,且在GBR模型和多变量模型中,PIV的表现优于其他炎性反应标志物。Corti等[28]研究也表明,PIV可以预测结直肠癌患者预后,这些研究均提示PIV有临床研究价值。
本研究的局限性包括回顾性设计及缺乏前瞻性验证。研究中,我们没有分析纳入的结肠癌患者经过免疫治疗或靶向治疗后是否对血液生物标志物有影响,并且,并未分析在治疗前后炎性反应指标变化是否与患者预后相关联。此外,本文原始数据缺乏患者术后辅助治疗的信息,因此在文章中并未阐明患者术后辅助治疗的差异,后续我们将进一步完善相关数据。由于样本量小、随访时间短等相关原因,本研究目前还处于起步阶段,结果应用到临床中暂时会有不足,在后续研究中会进一步完善相关数据,分不同治疗方案做进一步的分析。随着数据进一步积累,希望后续研究成果能够为临床决策提供帮助。总之,本研究建立了具有良好预测性能的模型,结果显示,PIV可能具有显著的预测价值,有助于临床分析患者的分层和预后。
Competing interests: The authors declare that they have no competing interests.利益冲突声明:所有作者均声明不存在利益冲突。作者贡献:梁 鑫:设计方案、统计数据及撰写文章梁新军:指导设计方向及论文修改魏少忠:设计方案、提出论文修改指导性建议 -
表 1 结直肠癌患者的人口学和肿瘤特征
Table 1 Demographic and tumor characteristics of patients with colorectal cancer

表 2 Cox比例风险模型对影响结直肠癌患者总生存率因素的单因素和多因素分析
Table 2 Univariate and multivariate analyses of the factors affecting colorectal cancer patients's OS by Cox proportional hazard model

-
[1] Siegel RL, Miller KD, Fuchs HE, et al. Cancer Statistics, 2021[J]. CA Cancer J Clin, 2021, 71(1): 7-33. doi: 10.3322/caac.21654
[2] Siegel RL, Miller KD, Goding Sauer A, et al. Colorectal cancer statistics, 2020[J]. CA Cancer J Clin, 2020, 70(3): 145-164. doi: 10.3322/caac.21601
[3] Aggarwal BB, Vijayalekshmi RV, Sung B. Targeting inflammatory pathways for prevention and therapy of cancer: short-term friend, long-term foe[J]. Clin Cancer Res, 2009, 15(2): 425-430. doi: 10.1158/1078-0432.CCR-08-0149
[4] Alifano M, Mansuet-Lupo A, Lococo F, et al. Systemic inflammation, nutritional status and tumor immune microenvironment determine outcome of resected non-small cell lung cancer[J]. PLoS One, 2014, 9(9): e106914. doi: 10.1371/journal.pone.0106914
[5] Shrihari TG. Dual role of inflammatory mediators in cancer[J]. Ecancermedicalscience, 2017, 11: 721.
[6] Mantovani A, Marchesi F, Malesci A, et al. Tumour-associated macrophages as treatment targets in oncology[J]. Nat Rev Clin Oncol, 2017, 14(7): 399-416. doi: 10.1038/nrclinonc.2016.217
[7] Mazaki J, Katsumata K, Kasahara K, et al. Neutrophil-to-lymphocyte ratio is a prognostic factor for colon cancer: a propensity score analysis[J]. BMC Cancer, 2020, 20(1): 922. doi: 10.1186/s12885-020-07429-5
[8] Chen JH, Zhai ET, Yuan YJ, et al. Systemic immune-inflammation index for predicting prognosis of colorectal cancer[J]. World J Gastroenterol, 2017, 23(34): 6261-6272. doi: 10.3748/wjg.v23.i34.6261
[9] Edin S, Wikberg ML, Dahlin AM, et al. The distribution of macrophages with a M1 or M2 phenotype in relation to prognosis and the molecular characteristics of colorectal cancer[J]. PLoS One, 2012, 7(10): e47045. doi: 10.1371/journal.pone.0047045
[10] Fucà G, Beninato T, Bini M, et al. The Pan-Immune-Inflammation Value in Patients with Metastatic Melanoma Receiving First-Line Therapy[J]. Target Oncol, 2021, 16(4): 529-536. doi: 10.1007/s11523-021-00819-0
[11] Zeng R, Liu F, Fang C, et al. PIV and PILE Score at Baseline Predict Clinical Outcome of Anti-PD-1/PD-L1 Inhibitor Combined With Chemotherapy in Extensive-Stage Small Cell Lung Cancer Patients[J]. Front Immunol, 2021, 12: 724443. doi: 10.3389/fimmu.2021.724443
[12] Sahin AB, Cubukcu E, Ocak B, et al. Low pan-immune-inflammation-value predicts better chemotherapy response and survival in breast cancer patients treated with neoadjuvant chemotherapy[J]. Sci Rep, 2021, 11(1): 14662. doi: 10.1038/s41598-021-94184-7
[13] Ligorio F, Fucà G, Zattarin E, et al. The Pan-Immune-Inflammation-Value Predicts the Survival of Patients with Human Epidermal Growth Factor Receptor 2 (HER2)-Positive Advanced Breast Cancer Treated with First-Line Taxane-Trastuzumab-Pertuzumab[J]. Cancers (Basel), 2021, 13(8): 1964. doi: 10.3390/cancers13081964
[14] Dvorak HF. Tumors: wounds that do not heal. Similarities between tumor stroma generation and wound healing[J]. N Engl J Med, 1986, 315(26): 1650-1659. doi: 10.1056/NEJM198612253152606
[15] Giese MA, Hind LE, Huttenlocher A. Neutrophil plasticity in the tumor microenvironment[J]. Blood, 2019, 133(20): 2159-2167. doi: 10.1182/blood-2018-11-844548
[16] Powell DR, Huttenlocher A. Neutrophils in the Tumor Microenvironment[J]. Trends Immunol, 2016, 37(1): 41-52. doi: 10.1016/j.it.2015.11.008
[17] Zhang X, Zhang W, Yuan X, et al. Neutrophils in cancer development and progression: Roles, mechanisms, and implications (Review)[J]. Int J Oncol, 2016, 49(3): 857-867. doi: 10.3892/ijo.2016.3616
[18] Rosenberg SA, Spiess P, Lafreniere R. A new approach to the adoptive immunotherapy of cancer with tumor-infiltrating lymphocytes[J]. Science, 1986, 233(4770): 1318-1321. doi: 10.1126/science.3489291
[19] Paijens ST, Vledder A, de Bruyn M, et al. Tumor-infiltrating lymphocytes in the immunotherapy era[J]. Cell Mol Immunol, 2021, 18(4): 842-859. doi: 10.1038/s41423-020-00565-9
[20] Nieswandt B, Hafner M, Echtenacher B, et al. Lysis of tumor cells by natural killer cells in mice is impeded by platelets[J]. Cancer Res, 1999, 59(6): 1295-1300. http://pdfs.semanticscholar.org/c955/12465e6e7a6ba95355969d91ff14a15e1cd5.pdf
[21] Schlesinger M. Role of platelets and platelet receptors in cancer metastasis[J]. J Hematol Oncol, 2018, 11(1): 125. doi: 10.1186/s13045-018-0669-2
[22] Ugel S, Canè S, De Sanctis F, et al. Monocytes in the Tumor Microenvironment[J]. Annu Rev Pathol, 2021, 16: 93-122. doi: 10.1146/annurev-pathmechdis-012418-013058
[23] Kim R, Hashimoto A, Markosyan N, et al. Ferroptosis of tumour neutrophils causes immune suppression in cancer[J]. Nature, 2022, 612(7939): 338-346. doi: 10.1038/s41586-022-05443-0
[24] Veglia F, Sanseviero E, Gabrilovich DI. Myeloid-derived suppressor cells in the era of increasing myeloid cell diversity[J]. Nat Rev Immunol, 2021, 21(8): 485-498. doi: 10.1038/s41577-020-00490-y
[25] 韩晶, 王贵英, 张难, 等. 肿瘤部位及临床病理特征对不同TNM分期行结直肠癌根治性切除术患者预后的影响研究[J]. 中国全科医学, 2020, 23(18): 2275-2283. https://www.cnki.com.cn/Article/CJFDTOTAL-QKYX202018010.htm Han J, Wang GY, Zhang N, et al. Associations of Primary Tumor Site and Clinicopathologic Features with TNM-related Survival in Patients with Radical Resection of Colorectal Cancer[J]. Zhongguo Quan Ke Yi Xue, 2020, 23(18): 2275-2283. https://www.cnki.com.cn/Article/CJFDTOTAL-QKYX202018010.htm
[26] 李程, 闫柯, 霍斌亮, 等. 结直肠癌不同病理特征患者化疗前后循环肿瘤DNA水平变化及预后预测的列线图模型构建[J]. 疑难病杂志, 2022, 21(6): 566-570, 581. https://www.cnki.com.cn/Article/CJFDTOTAL-YNBZ202206003.htm Li C, Yan K, Huo BL, et al. Construction of a nomogram model for changes in circulating tumor DNA levels before and after chemotherapy in pa-tients with colorectal cancer with different pathological characteristics and prognosis prediction[J]. Yi Nan Bing Za Zhi, 2022, 21(6): 566-570, 581. https://www.cnki.com.cn/Article/CJFDTOTAL-YNBZ202206003.htm
[27] Fucà G, Guarini V, Antoniotti C, et al. The Pan-Immune-Inflammation Value Is a New Prognostic Biomarker in Metastatic Colorectal Cancer: Results From a Pooled-Analysis of the Valentino and TRIBE First-Line Trials[J]. Br J Cancer, 2020, 123(3): 403-409. doi: 10.1038/s41416-020-0894-7
[28] Corti F, Lonardi S, Intini R, et al. The Pan-Immune-Inflammation Value in microsatellite instability-high metastatic colorectal cancer patients treated with immune checkpoint inhibitors[J]. Eur J Cancer, 2021, 150: 155-167. doi: 10.1016/j.ejca.2021.03.043
-
期刊类型引用(2)
1. 张文兵,刘洁,何文霞,陈敬,曹辉. 贝伐珠单抗联合XELOX化疗方案治疗转移性结直肠癌患者的有效性及安全性. 中外医学研究. 2024(09): 10-14 .  百度学术
百度学术
2. 宋广全. 贝伐珠单抗治疗转移性结直肠癌患者的临床效果分析. 中国实用医药. 2024(23): 122-124 .  百度学术
百度学术
其他类型引用(0)



 下载:
下载: