文章信息
- 胡明明,胡瑛,贺加贝,刘志东,王子彤,张海青,李宝兰.
- HU Mingming, HU Ying, HE Jiabei, LIU Zhidong, WANG Zitong, ZHANG Haiqing, LI Baolan.
- 肺原发黏液表皮样癌12例并文献复习
- Primary Pulmonary Mucoepidermoid Carcinoma: Twelve Cases Report and Literature Review
- 肿瘤防治研究, 2016, 43(04): 309-312
- Cancer Research on Prevention and Treatment, 2016, 43(04): 309-312
- http://www.zlfzyj.com/CN/10.3971/j.issn.1000-8578.2016.04.015
-
文章历史
- 收稿日期: 2015-06-10
- 修回日期: 2015-10-14
2. 101149 北京,北京市结核病胸部肿瘤研究所/首都医科大学附属北京胸科医院胸外科;
3. 101149 北京,北京市结核病胸部肿瘤研究所/首都医科大学附属北京胸科医院病理科
2. Department of Thoracic Surgery, Beijing Tuberculosis and Thoracic Tumor Research Institute/Beijing Chest Hospital, Capital Medical University, Beijing 101149, China;
3. Department of Pathology, Beijing Tuberculosis and Thoracic Tumor Research Institute/Beijing Chest Hospital, Capital Medical University, Beijing 101149, China
肺黏液表皮样癌(pulmonary mucoepidermoid carcinoma,PMEC)是一种非常罕见的原发于气管支气管树黏膜下的小唾液腺肿瘤,其发病率约占肺部原发肿瘤的0.1%~0.2%[1],因此对于该病的临床诊治经验不足。现对本院自1999年—2014年收治的有完整资料的12例PMEC患者进行临床特征、胸部影像学、病理学特征和预后等进行回顾性分析,以增加对此病的认识,提高诊治水平。
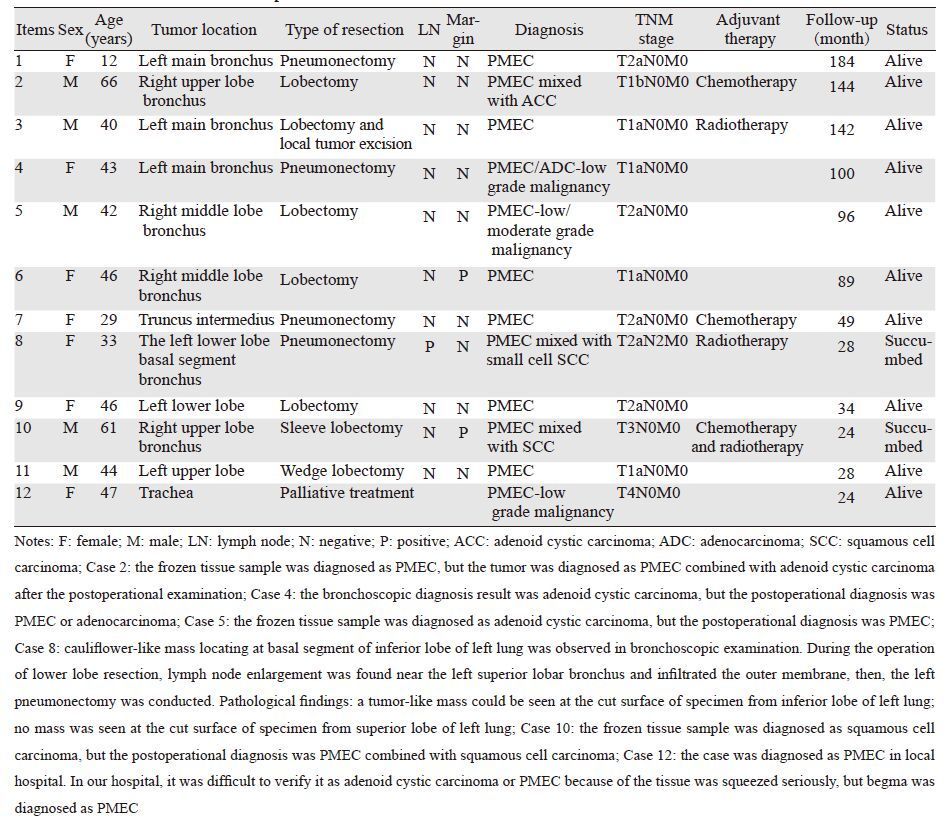
1 病例资料我院自1999年1月—2014年7月诊治原发肺部肿瘤患者4 739例,其中PMEC患者共12例,女7例,男5例,中位年龄43.5岁(12~66岁)。不吸烟者10例,仅1例有长期吸烟史,1例吸烟信息不详。12例患者就诊时的临床症状为咳嗽(7例)、血痰(7例)、胸闷(3例)、发热(2例)、乏力(1例),其中2例患者曾咳出大块肉样异物。从症状出现至首次来我院就诊的时间最短为3周,最长为3年,中位时间为3.5月。自来我院就诊至最终明确诊断时间最短为12天,最长为35天,中位时间为20天。
12例患者中有10例患者术前检测了血清肿瘤标志物水平,3例患者出现异常,其中1例NSE 14.4 ng/ml(正常值:0~10 ng/ml),CYFRA 4.3(正常值:0~4 ng/ml);1例胃泌素前体438.7 ng/ml(正常值:0~50 ng/ml);1例NSE 11.279 ng/ml(正常值:0~10 ng/ml),其余肿瘤标志物检测均在正常范围内。经纤维支气管镜、胸部X线、CT等检查结果为:10例发生在近端支气管,表现为中心型肺癌,包括气管中段1例,主支气管3例,右中间干1例,叶支气管4例,段支气管1例;2例发生在远端支气管,表现为外周型肺癌。病灶位于左肺6例,右肺5例,气管中段1例。胸部X线或CT检查可表现为肺门块影、或伴远端肺不张,或不见肿块阴影仅见肺炎及阻塞性肺不张,可表现为外周肺野的肿块,或表现为主支气管内的肿物。12例患者中,11例行纤维支气管镜检查,11例中除2例外周型PMEC外,其余均可于镜下见到新生物。11例接受了手术治疗,其中全肺切除4例,肺叶切除4例,肺叶袖状切除2例,病灶楔形切除1例。手术后3例接受了辅助放疗,3例接受了辅助化疗;1例因手术难度较大,给予气管镜下姑息治疗和局部放疗。11例接受手术切除治疗的患者中,有10例于手术前纤维支气管镜下取得活检,1例确诊为PMEC,7例为阴性,1例诊断为腺样囊性癌,1例诊断为鳞癌;术中7例取肿瘤组织进行冰冻切片病理检查,3例确诊为PMEC,1例为鳞癌,1例考虑为腺样囊性癌,2例仅诊断为恶性组织。
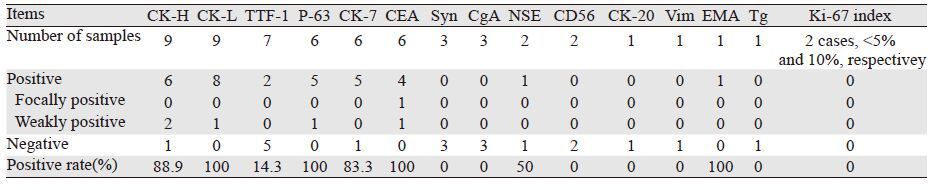
术后切除肿物的最大径中位值为2.9 cm (0.8~6.0 cm),其中1例伴淋巴结转移,2例手术切缘残留癌阳性。经典的PMEC在镜下可见到表皮样细胞、中间型细胞及黏液细胞三种成分。低级别主要由黏液细胞和分化好的表皮细胞构成,核异型性不明显。中等级别则可见更多的中间型细胞和表皮细胞,细胞异型性较明显。本组12例患者中,有2例报告为低度恶性,1例为低-中度恶性,其余9例未对恶性程度作相关描述。11例手术患者中,7例术后病理报告确诊为PMEC;1例PMEC伴小细胞鳞癌成分;1例PMEC伴鳞癌成分;1例诊断为PMEC伴有腺样囊性癌成分;1例诊断为PMEC或者腺癌。1例无法手术者于当地医院诊断为PMEC,我院病理活检所取组织挤压严重,诊断为PMEC或腺样囊性癌,后经咳出物确诊为PMEC,见表 1。9例术后对组织标本进行了免疫组织化学的检测,依具体情况,分别选择了不同的指标进行组合,结果见表 2。
 |
本组患者随访时间24~196月,中位随访时间为69月。随访过程中2例因为肿瘤复发转移死亡,生存时间分别为24和28月,其病理特征为1例PMEC伴鳞癌,1例PMEC伴小细胞鳞癌;其余10例均健在,分别为低级别和中等级别PMEC患者。现本组患者中满10年生存者4例,满5年生存者6例,见表 1。
2 讨论黏液表皮样癌通常起源于腮腺、下颌下腺等大唾液腺和口腔、颌周的小唾液腺,原发于肺的黏液表皮样癌(PMEC)很少见。我院自1999年连续收治的4 739例肺原发肿瘤患者中仅有12例诊断为PMEC,发病率为0.25%,与文献报道发病率接近[1]。
PMEC同其他类型的肺癌相比较,在人口学资料上有独特的特点。本组12名患者中,女7例,男5例,男女比例为1:1.4。发病年龄较轻,中位年龄为43.5岁,最小的为1例12岁女童。国内报道[2],在小儿和青少年原发的气管支气管肿瘤中,PMEC的发生率为82.35%(14/17),国内外文献中均可检索到低龄患儿的案例报道[2, 3, 4]。本组中仅1例患者有长期吸烟史(1包/天,50年),其余患者均不吸烟,提示吸烟不是PMEC的致病因素。本组患者在人口学资料与吸烟状况分布上,与国内外文献报道相比没有明显的差异[5, 6, 7, 8]。
PMEC好发于大气道,外周型的罕见,本组中仅有2例外周型PMEC。患者就诊的症状包括大气道阻塞、刺激的局部症状和发热、乏力等全身症状,症状相对缺少特异性,部分患者于当地曾按结核、哮喘、支气管炎治疗,本组中有2例患者在出现咳嗽、咳痰症状后3年行纤维支气管镜检查发现肿物,从而明确诊断,提示我们支气管镜检查是诊断此病的重要手段。本组中有11例行纤维支气管镜检查,除2例外周型外,均可于镜下发现异常新生物。因此,凡是肺内反复感染,治疗无效的患者应考虑及时行气管镜检查以明确大气道内是否有病变。
由于PMEC发病率低,而且组织成分复杂,尤其是中间型细胞难以辨别,致使关于PMEC的诊断经验不足,尤其是高级别PMEC,难与腺鳞癌相鉴别[9],本组病例中术前通过纤维支气管镜活检确诊者仅1例,1例误诊为腺样囊性癌,1例误诊为鳞癌;术中7例进行冰冻切片病理检查,3例确诊为PMEC,1例误诊为鳞癌,1例误诊为腺样囊性癌,2例仅诊断为恶性组织,其余均通过术后标本明确诊断。本组患者中,病例2,术中冰冻诊断为PMEC,术后病理诊断为PMEC伴有腺样囊性癌成分;病例4,气管镜活检诊断为腺样囊性癌,术后病理诊断为PMEC或腺癌;病例5,术中冰冻诊断为腺样囊性癌,术后病理诊断为PMEC;病例10,术中冰冻诊断为鳞癌,术后病理诊断为PMEC伴鳞癌;病例12,当地医院活检诊断为PMEC,我院取活检时因为组织挤压严重,考虑为PMEC或腺阳囊性癌,后经咳出物活检,确诊为PMEC,这些信息说明对PMEC与腺样囊性癌、鳞癌的鉴别诊断尚缺乏充分的经验。免疫组织化学检测是鉴别诊断的重要手段,Brunnström等[10]认为,TTF-1和Backspin A双阴性可以基本上排除腺鳞癌的可能性。Shilo[5]报道了6例中央型低级别PMEC病例的免疫组织化学检测结果为全部TTF-1阴性。本文总结了12例PMEC患者的免疫组织化学结果,为目前公开发表文献中纳入病例数最多的报道,TTF-1为肺癌免疫组织化学检测中最为常用的指标之一,本组TTF-1共检测7例样本,其中5例阴性者均为中央型PMEC,2例阳性者均为外周型PMEC。国外学者报道,TTF-1是原发外周型肺癌的标志物[11]。因此,虽然本组有2例TTF-1阳性患者,这与肿瘤的特殊位置有关。Ki-67是一种与细胞周期相关的蛋白质,通过Ki-67指数可以了解恶性肿瘤的细胞增殖活性,本组检测了2例TTF-1阳性组织的Ki-67指数,结果1例为10%,1例为5%,这与低度恶性肿瘤的生物学特性吻合。
根据组织学形态、细胞异型性、核分裂象和坏死程度,PMEC可分为低级别、中等级别和高级别,该分级与其生物学行为相关,高级别肿瘤罕见,但是侵袭性明显,预后差,组织学分级是PMEC患者最重要的预后因子[12]。国外报道[13]1例发生骨髓转移的高级别黏液表皮样癌患者,入院后16天死亡。Heitmiller等[8]报道了18例PMEC,其中15例为低级别病例,在中位随访时间为4.7年时全部生存,3例高级别肿瘤均在诊断后16月内死亡。本组病例中对3例肿瘤组织的恶性程度进行了描述,其他病例没有对恶性程度作专门描述。病例12在纤维气管镜下行肿瘤的局部治疗,肿物经组织病理学检测为低度恶性,即低级别PMEC,目前已经生存满2年,未见复发和转移征象;病例4和病例5分别为低度恶性和低/中度恶性,目前均健在,这与国内外低级别PMEC的生存报道是一致的[8, 14, 15]。因此,PMEC在诊断时若能增加肿瘤细胞的分级信息,可以增加对患者预后判断的准确性。
本组12例中有3例伴有其他成分:其中病例2为PMEC伴腺样囊性癌,手术病理分期为T1bN0M0,术后给予辅助化疗,目前仍健在;病例8为PMEC伴小细胞鳞癌患者,手术病理诊断为T2aN2M0,术后给予辅助放疗,随访至28月时因肿瘤复发转移死亡;病例10为PMEC伴鳞癌患者,手术病理诊断为T3N0M0,手术切缘残癌细胞阳性,术后给予辅助放疗和化疗,随访至24月时因肿瘤多发转移死亡,对放化疗不敏感。本组病例在预后特点上呈现为:单纯成分的PMEC预后好,目前10例仍全部在世;伴有鳞癌成分者,如本组2例伴鳞癌和小细胞鳞癌成分者,则疾病进展迅速,生存期明显短于前者。本组患者中不论是在活检中,或在冰冻组织检查中,都有误诊为腺样囊性癌的病例,尤其在气管镜活检标本较小时鉴别难度增加,说明腺样囊性癌与PMEC的鉴别仍需引起注意[16]。
手术切除是PMEC的标准治疗,文献报道,低级别者可以获得长期生存,10年生存率能达到100%,不必行辅助治疗[17]。但高级别者即便给予手术切除,预后依然较差,对此类肿瘤的有效治疗手段也鲜有报道[18, 19],随着非小细胞肺癌靶向治疗的进展,针对PMEC中表皮生长因子受体酪氨酸激酶抑制剂(EGFR-TKI)治疗的研究也陆续有报道[20, 21, 22],为高级别PMEC患者的治疗提供了思路。
本研究的时间跨度为16年,可能早年一些诊断上难以区分的病例,随着诊断技术的进步,现在已经可以明确诊断。但是因为原PMEC的发病率很低,仍有必要对这些少见病例加以总结,以增加对该病的诊治经验。
| [1] | Leonardi HK, Jung-Legg Y, Legg MA, et al. Tracheobronchial mucoepidermoid carcinoma. Clinicopathological features and results of treatment[J]. J Thorac Cardiovasc Surg, 1978, 76(4): 431-8. |
| [2] | Yu Y, Song Z, Chen Z, et al. Chinese pediatric and adolescent primary tracheobronchial tumors: a hospital-based study[J]. Pediatr Surg Int, 2011, 27(7): 721-6. |
| [3] | Deschildre A, Sardet A, Brouard J, et al. Bronchial mucoepidermoid carcinoma: apropos of 3 cases[J]. Arch Pediatr, 1996, 3(7): 689-93. |
| [4] | Qian X, Sun Z, Pan W, et al. Childhood bronchial mucoepidermoid tumors: A case report and literature review[J]. Oncol Lett, 2013, 6(5): 1409-12. |
| [5] | Shilo K, Foss RD, Franks TJ, et al. Pulmonary mucoepidermoid carcinoma with prominent tumor-associated lymphoid proliferation[J]. Am J Surg Pathol, 2005, 29(3): 407-11. |
| [6] | Lin MF, Yang ZY, Zhang HY. Clinical analysis of 96 cases of bronchial mucoepidermoid carcinoma[J]. Shi Yong Zhong Liu Xue Za Zhi, 2006, 20(2): 129-30. [林敏芳, 杨之怡, 张宏英. 支气管粘液表皮样癌96例临床分析[J]. 实用肿瘤学杂志, 2006, 20(2): 129-30.] |
| [7] | Li X, Zhang W, Wu X, et al. Mucoepidermoid carcinoma of the lung: common findings and unusual appearances on CT[J]. Clin Imaging, 2012, 36(1): 8-13. |
| [8] | Heitmiller RF, Mathisen DJ, Ferry JA, et al. Mucoepidermoid lung tumors[J]. Ann Thorac Surg, 1989, 47(3): 394-9. |
| [9] | Sonobe S, Inoue K, Tachibana S, et al. A case of pulmonary mucoepidermoid carcinoma responding to carboplatin and paclitaxel[J]. Jpn J Clin Oncol, 2014, 44(5): 493-6. |
| [10] | Brunnstrouml;m H, Johansson L, Jirstrouml;m K, et al. Immunohistochemistry in the differential diagnostics of primary lung cancer: an investigation within the Southern Swedish Lung Cancer Study[J]. Am J Clin Pathol, 2013, 140(1): 37-46. |
| [11] | Du EZ, Goldstraw P, Zacharias J, et al. TTF-1 expression is specific for lung primary in typical and atypical carcinoids: TTF-1-positive carcinoids are predominantly in peripheral location[J]. Hum Pathol, 2004, 35(7): 825-31. |
| [12] | Alsidawi S, Morris JC, Wikenheiser-Brokamp KA,et al. Mucoepidermoid carcinoma of the lung: a case report and literature review[J]. Case Rep Oncol Med, 2013, 2013: 625243. |
| [13] | Pan Z, Yang G, Qu L, et al. Bone marrow metastasis in primary bronchial mucoepidermoid carcinoma: a case report[J]. World J Surg Oncol, 2014, 21(12): 158. |
| [14] | Chin CH, Huang CC, Lin MC, et al. Prognostic factors of tracheobronchial mucoepidermoid carcinoma-15 years experience[J]. Respirology, 2008, 13(2): 275-80. |
| [15] | Yu CH, Yin J, Liu Y, et al. Surgical treatment and prognostic analysis of pulmonary mucoepidermoid carcinoma[J]. Lin Chuang Fei Ke Za Zhi, 2010, 15(3): 342-3. [于长海, 尹静, 刘颖, 等. 肺粘液表皮样癌的外科治疗与预后分析[J]. 临床肺科杂志, 2010, 15(3): 342-3.] |
| [16] | Lu M, Liu WH. Pathological features of primary pulmonary salivary gland tumor of the lung[J]. Xin Fei Xue Guan Bing Za Zhi, 2011, 5(30): 420-3. [陆鸣, 柳玮华. 原发性肺涎腺肿瘤临床病理特点[J]. 心肺血管病杂志, 2011, 5(30): 420-3.] |
| [17] | Neville HL, Hogan AR, Zhuge Y, et al. Incidence and outcomes of malignant pediatric lung neoplasms[J]. J Surg Res, 2009, 156(2): 224-30. |
| [18] | Vadasz P, Egervary M. Mucoepidermoid bronchial tumors: a review of 34 operated cases[J]. Eur J Cardiothorac Surg, 2000, 17(5): 566-9. |
| [19] | Xue Q, Zhang DC, He J, et al. Mucoepidermoid carcinoma derives from tracheobronchial tree[J]. Ai Zheng, 2002, 21(6): 681. [薛奇, 张德超, 赫捷, 等. 气管支气管粘液表皮样癌[J]. 癌症, 2002, 21 (6): 681.] |
| [20] | Han SW, Kim HP, Jeon YK, et al. Mucoepidermoid carcinoma of lung: potential target of EGFR-directed treatment[J]. Lung Cancer, 2008, 61(1): 30-4. |
| [21] | Yu Y, Song Z, Gao H, et al. EGFR L861Q mutation is a frequent feature of pulmonary mucoepidermoid carcinoma[J]. Cancer Res Clin Oncol, 2012, 138(8): 1421-5. |
| [22] | Li X, Liao ZJ, Guo YH, et al. Pulmo-mucoepidermeid carcinoma with esophagus metastases: a case report and review of literature[J]. Zhong Liu Fang Zhi Yan Jiu, 2011, 38(12): 1462. [李旭, 廖子君, 郭亚焕, 等. 肺黏液表皮样癌食管转移1例报道及文献回顾[J]. 肿瘤防治研究, 2011, 38(12): 1462.] |
 2016, Vol. 43
2016, Vol. 43