文章信息
- 付锴,江普查,刘细国.
- FU Kai,JIANG Pucha,LIU Xiguo.
- 慢病毒载体介导RNAi稳定抑制VASH1表达对人脑胶质瘤细胞增殖、凋亡的影响
- Investigation on Effect of Lentiviral Vector-mediated RNA Interference Inhibiting VASH1 Expression on Proliferation and Apoptosis of Human Glioma Cells U-87MG
- 肿瘤防治研究, 2016, 43(03): 193-196
- Cancer Research on Prevention and Treatment, 2016, 43(03): 193-196
- http://www.zlfzyj.com/CN/10.3971/j.issn.1000-8578.2016.03.005
-
文章历史
- 收稿日期: 2015-05-28
- 修回日期: 2015-10-20
2. 430079 武汉,湖北省肿瘤医院神经外科
2. Department of Neurosurgery, Hubei Cancer Hospital, Wuhan 430079, China
恶性肿瘤生长、浸润和转移依赖新生血管形成,肿瘤新生血管生成的过程受到诸多因素的影响,包括多种血管生长调节因子、血管抑制调节因子和癌基因等[1]。VASH1是新近发现的受VEGF、成纤维生长因子2(FGF-2)诱导在人血管内皮细胞(human umbilical vein endothelial cell,HUVEC)中特异性表达的血管生成抑制因子[2]。近来有学者发现VASH1在子宫内膜癌以及肾细胞癌中的表达水平随着其肿瘤恶性程度的增高而降低[3, 4]。但VASH1在胶质瘤中的表达尚无相关报道。本研究利用慢病毒载体在人脑胶质瘤U-87MG细胞内通过RNA干扰技术,稳定抑制VASH1基因的表达,并观察对人脑胶质瘤U-87MG细胞增殖、凋亡的影响,为后期研究VASH1基因在胶质瘤中的生物学作用奠定基础。
1 材料与方法 1.1 材料慢病毒载体系统pGCL-GFP载体、pHelper 1.0(gag/pol元件)载体、pHelper 2.0(VSVG元件)载体、293T细胞、DH5α大肠杆菌菌株由上海吉凯基因化学公司提供。人脑胶质瘤U-87MG细胞由上海中科院细胞所提供。胎牛血清和DMEM及F12培养液(美国Gibco公司)。限制性内切酶HpaⅠ和EcoRⅠ、T4 DNA连接酶(美国New England BioLabs公司),质粒抽提及凝胶纯化试剂盒(德国Qiagen公司),TRIzol试剂盒及Lipofectamine2000(美国Invitrogen公司),RT-PCR试剂盒[Takara宝生物工程(大连)有限公司],鼠抗人VASH1一抗、兔抗鼠VASH1二抗、鼠抗人β-actin一抗、兔抗鼠β-actin二抗均购自美国Santa Cruz Biotechnology公司。
1.2 方法 1.2.1 细胞培养人脑胶质瘤U-87MG细胞放在10%新生牛血清的DMEM培养液中,内加青霉素100 u/ml,链霉素100 μg/ml,置于5%CO2、饱和湿度、37℃恒温培养箱内培养。
1.2.2 VASH1 shRNA慢病毒表达载体的构建通过Genbank数据库检索VASH1基因的相关信息,应用Ambion公司的在线设计软件,选择人VASH1基因(基因序列号:NM_014909)cDNA序列上1307~1331位点,siRNA序列为5'- AGCGCTACAT CAGAGAGCTGCAGTA-3'。经BLAST检索确认与VASH1以外的人类已知基因序列无同源性。设计并合成VASH1 shRNA的DNA Oligo,退火形成双链DNA,HpaⅠ、EcoRⅠ双酶切、连接载体,转化大肠杆菌DH5α后进入pGCL-GFP表达质粒。挑取重组阳性克隆行PCR,送测序鉴定(上海吉凯基因技术公司)。混合pGCL-GFP载体20 μg,pHelper 1.0载体15 μg,pHelper 2.0载体10 μg,共转染293T细胞。转染后8 h更换为完全培养液,培养48 h后,收集富含慢病毒颗粒的细胞上清液,-80℃保存备用[5]。
1.2.3 实验分组及慢病毒载体转染实验分为3组:空白对照组(未转染);阴性对照组(转染液加入空质粒pGCL-GFP-Negative);VASH1 shRNA组(转染液加入pGCL-GFP-VASH1慢病毒载体)。将人脑胶质瘤U-87MG细胞分3组用Lipofectin 2000介导进行转染。
1.2.4 RT-PCR检测U-87MG细胞中VASH1mRNA的表达 收集细胞,按TRIzol试剂说明提取细胞总RNA,按RT-PCR试剂盒说明书进行cDNA反转录。Caspase3上游引物:5′-GGAAGCGAATCAATGCAGTC-3',下游引物:5'-CTCAGAAGCACACA AACAAAAC-3';内参照β-actin上游引物:5'-GGCG GCACCACCATGTACCCT-3',下游引物:5′-AGGGGCCCGGACTCTCGTCATACT-3'。扩增产物经2%琼脂糖凝胶电泳。经凝胶图像分析仪分析结果。以VASH1与β-actin条带的吸光度比值表示VASH1 mRNA的相对含量。 1.2.5 Western
blot检测U-87MG细胞中VASH1蛋白的表达量 收集细胞,细胞裂解液处理细胞,离心后取上清液,考马斯亮蓝法测定蛋白质浓度,聚丙烯酞胺凝胶电泳,将蛋白电转至硝酸纤维膜上,与VASH1抗体结合,之后用辣根过氧化物酶结合的二抗结合,ECL法显色后照相。最后以Image-Pro Plus 4.5图像分析系统测定各条带灰度值,以此反映VASH1蛋白的表达度。 1.2.6 MTT法检测转染VASH1
shRNA后U-87MG细胞的生长增殖活性 将3组细胞分别接种于96孔培养板中,细胞终密度约为3.5×104/L,接种24 h后进行转染。分别培养24、48、72、96 h后每孔加入100 μl MTT液(5 g/L),继续培养4 h后,小心弃去上清液,加入100 μl DMSO液,振荡,待蓝紫色溶解后,在全自动酶标仪上测定吸光度(OD)值,计算各孔A570抑制率(%)=(1-实验OD值平均值/对照OD值平均值)×100%。 1.2.7 FCM检测转染VASH1
shRNA后U-87MG细胞的凋亡 采用Annexin-Ⅴ与PI双染流式细胞术检测细胞凋亡。6孔板细胞转染24、48、72、96 h后,加胰蛋白酶消化、收集。用PBS洗2次,加入100 μl Binding Buffer和FITC标记的Annexin-Ⅴ(20 μg/ml)10 μl,室温避光30 min,再加入PI(50 μg/ml)5 μl,避光反应5 min后,加入400 μl Binding Buffer,1 h内进行流式细胞术定量检测,同时以不加Annexin-Ⅴ/FITC及PI管作为阴性对照。
1.3 统计学方法应用统计学软件SPSS15.0进行数据分析,用t检验进行两组间差异比较,P<0.05为差异有统计学意义。
2 结果 2.1 VASH1 shRNA转染U-87MG细胞后对VASH1 mRNA表达的影响RT-PCR结果显示转染48、96 h时pGCL-GFP-VASH1组的条带亮度均显著低于其余各组,VASH1 mRNA表达抑制率为分别为58.27%、73.93%,与阴性对照组及空白对照组比较,差异均有统计学意义(P=0.000);阴性对照组与空白对照组比较差异无统计学意义(P=0.481),见图 1。
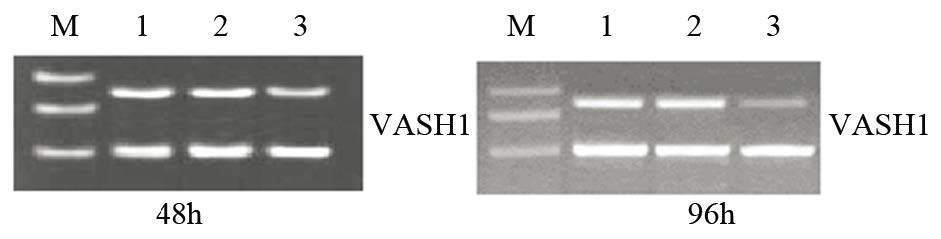
|
| 1: control group; 2: negative group; 3: pGCL-GFP-VASH1 group 图 1 RT-PCR检测VASH1 shRNA转染U-87MG细胞后VASH1 mRNA的表达 Figure 1 Expression of VASH1 mRNA in U-87MG cells transfected with VASH1 shRNA detected by RT-PCR |
结果显示转染48、96 h时pGCL-GFP-VASH1组VASH1蛋白的表达均明显受到抑制,与阴性对照组及空白对照组比较,差异均有统计学意义(P=0.000);阴性对照组和空白对照组VASH1蛋白的表达差异无统计学意义(P=0.527),见图 2。
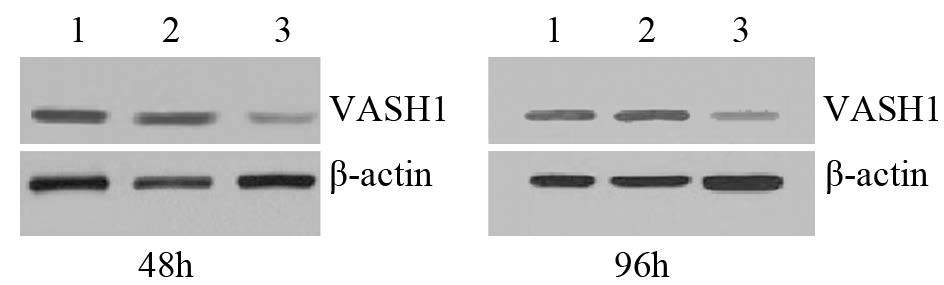
|
| 1: control group; 2: negative group; 3: pGCL-GFP-VASH1 group 图 2 Western blot检测VASH1 shRNA转染U-87MG细胞后VASH1蛋白的表达 Figure 2 Expression of VASH1 protein in U-87MG cells transfected with VASH1 shRNA detected by Western blot |
MTT法检测各组细胞的生长曲线结果表明:VASH1 shRNA稳定抑制VASH1的表达后U-87MG细胞增殖活性得到了明显的增强。pGCL-GFP-VASH1组与阴性对照组和空白对照组相比,在24 h时细胞的增殖活性差异均无统计学意义(P=0.416),超过48 h后pGCL-GFP-VASH1组细胞的增殖活性出现明显增强(P=0.000),最高抑制率出现在96 h;120 h时pGCL-GFP-VASH1组细胞的增殖活性出现下降,与阴性对照组与空白对照组相比差异无统计学意义(P=0.231)。阴性对照组与空白对照组相比,细胞的增殖活性差异无统计学意义(P=0.489),见图 3。
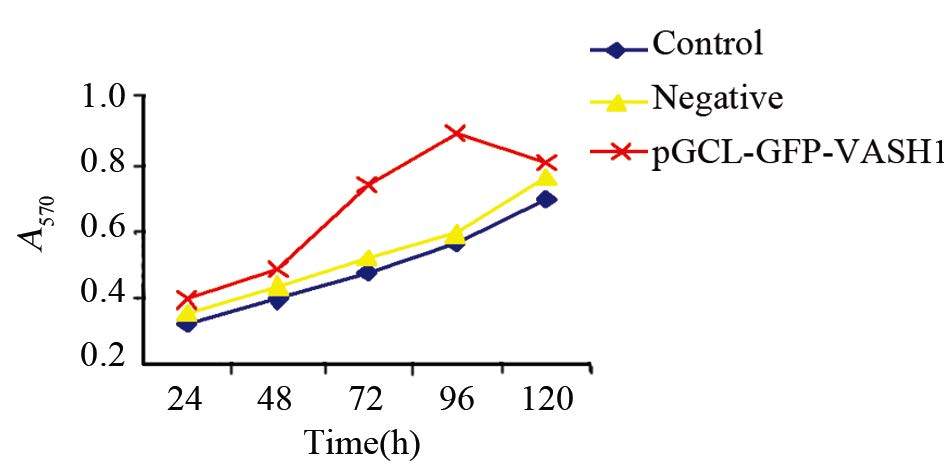
|
| 图 3 各组细胞在不同时间的MTT分析 Figure 3 MTT analysis of three groups at different time |
收集各组细胞,提取基因组DNA,观察DNA ladder的形成。FCM法检测显示,VASH1 shRNA稳定抑制VASH1的表达后U-87MG细胞的凋亡率明显下降,在96 h时的凋亡率(8.01±0.21)%与阴性对照组(22.32±0.80)%和空白对照组(27.48±0.41)%相比,差异有统计学意义(P=0.000);而阴性对照组与空白对照组之间的细胞凋亡率的差异无统计学意义(P=0.419),见图 4。
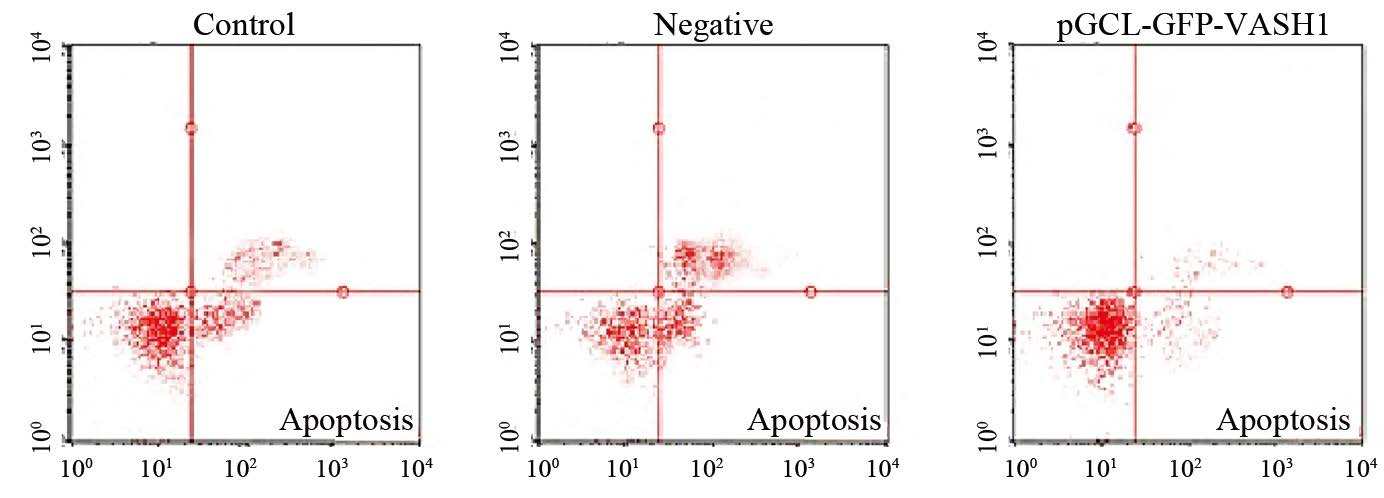
|
| 图 4 F C M 法检测转染9 6 h 时 VASH1 shRNA对U-87MG细胞凋 亡的影响 Figure 4 Effect of VASH1 shRNA on apoptosis of U-87MG cells detected by FCM at 96h |
VASH1属于血管生成抑制因子家族的一类血管生成调节蛋白,它能抑制血管内皮细胞增殖和新生血管网的形成,是第一个被发现的内皮细胞来源的对血管生成进行负反馈调节的因子[6]。VASH1作为内源性血管新生负性调节因子,不但能选择性地表达于内皮细胞,直接抑制内皮细胞的迁移、增生、内皮网及血管的形成,还能通过负反馈调节VEGF间接地抑制血管生成[7]。目前研究表明,VASH1通过抑制了血管新生的出芽阶段并参与血管新生的终止成熟阶段等两个方面发挥抑制肿瘤血管生成的作用[8]。
RNA干扰(RNA interference,RNAi)技术是双链RNA介导的、序列特异的转录后基因沉默现象,用于高效地降低或关闭特定基因的表达,为内源性功能基因研究和基因治疗提供了新的策略[9]。研究发现如果将siRNA直接或经重组表达质粒转入真核细胞,它只能产生短时间基因沉默效果。慢病毒载体作为近年来发展的一个新型导入siRNA的载体,可将目的基因有效输入到细胞核,可感染分裂和非分裂细胞并可整合到宿主的基因组,持续下调目的基因的表达,其基因转染效率高,细胞免疫反应小,并通过基因整合,稳定持久地产生短发卡RNA(shRNA)而发挥其关键的沉默效应[10]。
本研究针对人VASH1基因编码区设计了一条shRNA,以复制缺陷型慢病毒作为载体,构建了特异性干扰VASH1基因的慢病毒载体,并成功转染至人脑胶质瘤U-87MG细胞。经RT-PCR和Western blot分析证明在U-87MG细胞内VASH1在分子水平及蛋白水平的表达均得到明显的抑制。结果说明本研究构建的慢病毒RNA干扰表达载体在人脑胶质瘤U-87MG细胞内能稳定、高效、特异地抑制VASH1基因表达。
脑胶质瘤组织的增殖过程依赖于肿瘤新生血管的形成。VASH1在血管新生过程中有着重要的负反馈调节作用。在对宫颈癌标本的研究发现,血管内皮细胞中VASH1的表达随着组织学恶性程度的增加而增加,而且与随之变化的VEGFR2存在相关性[11]。本研究对VASH1 shRNA转染U-87MG细胞的细胞增殖能力进行检验,结果发现VASH1表达的抑制有促进U-87MG细胞增殖的趋势,提示VASH1可能通过抑制胶质瘤新生血管的形成来起到抑制胶质瘤发生、发展的作用,但其具体机制尚需要进一步研究。而本实验中还发现U-87MG细胞的凋亡率较阴性对照组和空白对照组明显下降,说明VASH1基因的缺失与人脑胶质瘤U-87MG细胞凋亡也密切相关。同时本研究结果表明VASH1 shRNA转染U-87MG细胞后在第48 h主要表现为早期凋亡细胞的减少,而96 h时晚期凋亡细胞也明显减少,说明VASH1 shRNA转染后在96 h出现VASH1的抑制高峰,其结果与RT-PCR、Western blot、MTT检测的结果相呼应。
综上所述,VASH1对人脑胶质瘤U-87MG细胞恶性生物学行为有明显的调控作用。这不仅为进一步明确人脑胶质瘤的发病机制提供了新的研究思路,也为临床利用VASH1作为判断肿瘤发生发展的分子标志物和抗肿瘤血管生成治疗的有效蛋白因子提供了理论依据。
| [1] | Kerbel RS. Tumor angiogenesis[J]. N Engl J Med, 2008, 358(19): 2039-49. |
| [2] | Watanabe K, Hasegawa Y, Yamashita H, et al. Vasohibinas an endothelium-derived negative feedback regulator of angiogenesis[J]. J Clin Invest, 2004, 114(7): 898-907. |
| [3] | Wang J, Liu ZC, Ma ZH, et al. The effect of VEGF, HIF-1a, Vasohibin in tumor angiogenesis of endometrioid aden ocarcinoma and its relation to prognosis[J]. Zhongguo Zu Zhi Hua Xue Yu Xi Bao Hua Xue Za Zhi, 2010, 19(1): 43-7. [王琚, 刘政操, 马志红, 等. VEGF、HIF-1α、Vasohibin在子宫内膜腺癌血管生成中的作用及与预后的关系[J]. 中国组织化学与细胞化学杂志, 2010, 19(1): 43-7.] |
| [4] | Zhao G, Yang Y, Tang Y, et a1. Reduced expression of vasohibin-1 is associated with clinicopathological features in renal cell carcinoma[J]. Med Oncol, 2012, 29(5): 3325-34. |
| [5] | Zhao H, Zhang JY, Xu WH, et al. Construction and identification of lentiviral vector for RNA interference targeting STUB1 gene[J]. Zhejiang Da Xue Xue Bao(Yi Xue Ban), 2010, 39(6): 623-7. [ 赵虹, 张惊宇, 徐万海, 等. STUB1基因RNA干扰慢病毒载体的构建与鉴定[J]. 浙江大学学报(医学版), 2010, 39(6): 623-7.] |
| [6] | Kerbel RS. Vasohibin: the feedback on a new inhibitor of angiogenesis[J]. J Clin Invest, 2004, 114(7): 884-6. |
| [7] | Shimizu K, Watanabe K, Yamashita H, et al. Gene regulation of a novel angiogenesis inhibitor, vasohibin, in endothelial cells[J]. Biochem Biophys Res Commun, 2005, 327(3): 700-6. |
| [8] | Hosaka T, Kimura H, Heishi T, et a1. Vasohibin-1 expression in endothelium of tumor blood vessels regulates angiogenesis[J]. Am J Pathol, 2009, 175(1): 430-9. |
| [9] | Zeng Z, Zhang C, Chen J. Lentivirus-mediated RNA interference of DC-STAMP expression inhibits the fusion and resorptive activity of human osteoclasts[J]. J Bone Miner Metab, 2013, 31(4): 409-16. |
| [10] | Liu L, Zhang N, Liu J, et al. Lentivirus-mediated siRNA interference targeting SGO-1 inhibits human NSCLC cell growth[J]. Tumour Biol, 2012, 33(2): 515-21. |
| [11] | Yoshinaga K, Ito K, Moriya T, et al. Roles of intrinsic angiogenesis inhibitor, vasohibin, in cervical carcinomas[J]. Cancer Sci, 2011, 102(2): 446-51. |
 2016, Vol. 43
2016, Vol. 43
