文章信息
- 刘君,肖扬,郭建雄,魏巍,黄小红,张荣侠,吴宜嘉,周娟.
- LIU Jun, XIAO Yang, GUO Jianxiong, WEI Wei, HUANG Xiaohong, ZHANG Rongxia, WU Yijia, ZHOU Juan.
- 奥沙利铂联合替吉奥和吉西他滨联合顺铂治疗晚期三阴性乳腺癌的疗效和不良反应比较
- Clinical Efficacy and Toxicities of Oxaliplatin plus S-1(SOX) and Gemcitabine plus Cisplatin (GP) Regimens on Advanced Triple-negative Breast Cancer Patients
- 肿瘤防治研究, 2016, 43(01): 72-77
- Cancer Research on Prevention and Treatment, 2016, 43(01): 72-77
- http://www.zlfzyj.com/CN/10.3971/j.issn.1000-8578.2016.01.016
-
文章历史
- 收稿日期: 2015-03-24
- 修回日期: 2015-10-13
三阴性乳腺癌(triple-negative breast cancer,TNBC)是指雌激素受体(estrogen receptor,ER)、孕激素受体(progesterone receptor,PR)及人表皮生长因子受体2(human epidermal growth factor receptor2,HER2)均为阴性的乳腺癌[1],是一种特殊的乳腺癌亚型,约占乳腺癌的12%~24%[2]。这类乳腺癌有着侵袭性强、复发风险高、5年生存率低、预后差的特点[3]。由于内分泌治疗不敏感和缺乏抗HER2治疗的靶点,所以目前针对晚期TNBC的治疗手段主要是化疗,但是目前还没有针对三阴性乳腺癌的治疗指南。传统的单药或联合化疗是TNBC治疗中的重要治疗手段,尤其是以蒽环类和紫杉类药物为基础的化疗方案显示出一定的疗效[4],但是有研究表明蒽环类化疗药物并不能改善TNBC患者的预后[5],如何能提高晚期三阴性患者的生存是近几年乳腺癌领域的研究热点。Sarohi等[6]报道,TNBC对于铂类药物较为敏感。顺铂可引起链间和链内交联,影响修复及触发细胞凋亡,吉西他滨(GEM)是一种嘧啶类抗代谢药,最新研究表明这两种药物联合可增强细胞毒作用,或可作为晚期三阴性乳腺癌一线化疗的首选策略[7]。奥沙利铂(OXA)作为第三代铂类药物,与顺铂和卡铂具有不完全交叉耐药,且奥沙利铂与氟尿嘧啶(5-Fu)具有协同作用,即使对氟尿嘧啶耐药的患者也有效[8]。氟尿嘧啶是治疗乳腺癌的常用药物之一,替吉奥(S-1)是一种口服的氟尿嘧啶类抗肿瘤药,疗效明显优于替加氟(FT)、5-Fu[9] 。国外研究[10]显示替吉奥单药治疗乳腺癌疗效高,不良反应小,耐受性好。我们尝试分别应用奥沙利铂联合替吉奥(SOX方案)和吉西他滨联合顺铂(GP方案)治疗晚期三阴性乳腺癌患者,取得了满意的效果,现报告如下。
1 资料与方法 1.1 资料收集2011年1月—2013年9月泰兴市人民医院收治均经病理学及免疫组织化学检查证实的晚期女性三阴性乳腺癌患者。入选标准:临床分期为Ⅳ期,不适合行根治性手术或术后转移病例;同意接受抗癌化学药物治疗;均有客观可测量的转移病灶(体检、B型超声、CT、MRI);体力状况(KPS)评分≥70分,预计生存期超过3月;心肺肾功能正常,白细胞>3.5×109/L、中性粒细胞计数>1.5×109/L、血小板计数>75×109/L时,肝功能<正常值1.5倍范围,心电图基本正常;无外周神经疾病;既往未使用奥沙利铂、替吉奥、吉西他滨和顺铂,1月内未应用其他化疗药物;均签署抗癌药物治疗知情同意书。符合入选标准的患者随机分为SOX组和 GP组接受化疗。治疗方法: SOX组:奥沙利铂(艾恒:江苏恒瑞医药股份有限公司)135 mg/m2,加入5%葡萄糖注射液500 ml,静脉滴注,2 h,第1天;替吉奥胶囊(维康达:山东新时代药业有限公司):40~60 mg(<1.25 m2,40 mg;1.25~1.5 m2,50 mg;>1.5 m2,60 mg),于早、晚饭后口服,连服14天。GP组:吉西他滨1000 mg/m2,加入0.9%氯化钠注射液 100 ml,静脉滴注,30 min,第1、8天;顺铂75 mg/m2,分3天,加入0.9%氯化钠注射液500 ml,静脉滴注。两组均21天为1周期,每2周期评价疗效,有效及稳定患者继续化疗,最长不超过6周期,进展者更换其他方案,骨转移患者同时应用双磷酸盐治疗,脑转移者加颅脑局部放疗。所有患者化疗前常规给予5-羟色胺3受体拮抗剂预防呕吐反应,同步保肝、护胃治疗;化疗后如有白细胞、血小板减少分别给予粒细胞集落刺激因子、白介素-11治疗。如果每一周期化疗前白细胞<3.5×109/L或中性粒细胞计数<1.5×109/L或血小板计数<75×109/L时,则延迟化疗;如果出现4度骨髓抑制、3度以上周围神经毒性,下一周期化疗药物剂量减少25%。
1.2 疗效评估及随访治疗前后检查三大常规、肝肾功能、血糖、心电图、肿瘤指标,治疗过程中每周复查血常规1~2次,详细记录KPS评分、体重变化。所有患者至少完成2周期化疗,每2周期评价疗效。疗效评价参考实体瘤的疗效评价标准(RECIST标准3),分为完全缓解(complete remission,CR)、部分缓解(partial remission,PR)、稳定(stable disease,SD)及进展(progressive disease,PD)。总有效率(response rate,RR)根据CR与PR病例数之和计算,疾病控制率(disease control rate,DCR)根据CR、PR与SD病例数之和计算。不良反应按美国癌症研究所常见毒性判定标准(NCI-CTC)(3.0版)抗癌药物毒性评价标准分为0~Ⅳ级。无进展生存时间(progress free survival,PFS)定义为开始接受SOX、GP方案化疗至疾病进展或死亡的时间。总生存时间(overall survival,OS)为自第一次行SOX、GP化疗开始至死亡或末次随访的时间。采用电话与信件相结合的方式进行随访,随访截止时间为2014年12月31月。
1.3 统计学方法应用SPSS19.0统计软件进行分析,应用Kaplan-Meier统计无进展生存时间和中位生存时间,Log rank检验,检验水准P=0.05。
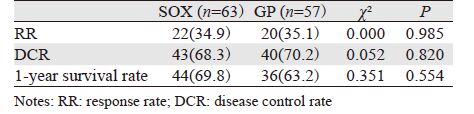
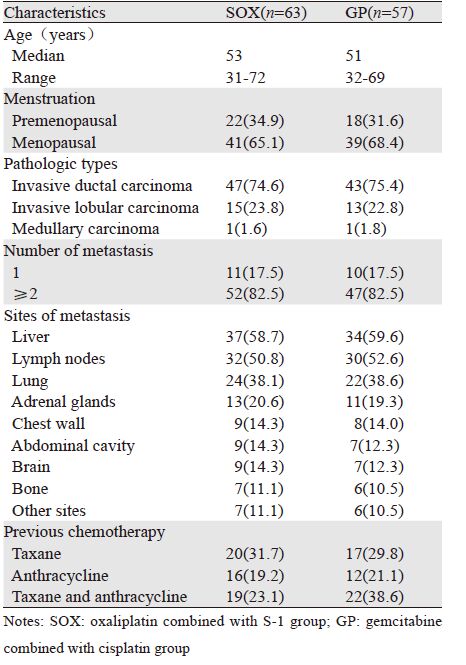
2 结果 2.1 患者临床资料根据入选标准共120例患者纳入本研究,其中SOX组63例,GP组57例,两组在年龄、月经情况、病理类型、转移灶数目、转移部位、既往治疗情况等方面差异无统计学意义(P>0.05),见表 1。
 |
SOX组63例患者共接受264周期的化疗,最少2周期,最长6周期,中位为4周期。18例患者因化疗毒性而延迟治疗,延迟时间均小于7天,9例患者因化疗毒性而减少化疗药物剂量。GP组57例患者共接受246周期的化疗,最少2周期,最长6周期,中位为4周期。15例患者因化疗毒性而延迟治疗,延迟时间均小于7天,11例患者因化疗毒性而减少化疗药物剂量。两组患者无病例因不良反应终止治疗,无治疗相关死亡,全部可评价疗效。
2.3 近期疗效随访截至2014年12月31日,中位随访时间26.5(3.6~48.0)月,SOX组失访2例,GP组失访1例。120例患者均可评价疗效,RR为35.0%,DCR为69.2%。SOX组与GP组CR分别为3例(4.8%)与3例(5.3%),PR分别为19例(30.2%)与17例(29.8%),SD分别为21例(33.3%)与20例(35.1%),PD分别为20例(31.7%)与17例(29.8%),差异均无统计学意义(P>0.05)。SOX组与GP组的RR分别为34.9%与35.1%,DCR为68.3%与70.2%,差异均无统计学义(P>0.05),见表 2。
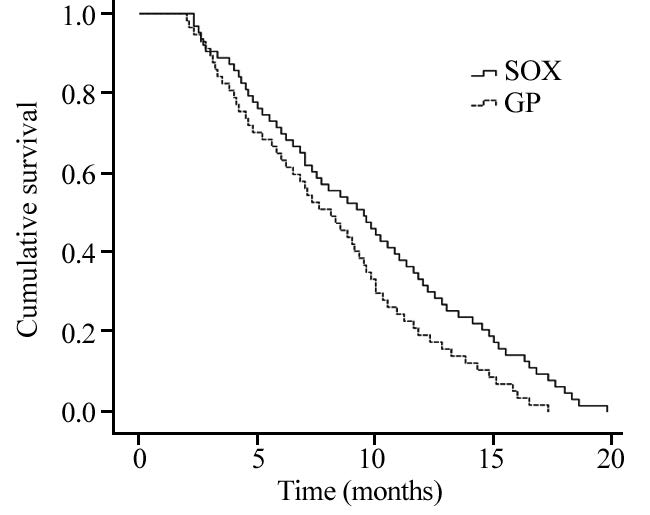
SOX组患者的疾病进展时间(time to progression,TTP)为2.3~19.8月,中位TTP为9.5月(95%CI:7.3~11.7),1年生存率为69.8%,OS为4.3~40月,中位OS为19.5月(95%CI:16.5~22.5);GP组患者的TTP为2.0~17.3月,中位TTP为8.1月(95%CI:6.2~10.0),1年生存率为63.2%,OS为4.1~34.5月,中位OS为18.7月(95%CI:16.6~20.8)。两组1年生存率差异无统计学意义(P=0.554),见表 2;SOX组中位TTP较GP组延长1.4月,差异有统计学意义(P=0.033),见图 1;中位OS延长0.8月,差异无统计学意义(P=0.207),见图 2。
|
| 图 1 SOX组与GP组患者无进展生存期Kaplan-Meier曲线 Figure 1 Kaplan-Meier curves of progression free survival of SOX and GP group |
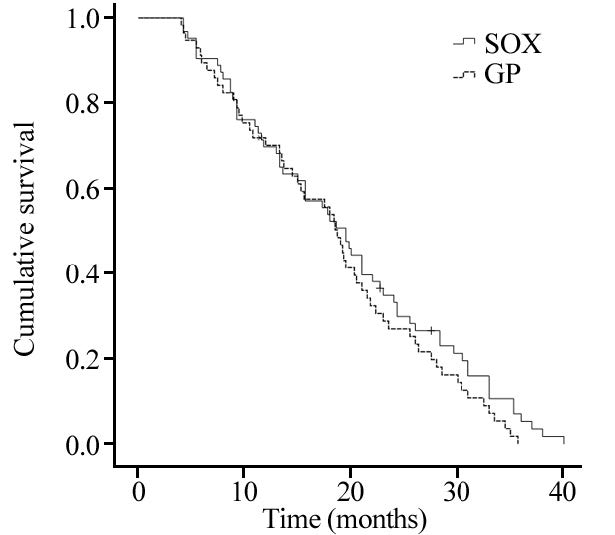
|
| 图 2 SOX组与GP组患者总生存期Kaplan-Meier曲线 Figure 2 Kaplan-Meier curves of overall survival of SOX and GP group |
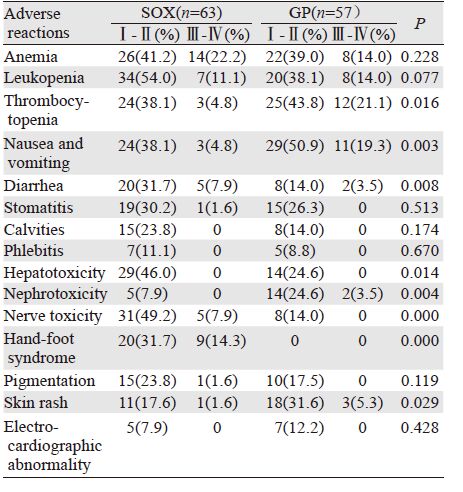
常见的不良反应为血液学毒性、外周神经毒性、胃肠反应、肝肾功能损害、外周神经毒性、手足综合征等。其中腹泻、肝功能损害、外周神经毒性、手足综合征发生率SOX组(39.6%、46.0%、14.0%、46.0%)明显高于GP组(17.5%、24.6%、57.1%、0),且差异有统计学意义(P=0.008、0.014、0.000、0.000);血小板减少、恶心/呕吐、肾毒性、皮疹发生率GP组(64.9%、70.2%、28.1%、36.9%)明显高于SOX组(42.9%、42.9%、7.9%、19.2%),且差异有统计学意义(P=0.016、0.003、0.004、0.029);贫血、白细胞减少、口腔黏膜炎、脱发、静脉炎、色素沉着、心电图改变两组发生率比较差异无统计学意义(P>0.05),见表 3。
根据三阴性乳腺癌基因表达特征、生物学功能和临床疗效,可以将三阴性乳腺癌分为5种亚型,即基底细胞样型(basal-like TNBC)、管腔型(Luminal TNBC)、间叶细胞样型(mesenchymal-like TNBC)、免疫相关型(immune-associated TNBC)、HER2过表达型(HER2 enriched TNBC)[11]。Basal-1ike型乳腺癌用免疫组织化学染色ER、PR、HER2阴性、表皮生长因子受体(EGFR)和细胞角蛋白CK5/6阳性来定义。而TNBC是一个异质性群体,与Basal-1ike型乳腺癌和BRCA-1相关性乳腺癌有很大程度的相关性,超过75%的TNBC归于Basal-1ike型乳腺癌[3],另有报道称有50%~87%的TNBC为BRCA-l突变相关乳腺癌 [12]。TNBC具有独特的生物学特征:(1)肿瘤体积较大,病理类型几乎均为导管癌,组织学分级较高。(2)肿瘤细胞多表达basal细胞角蛋白(CK5/6、CKl7)、EGFR和p53等,较少表达雄激素受体、E-钙黏蛋白和cyclin D。(3)与其他类型乳腺癌相比,较早发生局部复发和远处转移,复发高峰时期多在首次治疗后3年内[13],死亡主要发生在5年内[14],内脏转移率高于骨转移,易发生脊髓、脑、肝和肺转移,预后较差[15]。(4)不良预后因素多。三阴性本身是乳腺癌预后差的一个重要因素[16]。国内外多项研究均提出p53突变与乳腺癌的预后不良有关[17, 18],p53变异可导致蒽环类[19]和铂类耐药[20]。淋巴结的转移状况也是影响TNBC患者预后的重要因素。Hernandez-Aya等[21]的研究表明TNBC腋淋巴结有转移者的生存率要显著低于无癌转移者。周秋锋等[22]研究认为腋淋巴结转移灶中ER、PR、HER2的表达是否与原发灶一致是TNBC的独立危险因素。
TNBC对内分泌治疗及抗HER2治疗无效,但是较其他类型的乳腺癌对化疗更加敏感[23]。Keam等[24]对145例Ⅱ~Ⅲ期乳腺癌患者进行新辅助化疗,结果显示,47例TNBC患者的反应率和病理完全缓解率分别为为83.0%和17.0%,而非TNBC患者分别为62.2%和3.1%,差异均有统计学意义(P均<0.05)。由于多数三阴性乳腺癌患者存在BRCA1缺失或变异,BRCA1相关乳腺癌对能破坏DNA结构的药物非常敏感,例如铂类药物、烷化剂等[25]。目前有很多铂类应用于TNBC的临床试验,并证明了TNBC对铂类的敏感度较高。Yi等[26]报道TNBC患者经铂类药物治疗后pCR率为23%~90%,高于经蒽环类和紫杉醇类药物序贯化疗方案的19%~34%。Sirohi等[6]以含铂类化疗方案治疗328例乳腺癌,结果显示,病例完全缓解率TNBC较非TNBC高(88% vs. 51%),5年总生存率TNBC较低(64% vs. 85%),5年无病生存率也较低(57% vs. 72%),对于晚期的TNBC患者总生存率为4l%,而非TNBC为3l%,化疗所延长的无进展生存期TNBC为6月,非TNBC为4月,由以上试验可见铂类对于TNBC较非TNBC敏感。
吉西他滨是一种核苷类抗代谢药,其代谢物主要通过干扰DNA链的合成和耗尽脱氧核苷酸抑制DNA的合成,最终导致吉西他滨诱导的细胞凋亡,具有独特的抗肿瘤活性[27]。多个研究结果表明GEM对晚期乳腺癌有较高的疗效,由于其独特的作用机制与蒽环类和紫杉类无交叉耐药,可作为解救治疗,有研究表明在蒽环类或紫杉类治疗失败后的二线或三线化疗的有效率为29%[28]。而DDP联合GEM化疗会有更好的疗效,可增强细胞毒作用,并改善顺铂耐药[29]。
国内康马飞等[30]予多西他赛联合奥沙利铂治疗耐蒽环类药转移性乳腺癌,有效率为92.9%,耐受性好。国外一项关于卡培他滨和替吉奥在转移性胃癌中应用的Ⅱ期临床试验结果显示,两者临床效果没有明显差异,但卡培他滨更易发生手足综合征和口角炎[31]。卡培他滨在转移性乳腺癌患中的疗效已被临床试验证实[32],而替吉奥是第三代氟尿嘧啶衍生物,含有替加氟(FT)和两种生化修饰剂——吉美嘧啶(CDHP)及奥替拉西(OXO)。FT在肝脏线粒体内生成5-Fu,CDHP选择性抑制5-Fu分解代谢酶-二氢嘧啶脱氢酶(DPD),有助于延长血浆和肿瘤组织中5-Fu有效浓度,从而取得优于5-Fu持续静脉输注的疗效,但无静脉给药所致的静脉炎等并发症,由于OXO的加入,替吉奥的非血液学不良反应明显降低[33]。自1999年在日本上市以来有大量研究显示,其疗效良好,不良反应较小[34, 35]。Shien等[36]报道替吉奥用于晚期乳腺癌三线或以上治疗,37例患者中获PR 1例,SD 2例,中位疾病进展时间84天。一项日本的研究显示RR达到27.8%,PFS为6.2月,OS达到19.2月[37]。并有研究报道[38]替吉奥3周方案单药治疗老年乳腺癌患者16例,获得满意效果,RR为31.3%,中位PFS 、OS分别为5.1、17.9月。
以上多个国内外的研究表明,替吉奥、奥沙利铂、吉西他滨、顺铂均为多线治疗晚期乳腺癌及三阴性乳腺癌的有效单药,在此基础上本研究分别采用奥沙利铂联合替吉奥、吉西他滨联合顺铂治疗120例晚期三阴性乳腺癌患者,RR为35.0%,DCR为69.2%,TTP为8.5月(95%CI: 7.0~10.0),MOS为18.7月(95%CI: 17.1~20.3)。两种方案均取得了较好的疗效,总有效率、疾病控制率差异无统计学意义(P>0.05),SOX组中位OS较GP组有延长趋势(0.8月),但差异无统计学意义(P=0.207),而中位TTP延长1.4月,差异有统计学意义(P=0.033),SOX组显示出一定的优势。考虑到铂类药物敏感度得益于TNBC患者的BRCAl基因突变,而本研究未对患者进行BRCAl基因检测,不明确两组疗效差异是否与突变率不同有关,仍有待进一步研究。另外由于入选病例数偏少,未能就具体不同转移部位、病理类型患者生存期行进一步分析。
化疗在乳腺癌、尤其是晚期乳腺癌患者中的作用得到了肯定,在关注患者疗效的同时,患者的化疗不良反应及生存质量亦不容忽视。两组常见的不良反应包括血液学毒性、外周神经毒性、胃肠反应、肝肾功能损害、外周神经毒性、手足综合症等。两种方案不良反应的总体发生率相似,且经对症治疗后均可耐受,与多数文献报道一致。
总之,对于TNBC目前尚无统一的治疗标准,本研究提示采用奥沙利铂联合替吉奥、吉西他滨联合顺铂方案治疗晚期三阴性乳腺癌均安全、有效,不良反应耐受。由于本研究病例数较少,且为单中心分析,入选患者可能存在选择性偏倚,目前国内外缺乏相关报道,晚期三阴性乳腺癌的标准化疗方案的确立仍然要大样本前瞻性的临床研究证实,而结合分子生物学检测进行个体化治疗也许是今后的研究方向之一。
| [1] | Vrdoljak E,Mise BP,Lukic B, et al. Long-lasting control of triple-negative metastatic breast cancer with the novel drug combination ixabepilone and capecitabine-case report[J]. Onkologie,2010,33(1-2): 53-6. |
| [2] | Rakha EA,Ellis IO. Triple-negative/basal-like breast carncer:review[J]. Pathology,2009,41(1): 40-7. |
| [3] | Rastelli F,Biancanelli S,Falzetta A, et al. Triple-negative breast cancer:current state of the art[J]. Tumor,2010,96(6): 875-88. |
| [4] | Rastogi P,Anderson SJ,Bear HD, et al. Preoperative chemotherapy: updates of National Surgical Adjuvant Breast and Bowel Project Protocols B-18 and B-27[J]. J Clin Oncol,2008,26(5): 778-85. |
| [5] | Tan DS,Marchió C,Jones RL, et al. Triple negative breast cancer:molecular profiling and Prognostic impact in adjuvant anthracycline-treated patients[J]. Breast Cancer Res Treat,2007,111(1): 27-44. |
| [6] | Sirohi B,Arnedos M,Popat S, et al. Platinum-based chemotherapy in triple-negative breast cancer[J]. Ann Oncol,2008,19(11): 1847-52. |
| [7] | Hu XC,Zhang J,Xu BH, et al. Cisplatin plus gemcitabine versus paclitaxel plus gemcitabine as first-line therapy for metastatic triple-negative breast cancer (CBCSG006):a randomised,open-label,multicentre,phase 3 trial[J]. Lancet Oncol,2015,16(4): 436-46. |
| [8] | Qin SK,Gong XL. Chemotherapy of advanced gastric carcinoma: current and prospect[J]. Lin Chuang Zhong Liu Xue Za Zhi,2006,11(9): 642-52. [秦叔逵, 龚新雷. 晚期胃癌化疗的现状和新进展[J]. 临床肿瘤学杂志,2006,11(9): 642-52.] |
| [9] | Yuan Q. Clinical observation of 27 cases of nasopharynx cancer treated with HU,FT-207 and CF[J]. Zhongguo Yi Yao Dao Bao,2007,4(20): 54-5. [袁泉. 羟基脲、替加氟及亚叶酸钙治疗27例晚期鼻咽癌临床观察[J]. 中国医药导报,2007,4(20): 54-5.] |
| [10] | Hara F,Kiyoto S,Takahashi M, et al. Efficacy and safety of S-1 in patients with metastatic breast cancer[J]. Oncology,2010,79(3-4): 273-7. |
| [11] | Le Du F,Eckhardt BL,Lim B, et al. Is the future of personalized therapy in triple-negative breast cancer based on molecular subtype?[J]. Oncotarget,2015,6(15): 12890-908. |
| [12] | Zhang L,Fang C,Xu X, et al. Androgen receptor,EGFR,and BRCA1 as biomarkers in triple-negative breast cancer: a meta-analysis[J].Biomed Res Int,2015,2015: 357485. |
| [13] | Fornier M,Fumoleau P. The paradox of triple-negative breast cancer:novel approaches to treatment[J]. Breast J,2012,18(1): 41-51. |
| [14] | De Laurentiis M,Cianniello D,Caputo R, et al. Treatment triple negative breast cancer:current options and future perspectives[J].Cancer Treat Rev,2010,36(Suppl 3): S80-6. |
| [15] | Rakha EA,EI-Sayed ME,Green AR, et al. Prognostic markers in triple-negative breast cancer[J]. Cancer,2007,109(1): 25-32. |
| [16] | Rhee J,Han SW,Oh DY, et al. The clinicopathologic characteristics and prognostic significance of triple-negativity in node-negative breast cancer[J]. BMC Cancer,2008,8: 307. |
| [17] | Dookeran KA,Dignam JJ,Ferrer K, et al. P53 as a marker of prognosis in African-American women with breast cancer[J]. Ann Surg Oncol,2010,17(5): 1398-405. |
| [18] | Chae BJ,Bae JS,Lee A, et al. P53 as a specific prognostic factor in triple-negative breast cancer[J]. Jpn J Clin Oncol,2009,39(4): 217-24. |
| [19] | Knappskog S,Berge EO,Chrisanthar R, et al. Concomitant inactivation of the p53- and pRB- functional pathways predicts resistance to DNA damaging drugs in breast cancer in vivo[J]. Mol Oncol,2015,9(8): 1553-64. |
| [20] | Xu ZQ,Zhang Y,Li N, et al. Correlation between curative efficacy of post-operative platinum-based chemotherapy and ERCC1 and P53 protein expression in NSCLC: A retrospective analysis[J]. Zhongguo Xian Dai Yi Sheng,2010,48(21): 36-9. [徐志巧, 张燕, 李宁, 等. NSCLC术后铂类药物辅助化疗疗效与ERCC1和P53蛋白表达的分析[J]. 中国现代医生,2010,48(21): 36-9.] |
| [21] | Hernandez-Aya LF,Chavez-Macgregor M,Lei X, et al. Nodal status and clinical outcomes in a large cohort of patients with triple-negative breast cancer[J]. J Clin Oncol,2011,29(19): 2628-34. |
| [22] | Zhou QF,Yue SL,Wu HM, et al. A study on the ER,PR and Her-2 expression statuses between primary lesion and metastatic axillary lymph nodes of TNBC[J]. Shi Yong Zhong Liu Xue Za Zhi,2013,27(1): 54-9. [周秋锋, 岳双磊, 吴红梅, 等. TNBC原发灶与腋淋巴结转移灶中ER、PR、Her-2的表达变化与预后的相关性[J]. 实用肿瘤学杂志,2013,27(1): 54-9.] |
| [23] | Yadav BS,Sharma SC,Chanana P, et al. Systemic treatment strategies for triple-negative breast cancer[J]. World J Clin Oncol,2014,5(2): 125-33. |
| [24] | Keam B,Im SA,Kim HJ, et al. Prognostic impact of clinicopathologic parameters in stage Ⅱ/Ⅲ breast cancer treated with neoadjuvant docetaxel and doxombicin chemotherapy:paradoxical features of the triple negative breast cancer[J]. BMC Cancer,2007,7: 203. |
| [25] | Turner N,Tutt A,Ashworth A. Targeting the DNA repair defect of BRCA tumours[J]. Curr Opin Pharmacol,2005,5(4): 388-93. |
| [26] | Uhm JE,Park YH,Yi SY, et al. Treatment outcomes and clinicopathologic characteristics of triple-negative breast cancer patients who received platinum-containing chemotherapy[J].Int J Cancer,2009,124(6): 1457-62. |
| [27] | Wei MY,Zhuang YF,Wang WM. Gemcitabine for the treatment of patients with osteosarcoma[J]. Asian Pac J Cancer Prev,2014,15(17): 7159-62. |
| [28] | Brodowicz T,Kostler WJ,M?slinger R, et al. Single-agent gemeitabine as secondline and third-line treatment in metastatic breast cancer[J]. Breast,2000,9(6): 338-42. |
| [29] | Silver DP,Richardson AL,Eklund AC, et al. Efficacy of neoadjuvant Cisplatin in triple-negative breast cancer[J]. J Clin Oncol,2010,28(7): 1145-53. |
| [30] | Kang MF,Jiang HJ,Wang SK, et al. Efficacy of docetaxel combined with oxaliplatin by different administration routes in treatment of anthracycline-resistant metastatic breast cancer[J]. Zhongguo Zhong Liu Lin Chuang Yu Kang Fu,2005,12(6): 527-9. [康马飞, 蒋河君, 王世坤, 等. 多西紫杉醇联合奥沙利铂治疗耐蒽环类药转移性乳腺癌疗效分析[J]. 中国肿瘤临床与康复,2005,12(6): 527-9.] |
| [31] | Lee JL,Kang YK,Kang HJ, et al. A randomised multicentre phase II trial of capecitabine vs S-1 as first-line treatment in elderly patients with metastatic or recurrent unresectable gastric cancer[J]. Br J Cancer,2008,99(4): 584-90. |
| [32] | Lam SW,de Groot SM,Honkoop AH, et al. Paclitaxel and bevacizumab with or without capecitabine as first-line treatment for HER2-negative locally recurrent or metastatic breast cancer: a multicentre,open-label,randomised phase 2 trial[J]. Eur J Cancer,2014,50(18): 3077-88. |
| [33] | Shirasaka T,Tsukuda M,lnuyama Y, et al. New oral anticancer drug,TS-1(S-1)-from bench to clinic[J]. Gan To KagaKu Ryoho,2001,28(6): 855-64. |
| [34] | Koizumi W,Narahara H,HaraT, et al. S-1 plus cisplatin versus S-1 alone for first-line treatment of advanced gastric cancer[J]. Lancet Oncol,2008,9(3): 215-21. |
| [35] | Boku N. Chemotherapy for rnetastatic disease:review from JCOG trials[J]. Int J Clin Oncol,2008,13(3): 196-200. |
| [36] | Shien T,Shimizu C,Akashi-Tanakal S, et al. Clinical efficacy of S-1 in pretreated metastatic breast cancer patients[J]. Jpn J Clin Oncol,2008,38(3): 172-5. |
| [37] | Yamamoto D,Iwase S,Yoshida H, et al. Efficacy of S-1 in patients with capecitabine-resistant breast cancer-Japan Breast Cancer Research Network (JBCRN)04-1 trial[J]. Anticancer Res,2010,30(9): 3823-31. |
| [38] | Fujii K,Kosaka J,Mouri Y, et al. Chemotherapy of a 2-week S-1 administration followed by l-week rest for advanced and metastatic breast cancer[J]. Gan To Kagaku Ryoho,2011,38(9): 1467-70. |
 2016, Vol. 43
2016, Vol. 43