文章信息
- 张瑾,李红霞.
- ZHANG Jin, LI Hongxia.
- 应用iTRAQ多重化学标记串联质谱技术筛选晚期卵巢浆液性腺癌组织中卡铂耐药相关蛋白
- Screening of Potential Proteins Associated with Carboplatin-resistance in Advanced Ovarian Serous Adenocarcinoma Tissues Using iTRAQ Technology
- 肿瘤防治研究, 2016, 43(01): 58-62
- Cancer Research on Prevention and Treatment, 2016, 43(01): 58-62
- http://www.zlfzyj.com/CN/10.3971/j.issn.1000-8578.2016.01.013
-
文章历史
- 收稿日期: 2015-03-16
- 修回日期: 2015-06-15
卵巢癌在女性生殖系统肿瘤中死亡率居首位,目前虽有标准治疗方案使多数患者达到临床缓解,但化疗耐药性仍是导致治疗失败的主要原因。如何筛选出可能耐药的患者,预测化疗耐药性并进行个体化治疗将是未来的治疗目标。目前,生命科学领域的研究已经进入后基因组时代,蛋白质组学概念的提出为筛选卵巢癌耐药相关蛋白提供了新的途径。同位素标记相对和绝对定量(isobaric tag for relative and absolute quantitation,iTRAQ)技术是一种新的基于串联质谱方法的蛋白质组学定量技术,可同时对4~8种血清、组织或细胞裂解液等样本进行绝对和相对定量研究。iTRAQ技术作为一种理想的寻找生物标记的技术,已被应用于卵巢癌等肿瘤中以筛选肿瘤标志物[1, 2]。
三磷酸腺苷肿瘤药物敏感度检测(adenosine triphosphate-tumor chemosensitivity assay,ATP-TCA)是一种近年来探索的敏感、稳定的药敏检测方法,与临床结果有很高的相关性和一致性,可以很好地预测肿瘤细胞在体内对于化疗药物的敏感程度[3]。本研究旨在利用ATP-TCA体外药敏试验,从具有相同病理类型、分期及分化的卵巢癌标本中筛选出对卡铂敏感/耐药的标本,通过iTRAQ技术寻找与铂类耐药有关的卵巢癌耐药差异蛋白。
1 资料与方法 1.1 一般资料收集2013年3月至2013年11月Ⅲ期原发低分化卵巢浆液性腺癌标本45例,均由病理证实。所有标本均为手术中即时取材,一部分进行ATP-TCA药敏试验;一部分液氮冷冻后置入-80℃冰箱保存。标本的采集均经本院伦理委员会批准和患者本人或家属的知情同意。
1.2 ATP-TCA药敏试验按照文献报道对所有标本进行ATP-TCA药敏试验[3]。结果分析采用IC50、IC90(分别达到50%及90%抑制率的药物浓度)、敏感度指数(sensitive index,SI)作为参数,SI的计算方法为500%-5个检测药物浓度对应的肿瘤细胞生长抑制率(tumor growth inhibition,TGI)之和[这5个浓度分别为200%、100%、50%、25%和12.5%的药物血浆峰值浓度(peak plasma concentration,PPC)]。判定标准:敏感:IC50≤25% PPC;轻度敏感:IC90≤100% PPC且IC50≥25% PPC或SI≤250;耐药:SI>250。
1.3 iTRAQ试验 1.3.1 研究资料根据ATP-TCA试验结果,按照对卡铂的敏感程度分为三组:敏感组15例;轻度敏感组13例;耐药组17例。为能更好筛选出耐药相关蛋白并保证结果的一致性,选取同样例数、敏感度与耐药性差异明显的标本进行试验,故弃去轻度敏感组,选取敏感组及耐药组各15例进行后续试验。
1.3.2 试验步骤(1)蛋白质提取:卡铂敏感组15例标本,均取100 μg混合剪碎,加入液氮及预冷的TCA-冰丙酮研磨,4℃ 20 000 g离心30 min,重复3次。在沉淀中加入裂解液,20 000 g离心30 min,取上清液。加入二硫苏糖醇(DTT)及碘代乙酰胺(IAM)至终浓度55 mmol/L,暗室静置1 h。加入预冷丙酮,4℃ 20 000 g离心30 min,取沉淀加入缓冲液,4℃ 20 000 g离心30 min,取上清液。使用bradford法对蛋白进行定量。卡铂耐药组15例标本,处理方法同敏感组。
(2)肽段的标记:每个样品取100 μg蛋白,加入3.3 μg浓度为1 μg/μl胰酶,37℃水浴24 h,然后补加1 μg胰酶,37℃水浴12 h。冻干消化液,然后使用TEAB(水:TEAB=1:1)每管30 μl复溶肽段。每组蛋白样品各加入70 μl异丙醇,将不同大小的同位素标记试剂与对应样品混合(标记试剂113与114分别对应卡铂敏感标本和卡铂耐药标本),室温静置2 h后真空抽干标记后样品。
(3)高效液相色谱(HPLC)及质谱检测:标记后样本用A液(25%乙腈,10 mmol/L KH2PO4,磷酸调pH值至3.0)稀释10倍,调溶液pH值为3.0,15 000 g离心10 min,取上清液。将A液和B液(25%乙腈,2 mol/L KCl,10 mmol/L KH2PO4,磷酸调pH值至3.0)加入强阳离子交换柱泵中,调整压力平衡后上样,采用逐步提高阳离子浓度的梯度洗脱。洗脱HPLC柱后加入0.1%甲酸复溶肽段。使用Q-Exactive 质谱仪检测肽段信号。
(4)蛋白质定性与定量分析:质谱扫描后将质谱图输入到PD(Proteome Discoverer 1.3,thermo)软件。PD提取谱图用Mascot软件进行搜索,搜索结束后,PD软件根据Mascot搜索结果和第一步筛选后的谱图进行定量分析。取直接比值>1.2倍且P<0.05为差异蛋白。
(5)生物信息分析:质谱鉴定数据结果采用BLAST比对查找相似序列。功能和定位可以在GO(Gene Ontology)蛋白数据库中查询,选择GO的生物过程、细胞成分和分子功能注释对蛋白进行聚类分析,依据聚类分析的结果进行绘图,得到鉴定蛋白的GO聚类分析图。蛋白的信号通路分析采用日本基因组KEGG数据库对蛋白所涉及的通路进行分类和富集分析。
2 结果 2.1 质谱鉴定结果共鉴定出iTRAQ标记定量信息有显著差异(P<0.05)的蛋白755个。在Ⅲ期原发卵巢上皮浆液性癌标本中,卡铂耐药组与卡铂敏感组相比,上调1.2倍以上、1.5倍以下的差异蛋白有340个;上调1.5 倍以上的有89个;下调0.83倍以下、0.66倍以上的差异蛋白有280个;下调0.66倍以下的有46个。
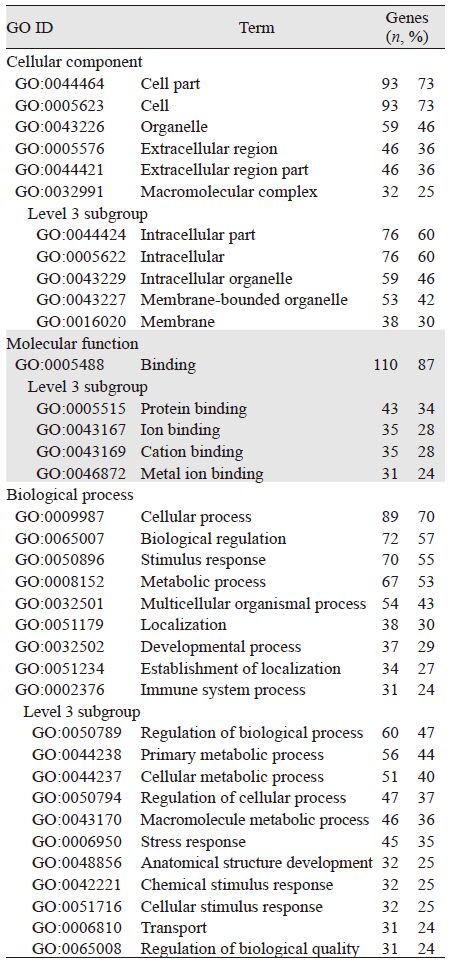
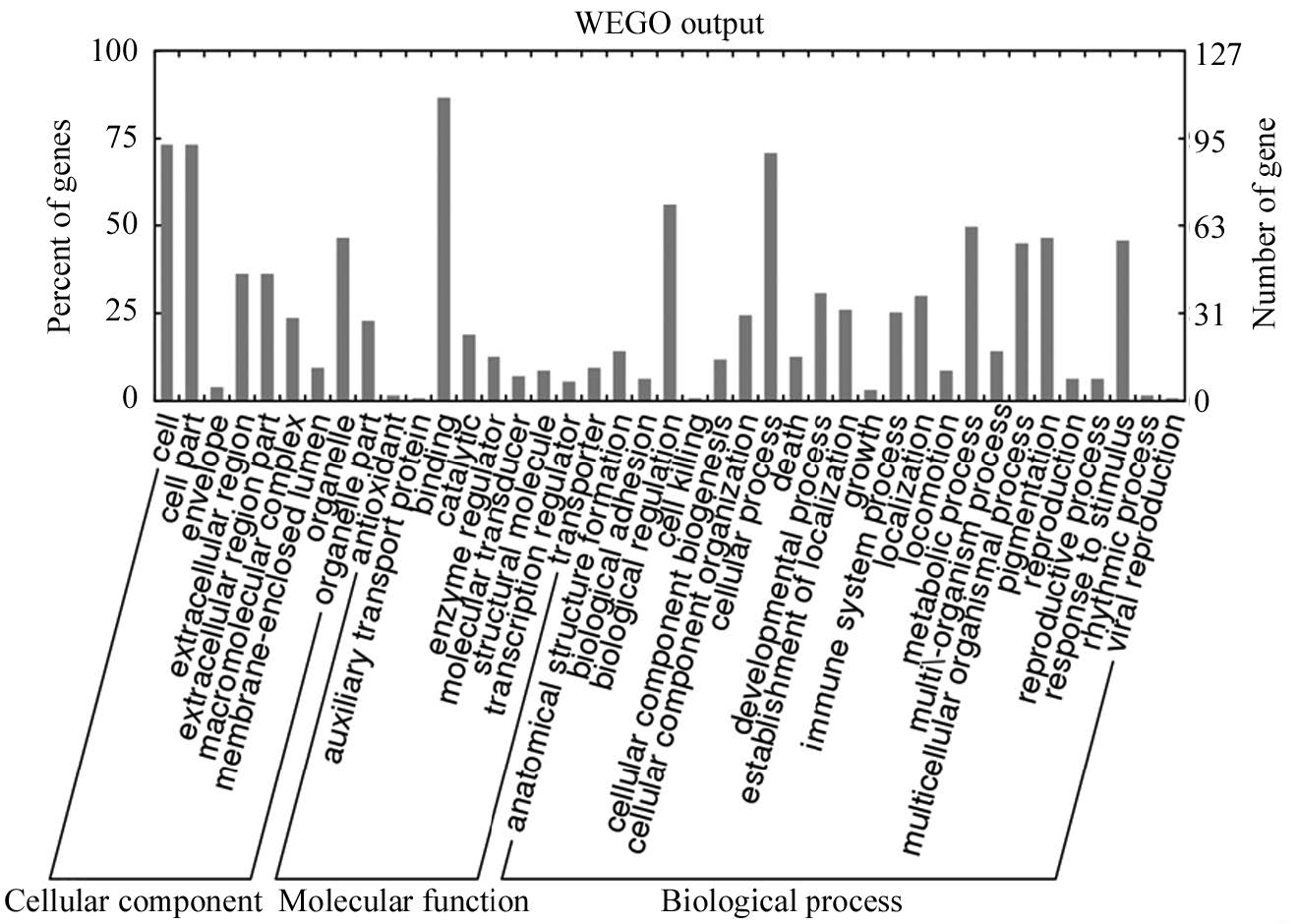
2.2 生物学功能分析用GO的蛋白数据库(http://www.geneontology.org/)及BLAST2GO(http://www.blast2go.com/b2ghome)对上述试验得出的755个差异表达蛋白进行数据库比对及蛋白的生物学功能注释,发现其中有127个差异表达蛋白可以被划分为3大功能类:与细胞组成相关的蛋白有118(93%)个,主要涉及细胞组分(93个,73%)、细胞(93个,73%)、细胞器(59个,46%)等14种功能;与分子功能相关的蛋白116(91%)个,有110个涉及结合反应,包括蛋白、离子结合等;与生物过程相关的蛋白115(91%)个,涉及多达21种功能,主要参与细胞过程(89个,70%)、生物调节(72个,57%)、刺激反应(70个,55%)、新陈代谢过程(67个,53%)、有机体多细胞过程(54个,43%)等。在GO分类第三级亚类水平上,功能注释可分成18种亚类。对此127个差异表达蛋白进行功能注释,每个蛋白可被注释有多种功能,见表 1、图 1。
 |
|
| 图 1 差异表达蛋白的GO生物学功能注释 Figure 1 Gene Oncology of differentially expressed proteins |
根据文献比对,在耐药标本中显著上调的429个差异表达蛋白中,包含osteopontin(OPN)、clusterin(CLU)、5'-nucleotidase(CD73)、tissue inhibitor of metalloproteinases 1(TIMP1)、cell surface glycoprotein MUC18(MCAM、CD146)等18个蛋白与肿瘤恶性行为、化疗及预后情况显著相关,见表 2。
采用KEGG数据库对所有755个差异表达显著的蛋白进行分析,发现56个差异表达蛋白参与信号通路的功能,涉及的通路有47个。与肿瘤相关的主要有PPA信号通路(涉及4个蛋白,7.14%)、Toll样受体信号通路(涉及3个蛋白5.36%)、TGF-β信号通路(涉及2个蛋白3.57%)、细胞黏附分子通路(涉及2个蛋白3.57%)等10条通路,其中有很多与肿瘤相关性明显的差异表达蛋白参与通路的过程,见表 3。
本研究中的iTRAQ技术采用8标试剂,即包括8种等量的同位素试剂,能对蛋白质酶解后肽段进行标记,从而通过串联质谱方法,对肽段进行精确鉴定和定量,为筛选卵巢癌耐药相关蛋白提供了可靠途径。iTRAQ技术对蛋白检测的灵敏度、 蛋白覆盖率高,已被应用于多种肿瘤血清、组织蛋白标志物的研究并取得良好的结果。Ding等[4]应用iTRAQ联合LC-MS/MS技术筛选了宫颈癌组织与正常组织的差异表达蛋白,发现了包括G6PD、ALDH3A1、STAT1和HSPB1在内的294种差异表达蛋白,有望成为宫颈癌治疗中新的靶向蛋白。Fan等[5]应用iTRAQ技术分析了10株卵巢癌细胞系及2株正常卵巢上皮细胞系,发现了1 273种 蛋白均存在于卵巢癌细胞系中,与正常卵巢上皮细胞相比,有75种蛋白表达上调、164种蛋白表达下调。
本研究应用iTRAQ技术在晚期卵巢浆液性癌组织中筛选出大量与卡铂耐药性显著相关的差异蛋白。通过文献及数据库比对,发现有众多上调的差异表达蛋白参与恶性肿瘤的发生发展过程,如骨桥蛋白(osteopontin,OPN)、丛生蛋白(clusterin,CLU)、5'-核苷酸酶(CD73)和金属蛋白酶组织抑制因子1(TIMP1)等,与肿瘤预后、化疗耐药性及治疗结局等相关。骨桥蛋白可增加肿瘤细胞黏附性,促进肿瘤生长和转移。Li等[6]报道在乳腺癌中OPN与肿瘤侵袭性相关。Hahne等[7]报道子宫内膜癌中抑制OPN的表达后,肿瘤细胞的迁移和侵袭能力显著减低,可提高肿瘤细胞对放疗的敏感度。丛生蛋白有分泌型(sCLU)和核型(nCLU)两种亚型,sCLU的过度表达,可保护肿瘤细胞免受自身免疫引起的凋亡和抗癌药物的损伤,从而降低癌细胞对化疗药物的敏感度。Koltai等[8]发现sCLU在乳腺癌、肺癌及卵巢癌等多种肿瘤中过度表达并与化疗耐药有关。本课题组在前期研究中也 发现CLU在化疗后复发的卵巢癌组织中高度表达,并且与多药耐药基因(MDR)的表达呈显著正相关[9]。亦有学者报道下调CLU的表达后可明显增加肺癌、膀胱癌细胞对顺铂、阿霉素的敏感度[10, 11]。5'-核苷酸酶为一种血浆膜蛋白,可促进肿瘤细胞中的血管生成,加快肿瘤的生长和转移,并且可能保护细胞免受化疗损伤,与多药耐药机制有关[12, 13]。特异性抑制CD73的表达后可以逆转多药耐药的表型并且增加化疗药物对肿瘤的杀伤作用[14, 15]。TIMP1通过抑制基质金属蛋白酶促进肿瘤细胞的生长和侵袭,并且具有抗凋亡活性及对抗化疗药物的作用,其高表达造成多种肿瘤对紫杉醇、表柔比星等化疗药物的反应不佳,可能与PI3K/Akt信号和NF-κB的信号通路有关[16, 17, 18]。
除了上述差异表达蛋白外,本研究还发现众多如血管抑素结合样蛋白1、血清淀粉样蛋白A、基膜聚醣和锌α2糖蛋白等在耐药组织中呈显著高表达的蛋白,可能成为新的耐药靶向蛋白,值得进一步进行化疗耐药性的研究。由于iTRAQ技术为初步筛查,还需要继续对样本进行差异表达蛋白的验证,为深入研究和逆转卵巢癌耐药机制提供基础。
| [1] | Zhang S, Mercado-Uribe I, Hanash S3, et al. iTRAQ-based proteomic analysis of polyploid giant cancer cells and budding progeny cells reveals several distinct pathways for ovarian cancer development[J]. PLoS One, 2013, 8(11): e80120. |
| [2] | Karabudak AA, Hafner J, Shetty V, et al. Autoantibody biomarkers identified by proteomics methods distinguish ovarian cancer from non-ovarian cancer with various CA-125 levels[J]. J Cancer Res Clin Oncol, 2013, 139(10): 1757-70. |
| [3] | Zhao D, Zhang W, Li XG, et al. Predicting clinical chemo-sensitivity of primary ovarian cancer using adenosine triphosphate-tumor chemosensitivity assay combined with detection of drug resistance genes[J]. Zhonghua Fu Chan Ke Za Zhi, 2011, 46(3): 193-8. [赵丹, 张伟, 李晓光, 等. 三磷酸腺苷-肿瘤体外药敏试验联合耐药基因检测预测原发性卵巢癌的化疗敏感性[J]. 中华妇产科杂志, 2011, 46(3): 193-8.] |
| [4] | Ding Y, Yang M, She S, et al. iTRAQ-based quantitative proteomic analysis of cervical cancer[J]. Int J Oncol, 2015, 46(4): 1748-58. |
| [5] | Fan G, Wrzeszczynski KO, Fu C. A quantitative proteomics-based signature of platinum sensitivity in ovarian cancer cell lines[J]. Biochem J, 2015, 465(3): 433-42. |
| [6] | Li NY, Weber CE, Mi Z, et al. Osteopontin up-regulates critical epithelial-mesenchymal transition transcription factors to induce an aggressive breast cancer phenotype[J]. J Am Coll Surg, 2013, 217(1): 17-26. |
| [7] | Hahne JC, Meyer SR, Kranke P, et al. Studies on the role of osteopontin-1 in endometrial cancer cell lines[J]. Strahlenther Onkol, 2013, 189(12): 1040-8. |
| [8] | Koltai T. Clusterin: a key player in cancer chemoresistance and its inhibition[J]. Onco Targets Ther, 2014, 7: 447-56. |
| [9] | Liu SL, Li HX. Over-expression of CLU and PKCα genes and their correlation with drug-resistance in human ovarian cancer tissue[J]. Xian Dai Fu Chan Ke Jin Zhan Za Zhi, 2010, 19(10): 735-8. [刘淑靓, 李红霞. CLU、PKCα基因过度表达与卵巢癌化疗耐药相关的研究[J]. .现代妇产科进展杂志, 2010, 19(10): 735-8] |
| [10] | Zhang B, Zhang K, Liu Z, et al. Secreted Clusterin Gene Silencing enhances chemosensitivity of A549 cells to cisplatin through AKT and ERK1/2 pathways in vitro[J]. Cell Physiol Biochem, 2014, 33(4): 1162-75. |
| [11] | Lu J, Luo JH, Pang J, et al. Lentivirus-mediated RNA interference of clusterin enhances the chemosensitivity of EJ bladder cancer cells to epirubicin in vitro[J]. Mol Med Rep, 2012, 6(5): 1133-9. |
| [12] | Wang L, Tang S, Wang Y, et al. Ecto-5'-nucleotidase (CD73) promotes tumor angiogenesis[J]. Clin Exp Metastasis, 2013, 30(5): 671-80. |
| [13] | Quezada C, Garrido W, Oyarzún C, et al. 5’-ectonucleotidase mediates multiple-drug resistance in glioblastoma multiforme cells[J]. J Cell Physiol, 2013, 228(3): 602-8. |
| [14] | Grozio A, Sociali G, Sturla L, et al. CD73 protein as a source of extracellular precursors for sustained NAD+ biosynthesis in FK866-treated tumor cells[J]. J Biol Chem, 2013, 288(36): 25938-49. |
| [15] | Zhi X, Wang Y, Zhou X, et al. RNAi-mediated CD73 suppression induces apoptosis and cell-cycle arrest in human breast cancer cells[J]. Cancer Sci, 2010, 101(12): 2561-9. |
| [16] | Hekmat O, Munk S, Fogh L, et al. TIMP-1 increases expression and phosphorylation of proteins associated with drug resistance in breast cancer cells[J]. J Proteome Res, 2013, 12(9): 4136-51. |
| [17] | Zhu D, Zha X, Hu M, et al. High expression of TIMP-1 in human breast cancer tissues is a predictive of resistance to paclitaxel-based chemotherapy[J]. Med Oncol, 2012, 29(5): 3207-15. |
| [18] | Fu ZY, Lv JH, Ma CY, et al. Tissue inhibitor of metalloproteinase-1 decreased chemosensitivity of MDA-435 breast cancer cells to chemotherapeutic drugs through the PI3K/AKT/NF-кB pathway[J]. Biomed Pharmacother, 2011, 65(3): 163-7. |
 2016, Vol. 43
2016, Vol. 43