文章信息
- 李雯,冯彦林.
- LI Wen, FENG Yanlin.
- SUVmax、Ki-67、p53、EGFR对三阴性乳腺癌新辅助化疗疗效的预测价值
- Valuation of SUVmax, Ki-67, p53 and EGFR in Predicting Effect of Neoadjuvant Chemotherapy on Triple-negative Breast Cancer Patients
- 肿瘤防治研究, 2016, 43(01): 45-47
- Cancer Research on Prevention and Treatment, 2016, 43(01): 45-47
- http://www.zlfzyj.com/CN/10.3971/j.issn.1000-8578.2016.01.010
-
文章历史
- 收稿日期: 2015-05-11
- 修回日期: 2015-08-05
近年来,18F-FDG PET/CT在乳腺癌治疗评估中的价值已被广泛认可,有研究指出不同亚型乳腺癌的18F-FDG代谢程度及预后上有所不同,18F-FDG PET/CT在评价三阴性乳腺癌(triple-negative breast cancer,TNBC)新辅助化疗(neoadjuvant chemotherapy,NAC)疗效上更有优势[1, 2, 3]。Ki-67反映肿瘤细胞的增殖,其高表达常提示乳腺癌预后不良[4]。p53表达阳性的乳腺癌侵袭性更强,并与淋巴结转移相关,提示预后不良[5]。EGFR高表达可以促进肿瘤细胞增殖、血管生成、黏附、侵袭、转移等[6]。本研究探讨18F-FDG PET/CT SUVmax、p53、Ki-67、EGFR对TNBC及非TNBC对新辅助化疗完全病理缓解(pathologic complete response,pCR)率的预测价值。
1 资料与方法 1.1 临床资料收集2008年1月至2013年6月期间在佛山市第一人民医院就诊并明确病理诊断的TNBC患者27例,非TNBC患者184例。排除原发性炎性乳腺癌、乳腺转移癌患者。所有患者均为女性,年龄26~65岁,中位年龄50岁。所有患者均在本院完成病理诊断、新辅助化疗、手术以及PET/CT显像。所有患者根据具体情况行3~6个疗程的新辅助化疗,见表 1。
所有211份新辅助化疗前活检标本经10%中性福尔马林固定,石蜡包埋切片、脱蜡、脱水,HE染色及Envision两步法免疫组织化学染色,使用光学显微镜观察。以胞核出现棕黄色颗粒视为Ki-67阳性,血管内皮阳性细胞不计在内。Ki-67表达依据2011年St.Gallen国际乳腺会议确定标准[7],阳性细胞比例≥14%为高表达,<14%为低表达。以细胞膜及细胞核出现棕黄色或棕色颗粒的细胞作为p53、EGFR阳性表达。
1.3 18F-FDG PET/CT扫描 1.3.1 扫描方法采用Philips公司GEMINI型PET/CT显像仪,18F-FDG 由广州同位素中心提供,放化纯度>95%。
所有受检者按要求准备后肘静脉注射5.18 MBq/kg 18F-FDG,平静休息60 min后行PET/CT显像。CT扫描参数:120 kV,130 mAs,螺距1.0,层厚6.5 mm。PET成像采用3D采集模式,3分钟/床位,数据经Ramla 3D方法获得衰减校正图像。
1.3.2 SUVmax计算及图像分析PET/CT图像由2位有丰富诊断经验的核医学医师独立诊断分析。最大标准摄取值(SUVmax)通过沿病灶边缘勾画感兴趣区(region of interest,ROI)后由工作站自动计算得出。
1.4 疗效评价标准病理完全缓解(pathologic complete response,pCR)被定义为手术切除标本肿瘤原发灶及腋窝淋巴结中均没有浸润或非浸润性癌组织残留。
1.5 统计学方法所有数据用统计学软件SPSS13.0进行处理,以P<0.05为差异有统计学意义。两组数据的均数比较采用独立样本t检验,二分类变量的比较采用的χ2检验以及Fisher’s精确检验。
2 结果 2.1 三阴性与非三阴性乳腺癌18F-FDG PET/CT显像所有三阴性与非三阴性乳腺癌患者在18F-FDG PET/CT显像中,癌灶均呈FDG高代谢,敏感度为100%。
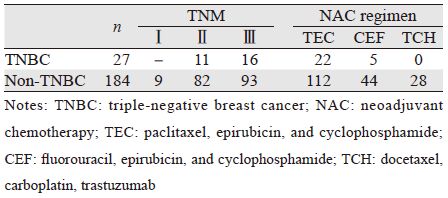
2.2 TNBC与非TNBC患者新辅助化疗疗效及SUVmax的比较TNBC患者新辅助化疗前的SUVmax高于非TNBC(P=0.045),新辅助化疗后TNBC患者的pCR率明显高于非TNBC患者(P=0.000),见表 2。
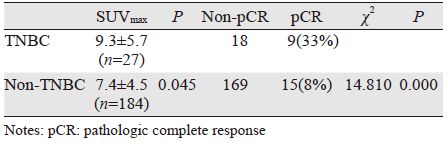 |
TNBC患者达到pCR组的化疗前SUVmax与未达到pCR组的化疗前SUVmax之间差异无统计学意义(t=0.068,P=0.946)。非TNBC患者达到pCR组的化疗前SUVmax与未达到pCR组的化疗前SUVmax之间差异无统计学意义(t=-0.908,P=0.365)。将TNBC及非TNBC患者按照T分期分成两组:T1+T2组、T3+T4组,分别比较两组中pCR组与未达到pCR组之间的SUVmax,结果显示TNBC及非TNBC患者的T1+T2、T3+T4组中,pCR组的化疗前SUVmax与未达到pCR组的化疗前SUVmax之间差异均无统计学意义,见表 3。
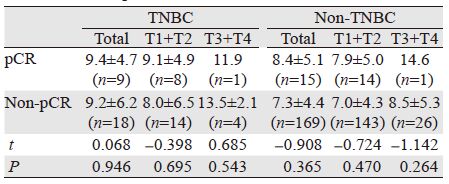 |
在TNBC患者中,分子生物学指标Ki-67、p53、EGFR阳性表达组的pCR率与阴性表达组之间差异均无统计学意义(P>0.05)。在非TNBC患者中,分子生物学指标Ki-67、p53、EGFR阳性表达组的pCR率与阴性表达组之间差异也均无统计学意义(P>0.05),结果见表 4。
 |
三阴性乳腺癌的发生率约占乳腺癌总发生率的15%,且常发生于40岁以下的女性,具有预后较差、5年生存率低、侵袭性强、易复发及易远处转移等生物学特征[8]。Wu等Meta分析结果显示,TNBC相较其他类型乳腺癌对NAC更敏感并且更可能达到病理完全缓解(pCR)[9] 。本研究发现TNBC患者有较高的病理完全缓解率(33%),高于非TNBC患者(8%),提示三阴性乳腺癌对新辅助化疗更加敏感。
与此同时,本研究发现TNBC所有患者的癌灶呈FDG高代谢,敏感度达100%,且TNBC患者的SUVmax要高于非TNBC患者(P<0.05),提示TNBC能量代谢更高,增殖更快,同时TNBC新辅助化疗前FDG高代谢使得PET/CT监测TNBC新辅助化疗疗效的作用更突出。Dogan等[8]针对三阴性乳腺癌的影像特征进行了综述,指出相对于ER阴性、HER2阳性的乳腺癌,18F-FDG PET/CT对三阴性乳腺癌敏感度更高,而且在诊断腋窝淋巴结转移的准确性上更优于其他分子亚型,观点与本研究相似。
本研究发现三阴性乳腺癌(TNBC)新辅助化疗中,达到pCR组的化疗前SUVmax与未达到pCR组之间未见明显相关性。与此同时,考虑到肿瘤长径对SUVmax的影响,将病例按照T分期分组进行了分析,结果仍然是阴性。可能的原因是化疗前的SUVmax并不能较好地体现出肿瘤病灶对新辅助化疗的反应。但本研究中只有3例做了化疗后PET/CT显像,该结果提示癌灶的FDG代谢及病灶体积随着治疗逐渐减少,因此化疗早期SUVmax的变化在预测TNBC新辅助化疗疗效中的价值值得进一步探讨。
Zhang等[10]一项纳入723例患者的Meta分析结果显示,Ki-67的表达以及淋巴结转移是三阴性乳腺癌新辅助化疗后pCR率的预测因素,而p53及CK5/6表达不能作为预后因子。本研究中,分子生物学指标Ki-67、p53、EGFR的阳性表达率与病理疗效之间均无统计学意义,需要增加病例数进一步研究。
三阴性乳腺癌对新辅助化疗敏感,18F-FDG代谢程度高,因此PET-CT在监测三阴性乳腺癌新辅助化疗疗效中的价值以及分子生物学指标Ki-67、p53、EGFR是否能够成为预测因素值得我们进一步大样本量进行前瞻性的研究。
| [1] | Groheux D, Hindie E, Giacchetti S, et al. Early assessment with 18F-fluorodeoxyglucose positron emission tomography/computed tomography can help predict the outcome of neoadjuvant chemotherapy in triple negative breast cancer[J]. Eur J Cancer, 2014, 50(11): 1864-71. |
| [2] | Groheux D, Giacchetti S, Delord M, et al. Prognostic impact of 18F-FDG PET/CT staging and of pathological response to neoadjuvant chemotherapy in triple-negative breast cancer[J]. Eur J Nucl Med Mol Imaging, 2015, 42(3): 377-85. |
| [3] | Koolen BB, Pengel KE, Wesseling J, et al. FDG PET/CT during neoadjuvant chemotherapy may predict response in ER-positive/HER2-negative and triple negative, but not in HER2-positive breast cancer[J]. Breast, 2013, 22(5): 691-7. |
| [4] | Qin Q, Gao F, Jiang W, et al. Effect of neoadjuvant chemotherapy on expressions of estrogen receptor, progesterone receptor, human epidermal growth factor receptor 2, and Ki-67 in breast cancer[J]. Chin Med J(Engl), 2014, 127(18): 3272-7. |
| [5] | Turner N, Moretti E, Siclari O, et al. Targeting triple negative breast cancer: is p53 the answer?[J]. Cancer Treat Rev, 2013, 39(5): 541-50. |
| [6] | Ferraro DA, Gaborit N, Maron R, et al. Inhibition of triple-negative breast cancer models by combinations of antibodies to EGFR[J]. Proc Natl Acad Sci USA, 2013, 110(5): 1815-20. |
| [7] | Goldhirsch A, Wood WC, Coates AS, et a1. Strategies for subtypes dealing with the diversity of breast cancer: highlights of the St. Gallen international expert consensus on the primary therapy of early breast cancer 2011[J]. Ann Oneol, 2011, 22(8): 1736-47. |
| [8] | Dogan BE, Turnbull LW. Imaging of triple-negative breast cancer[J]. Ann Oncol, 2012, 23 suppl 6:vi 23-9. |
| [9] | Wu K, Yang Q, Liu Y, et al. Meta-analysis on the associatiion between pathologic complete response and triple-negative breast cancer after neoadjuvant chemotherapy[J]. World J SurgOncol, 2014, 12: 95. |
| [10] | Zhang GJ, Xie WQ, Xu L, et al. Predictors of neoadjuvant chemotherapy for triple-negative breast cancer: a Meta-analysis with 723 cases[J]. Chinese-German J Clin Oncol, 2013, 12(1): 15-9. |
 2016, Vol. 43
2016, Vol. 43