文章信息
- 王雅琴,陈智.
- WANG Yaqin, CHEN Zhi.
- 成纤维细胞系3T3细胞来源exosome对小鼠乳腺癌细胞增殖能力的影响
- Effect of exosome Extracted from Fibroblast Cell Line 3T3 on Proliferation of Mouse Breast Cancer Cells
- 肿瘤防治研究, 2016, 43(01): 11-14
- Cancer Research on Prevention and Treatment, 2016, 43(01): 11-14
- http://www.zlfzyj.com/CN/10.3971/j.issn.1000-8578.2016.01.003
-
文章历史
- 收稿日期: 2015-02-16
- 修回日期: 2015-05-07
研究发现,肿瘤微环境在肿瘤的疾病进程中发挥着重要的作用,微环境中的炎症细胞、间质细胞等可分泌多种细胞因子调节肿瘤细胞的生长、分化、远处转移及血管生成等一系列病理生理功能[1, 2, 3]。外泌小体(exosome)作为近年来研究的热点,被认为是潜在的诊断标志和治疗靶点。exosome也称为小囊体或小囊泡,直径为30~100 nm,虽然是细胞外泌囊泡中体积较小的一种,但其中包含蛋白质及RNA等多种物质。研究表明,间质细胞可以通过分泌exosome激活乳腺癌细胞中的STAT1及NOTCH信号通路,调节肿瘤的化疗敏感度;exosome也有望作为非小细胞肺癌新的治疗靶点及临床诊断标志[4, 5, 6]。虽然既往研究表明exosome是肿瘤微环境中重要的组成部分,但究竟是通过其中的哪种蛋白或RNA分子调控肿瘤的生物学进程,目前尚不十分清楚。本研究通过小鼠成纤维细胞系3T3来源的exosome作为研究工具,以三阴性(雌、孕激素及表皮生长因子受体2表达均为阴性)小鼠乳腺癌细胞4T1作为实验模型,观察exosome对乳腺癌细胞增殖的影响,并探索其中可能的机制。
1 材料和方法 1.1 细胞及试剂小鼠成纤维细胞3T3及小鼠乳腺癌细胞4T1购自中科院上海细胞库。PureExo Exosome提取试剂盒、CCK8检测试剂盒及BrdU/PI双掺入检测试剂盒购自武汉启动子生物有限公司。抗人表皮生长因子受体2(human epidermal growth factor receptor-2,HER2)、下游PI3K/AKT信号转导通路p-AKT(308)、p-AKT(473)、AKT及内参GAPDH抗体均购自上海优宁维生物有限公司。HER2特异性siRNA及各基因PCR引物由武汉擎科生物有限公司设计并合成,引物序列为:HER2:上游引物:5’-GAGACAGAGCTAAGGAAGCTGA-3’,下游引物:5’-ACGGGGATTTTCACGTTCTCC-3’,GAPDH:上游引物:5’-AGGTCGGTGTGAACGGATTTG-3’,下游引物:5’-GGGGTCGTTGATGGCAACA-3’。HER2单克隆抗体靶向药物赫赛汀(Herceptin)购自美 国 基因科技中国分公司。
1.2 实验方法 1.2.1 细胞培养小鼠3T3及4T1细胞培养于含10%胎牛血清的DMEM培养液中,37℃、5%CO2培养箱内常规传代培养。
1.2.2 exosome提取及应用小鼠3T3细胞培养至对数生长期,收集10 ml上清液,低速离心去掉沉淀杂质,按照PureExo Exosome提取试剂盒说明书提取exosome。透射电镜观察、Western blot检测exosome特有的分子标志CD81,BCA法定量exosome的浓度。另将4T1细胞接种至6孔板及96孔板,大约至50%左右融合度,加入不同浓度的exosome继续培养,不同的时间点收集细胞行后续实验。无菌PBS漂洗5次。按照试剂盒说明书提取exosome中总RNA,qPCR检测其中HER2及内参GAPDH的mRNA水平。
1.2.3 CCK8试剂盒法检测细胞增殖不同浓度exosome处理后的4T1细胞,分别于0、24、48、72及96 h后按照CCK-8试剂盒说明书,每孔加入10%的CCK8溶液,继续孵育4 h后,利用酶标仪在450 nm处测定吸光度值并绘制曲线,每组设5个复孔,实验重复3次。
1.2.4 BrdU/PI双掺入法测定细胞DNA合成及细胞周期不同浓度exosome处理96 h后的4T1细胞掺入BrdU(10 μmol/L)30 min,PBS漂洗,75%冰乙醇固定过夜后,2 mol/L盐酸破膜打孔40 min,0.1 mol/L四氢硼砂中和,并依此孵育BrdU一抗、二抗及PI后行流式细胞仪检测,实验重复3次。
1.2.5 免疫印迹(Westernblot)实验 不同浓度的exosome作用96 h后,每组各收集1×106个细胞,裂解获取细胞总蛋白,各样品通过BCA法检测蛋白浓度,各蛋白样品按照上述检测所得浓度分别取50 μg行聚丙烯酰胺凝胶电泳,PVDF膜转膜并用脱脂奶粉封闭非特异性结合,依次孵育一抗及二抗最后用ECL显色液显影检测细胞中HER2、p-AKT(308)、p-AKT(473)和AKT的蛋白水平变化,以GAPDH作为内参,实验重复3次。
1.2.6 荧光定量实时PCR(qPCR)检测4T1细胞及exosome中HER2的表达不同浓度的exosome作用4T1细胞96 h后,每组各收集1×106个细胞,通过TRIzol一步法提取细胞总RNA,反转录合成cDNA,应用上述引物行PCR扩增,ABI7300检测并分析各细胞中HER2的mRNA水平,以GAPDH作为内参,每组设3个复孔,实验重复3次。exosome中HER2及GAPDH的总RNA按说明书提取。
1.3 统计学方法用SPSS12.0统计学软件进行统计分析。实验数据以均数±标准差(x±s)表示,组间比较采用t检验。P<0.05为差异有统计学意义。
本研究得到武汉中心医院医学伦理委员会的批准。
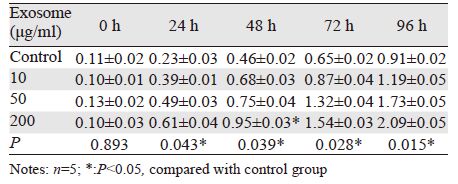
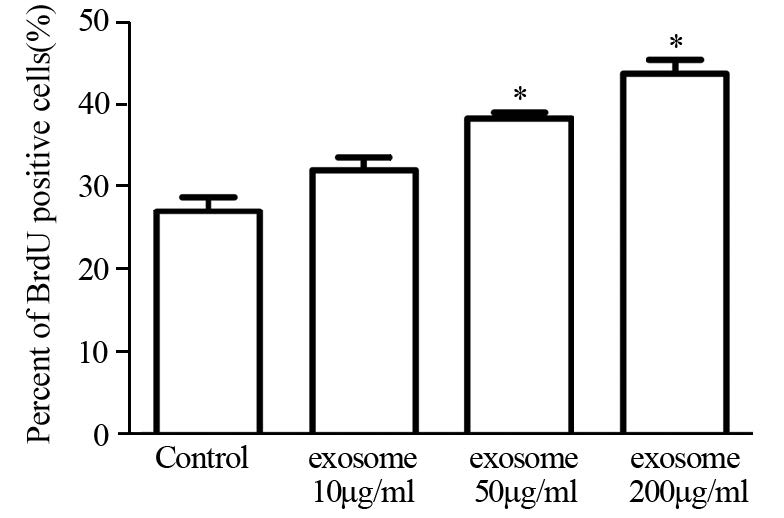
2 结果 2.1 exosome可促进4T1细胞增殖及细胞周期进程通过CCK8试剂盒法检测细胞增殖,结果提示exosome处理4T1细胞后,细胞增殖加快:0 h时各组细胞吸光度差异无统计学意义,24 h时200 μg/ml exosome处理组(0.61±0.04)高于对照组(0.23±0.03),P<0.05,48 h时200 μg/ml exosome处理组(0.95±0.03)明显高于对照组(0.46±0.02),差异有统计学意义(P<0.05);72、96 h时exosome各浓度组与对照组相比,均有明显升高,差异有统计学意义(P<0.05),见表 1。而BrdU/PI双掺入实验中,随着exosome浓度的升高,4T1细胞BrdU阳性细胞即处于DNA复制的S期细胞比例逐渐增多,见图 1~2,而处于G0/G1期的细胞比例明显减少,见图 2。
|
| *:P<0.05, compared with control group 图 1 exosome对4T1细胞DNA合成的影响 Figure 1 Effect of exosome on DNA systhesis of 4T1 cells |

|
| 图 2 不同浓度exosome对4T1细胞周期的影响 Figure 2 Effect of exosome on cell cycle of 4T1 cells |
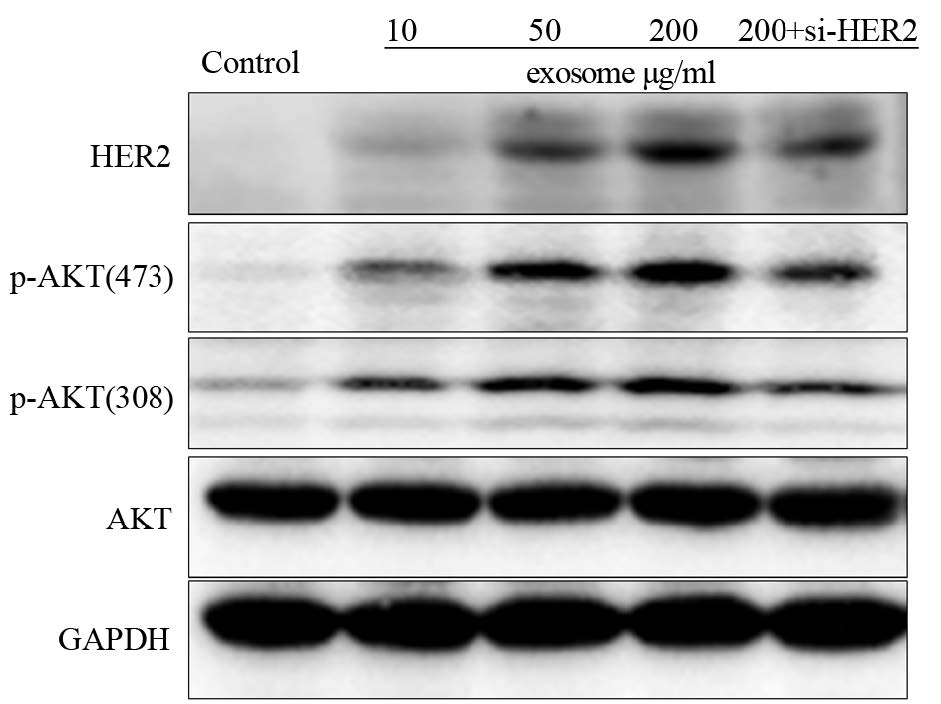
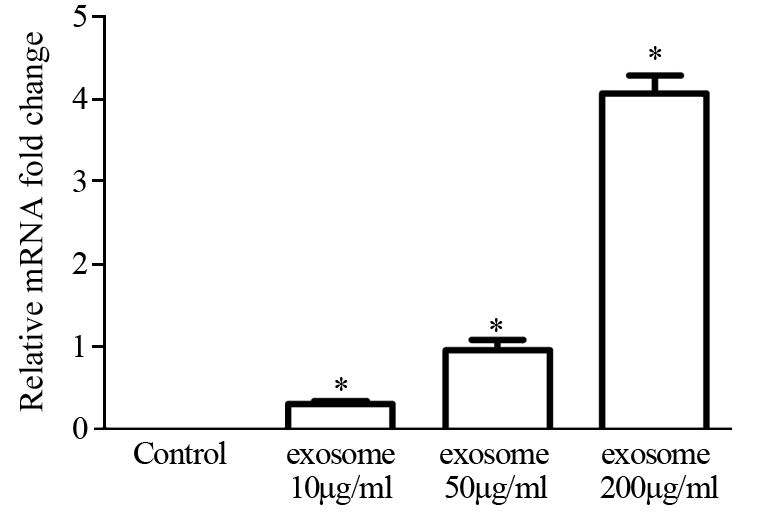
Western blot及qPCR结果提示,随着exosome浓度的提高,4T1细胞中HER2水平逐渐升高,而且Western blot结果提示HER2增高的同时伴随着AKT磷酸化水平明显升高;而转染HER2的特异性siRNA,干预HER2的表达后可抑制AKT的磷酸化水平,见图 3~4。
|
| 图 3 Western blot检测exosome对4T1细胞中HER2表达及PI3K/AKT信号通路活性的影响 Figure 3 Effect of exosome on expression of HER2 and activity of PI3K/AKT signal pathway in 4T1 cells observed by Western blot |
|
| n=3, *:P<0.05, compared with control group 图 4 qPCR检测不同浓度exosome对4T1细胞HER2 mRNA水平的影响 Figure 4 Effect of exosome on HER2 mRNA level in 4T1 cells observed by qPCR |
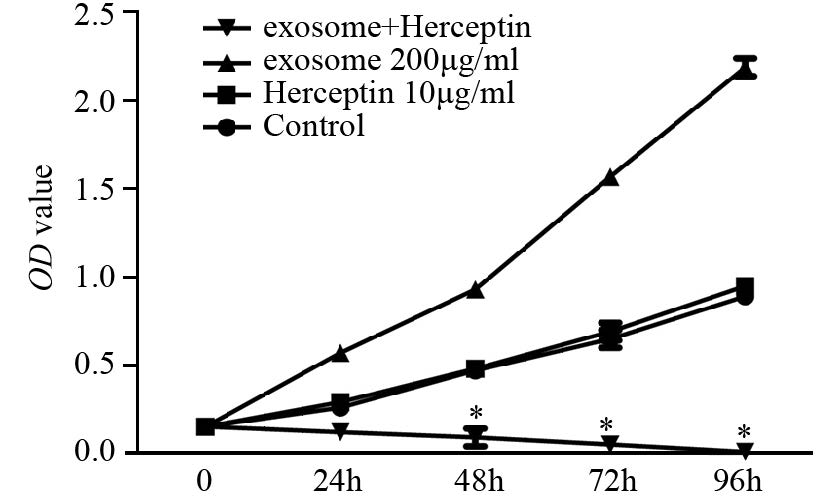
CCK8实验表明单独Herceptin对4T1细胞无明显杀伤作用,Herceptin作用后4T1细胞的增殖无显著变化,而同时给以200 μg/ml 的exosome处理细胞后,4T1细胞对Herceptin的敏感度明显增加,48 h开始出现统计学差异,差异最显著的96 h 时仅有约13% 4T1细胞存活,杀伤率达87%,见图 5。
|
| n=5. *: P<0.05, compared with control group 图 5 exosome对Herceptin治疗4T1细胞敏感度的影响 Figure 5 Effect of exosome on sensitivity of 4T1 cells to Herceptin treatment |
近年来随着肿瘤分子生物学研究的深入,人们发现肿瘤微环境在肿瘤的发生发展中起着重要的作用,肿瘤周围浸润着大量的炎症细胞及间质细胞可分泌exosome,通过胞吞作用进入肿瘤细胞中,调节肿瘤细胞的生长、运动及分化潜能。肿瘤细胞也可分泌exosome改变间质细胞尤其是免疫细胞对肿瘤的免疫监视及免疫应答[7, 8, 9]。而乳房组织中除乳腺腺体外,还含有大量脂肪细胞及纤维结缔细胞,那么这些间质细胞是否能通过分泌exosome影响乳腺上皮细胞中HER2等蛋白的表达,尚未知晓。本实验以小鼠的成纤维细胞3T3作为材料,利用试剂盒法提取的exosome处理小鼠乳腺癌4T1细胞,观察对其增殖及HER2表达的影响。
本研究发现,exosome可以明显促进4T1细胞从G0/G1期进入S期,从而加快肿瘤细胞周期进程并促进细胞增殖,说明exosome中含有某些可以正向调控细胞周期的蛋白或者RNA分子。因此再利用Western blot及qPCR检测exosome处理96 h后4T1细胞中HER2的表达(图 3~4),发现HER2的表达随着exosome浓度的增加而逐渐增高,提示exosome中可能含有HER2并通过其促进细胞增殖。进一步检测HER2下游PI3K/AKT信号通路,发现AKT磷酸化水平也随着exosome浓度的增加而明显增高,意味着exosome可以通过HER2激活4T1细胞的PI3K/AKT信号通路。检测exosome中HER2的mRNA水平,证实exosome确实存在HER2的RNA分子。进一步使用HER2的特异性单克隆抗体曲妥珠单抗即Herceptin,发现exosome可明显增加4T1细胞对Herceptin的敏感度。
综上所述,本研究发现,小鼠成纤维细胞系3T3来源exosome可促进小鼠乳腺癌细胞4T1增殖,加快其细胞周期进程,并且可能通过使4T1外源性获得HER2表达,从而激活其下游PI3K/AKT信号通路; exosome可以增强4T1细胞对Herceptin的治疗敏感度。本研究提示可针对exosome开发新的药物或抑制剂,有可能为乳腺癌的临床治疗开辟新的方向。当然目前针对exosome的研究仍仅限于实验室阶段,今后尚需进一步阐明exosome在肿瘤微环境复杂信号通路中的作用和意义;同时如何提高exosome检测敏感度、降低检测成本的问题也亟待解决。
| [1] | Martin SK, Kamelgarn M, Kyprianou N. Cytoskeleton targeting value in prostate cancer treatment[J]. Am J Clin Exp Urol, 2014, 2(1): 15-26. |
| [2] | Chandrasekaran S, King MR. Microenvironment of Tumor-Draining Lymph Nodes: Opportunities for Liposome-Based Targeted Therapy[J]. Int J Mol Sci, 2014, 15(11): 20209-39. |
| [3] | Tsunemi T, Hamada K, Krainc D. ATP13A2/PARK9 Regulates Secretion of Exosomes and α-Synuclein[J]. J Neurosci, 2014, 34(46): 15281-7. |
| [4] | Lässer C. Exosomes in diagnostic and therapeutic applications: biomarker, vaccine and RNA interference delivery vehicle[J]. Expert Opin Biol Ther, 2015, 15(1): 103-17. |
| [5] | Boelens MC, Wu TJ, Nabet BY, et al. Exosome transfer from stromal to breast cancer cells regulates therapy resistance pathways[J]. Cell, 2014, 159(3): 499-513. |
| [6] | Qin J, Xu Q. Functions and application of exosomes[J]. Acta Pol Pharm, 2014, 71(4):537-43. |
| [7] | Salido-Guadarrama I, Romero-Cordoba S, Peralta-Zaragoza O, et al. MicroRNAs transported by exosomes in body fluids as mediators of intercellular communication in cancer[J]. Onco Targets Ther, 2014, 7: 1327-38. |
| [8] | Ung TH, Madsen HJ, Hellwinkel JE, et al. Exosome proteomics reveals transcriptional regulator proteins with potential to mediate downstream pathways[J]. Cancer Sci, 2014, 105(11): 1384-92. |
| [9] | Zhou M, Chen J, Zhou L, et al. Pancreatic cancer derived exosomes regulate the expression of TLR4 in dendritic cells via miR-203[J]. Cell Immunol, 2014, 292(1-2): 65-9. |
 2016, Vol. 43
2016, Vol. 43