文章信息
- 王燕,张自雄,戴梦源,陶泽璋,肖伯奎,陈始明.
- WANG Yan, ZHANG Zixiong, DAI Mengyuan, TAO Zezhang, XIAO Bokui, CHEN Shiming.
- 5-Aza-C对人鼻咽癌细胞hTERT基因表达及端粒酶活性的影响
- Effect of 5-Azacytidine on hTERT mRNA Expression and Telomerase Activity in Human Nasopharyngeal Carcinoma Cells
- 肿瘤防治研究, 2016, 43(01): 6-10
- Cancer Research on Prevention and Treatment, 2016, 43(01): 6-10
- http://www.zlfzyj.com/CN/10.3971/j.issn.1000-8578.2016.01.002
-
文章历史
- 收稿日期: 2015-03-13
- 修回日期: 2015-05-18
2. 445000 恩施,湖北省恩施市中心医院五官科
2. Department of Otolaryngology-Head & Neck Surgery, The Central Hospital of Enshi Autonomous Prefecture, Enshi 445000, China
近几年的研究发现,表观遗传修饰在肿瘤发生、发展中具有非常重要的作用[1]。表观遗传调控可以影响基因转录活性而不涉及DNA序列的改变。DNA甲基化水平紊乱,是人类肿瘤最常见的表观遗传改变[2]。5-氮杂胞嘧啶核苷(5-Azacytidine,5-Aza-C)是一种特异性的甲基转移酶抑制剂,它通过与DNA甲基转移酶共价结合,降低酶生物活性,可以降低DNA甲基化水平并使染色体的结构松散,从而影响基因的表达[3]。 临床上,5-Aza-C被应用于治疗急性白血病、骨髓增生异常综合征等血液系统的肿瘤性疾病[4, 5]。
端粒酶的主要功能是合成端粒重复序列TTAGGG加至染色体末端的端粒,从而维持染色体末端的稳定[6]。端粒酶的活化是使细胞获得无限增殖能力成为永生化细胞的关键因素[7]。其中hTERT是端粒酶活性的限速决定因素[8],其表达水平与端粒酶活性相一致[9]。研究表明,端粒DNA不能被甲基化,而端粒重复序列临近的亚端粒区DNA则大量甲基化[10]。Ng等[11]研究表明亚端粒区甲基化水平的增加可能增加端粒酶活性。
我们的前期研究结果表明,端粒酶活性、端粒长度改变在头颈肿瘤发生过程起了重要作用[12]。在头颈肿瘤的发生过程中,均存在表观遗传修饰的改变及端粒结构、功能的异常[13]。本研究中以鼻咽癌细胞系为研究对象,采用甲基化特异性PCR(methylation-specific PCR,MSP)检测亚端粒区D4Z4甲基化修饰状态,并观察5-Aza-C干预对亚端粒区DNA甲基化状态、hTERT基因表达及端粒酶活性的影响,从表观遗传学的角度探讨鼻咽癌发生的分子机制,同时为鼻咽癌的诊断和治疗提供理论依据。
1 材料与方法 1.1 实验材料及主要试剂鼻咽癌CNE、CNE1、CNE2及5-8F细胞系由本实验室保存。RNA提取试剂Trizol(美国Invitrogen公司),反转录-聚合酶链反应(RT-PCR)试剂盒(美国Thermo Scientific公司),10%小牛血清及DMEM细胞培养液(美国Hyclone公司),DNA提取试剂盒(QIAamp DNA Mini Kit,德国Qiagen公司),EpiTect亚硫酸氢盐试剂盒(法国Qiagen公司),SYBR qPCR试剂盒(日本TaKaRa公司),TRAPeze 端粒酶检测试剂盒(美国Millipore公司)。
1.2 细胞培养鼻咽癌细胞采用10%小牛血清、100 u/ml青霉素、100 μg/ml硫酸链霉素的DMEM培养液,在37oC、5%CO2饱和湿度条件下常规培养,选用对数生长期的细胞进行实验。细胞培养瓶中分别加入含不同浓度(0、1、2.5 μmol/L)5-Aza-C的培养液,分别在24及48 h后更换相同浓度的加药培养液,于72 h后收集细胞,进行实验。以未加5-Aza-C干预的鼻咽癌细胞为对照组。
1.3 MSP法检测亚端粒区D4Z4甲基化细胞处理同1.2,按照说明书提取细胞DNA,并用紫外分光光度计测定DNA浓度,经亚硫酸盐处理后,回收DNA,并进行扩增,扩增引物为:上游引物5’-GTTTGTTGTTGGATGAGTTTTTGG-3’,下游引物 5’-AAATCTCTCACCRAACCTAAACC-3’。按照说明书,将扩增的产物进行琼脂糖凝胶电泳,回收扩增产物连接pMD18-T载体,提取质粒后各组选取5个克隆位点进行测序,测量甲基化状态。
1.4 RT-PCR检测hTERT mRNA水平细胞处理同1.2,根据操作说明用Trizol试剂提取总RNA,并用紫外分光计测定其浓度。hTERT反转录引物为:上游5’-AAGTTTGGAAGAAC CCCACATT-3’ ,下游5’-AGGATGGTCTTGAAG TCTGAGG-3’;反转录条件为:37℃ 2 h,70℃ 10 min。应用SYBR qPCR试剂盒扩增,hTERT PCR扩增:95℃预变性10 min,95℃ 15 min,58℃ 15 s,72℃ 45 s,40个循环,结束反应 。 PCR产物进行琼脂糖凝胶电泳,凝胶经胶片曝光后,采用Scion图像分析软件对结果进行分析,各组实验重复3次。
1.5 TRAP法检测端粒酶活性收集处理后的细胞,依照TRAPeze 端粒酶检测试剂盒说明书进行细胞处理。端粒酶自带模板将端粒重复序列(TTAGGG)加到生物素标记人工合成的P1-TS引物的3’端,经PCR反复扩增P1-TS和P2引物间的特异产物,产生含有端粒特异的六核苷酸重复序列的PCR产物。PCR反应条件:30℃孵育30 min,94℃ 30 s,59℃ 30 s,72℃ 1 min进行36个循环,72℃ 1 min延伸。扩增产物进行 10%的非变性聚丙烯酰胺凝胶电泳,然后应用溴化乙锭对凝胶进行染色,最后进行胶片曝光。重复检测3次。
1.6 统计学方法采用Graph Pad Prism 5(Graph Pad)统计软件进行分析,实验结果以均数±标准差(x±s)表示,组间比较用方差分析,P<0.05为差异有统计学意义。
2 结果 2.1 5-Aza-C处理后鼻咽癌细胞亚端粒区甲基化水平降低四株鼻咽癌细胞系的亚端粒区D4Z4上均检测到不同程度的DNA甲基化,甲基化水平约在35%~48%之间,但四种细胞之间的甲基化水平无明显差异。2.5 μmol/L 5-Aza-C处理后,亚端粒区D4Z4序列的甲基化水平明显下降,约在15%~20%之间,与处理前的甲基化水平相比差异均有统计学意义(CNE、CNE1、CNE2、5-8F的P值分别为0.006、0.004、0.008、0.005),见图 1。
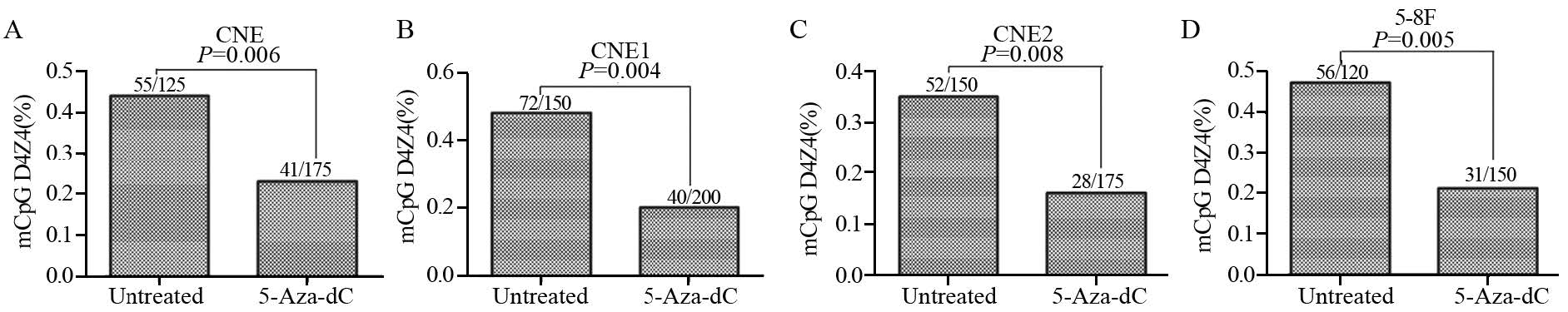
|
| There was partial methylation at the subtelomeric region D4Z4 repeats in the nasopharyngeal carcinoma(NPC) cell lines. The level of methylation was generally high (35%-48%), but not statistically different among four cell lines. 5-Aza-C significantly decreased DNA methylation levels at the D4Z4 repeats of subtelomeric region 图 1 5-Aza-C处理前后鼻咽癌细胞亚端粒区DNA甲基化水平 Figure 1 Subtelomeric region DNA methylation levels in NPC cell lines before and after 5-Aza-C treatment |
应用RT-PCR法,以β-actin作参照,检测四株细胞系hTERT mRNA的表达水平。结果显示,四株鼻咽癌细胞在处理前hTERT mRNA电泳呈强阳性条带,2.5 μmol/L 5-Aza-C处理后,hTERT mRNA的表达明显下调,呈弱阳性条带,(CNE、CNE1、CNE2、5-8F的P值分别为0.005、0.004、0.007、0.006)而1 μmol/L 5-Aza-C处理后的hTERT mRNA的表达无明显改变,见图 2。
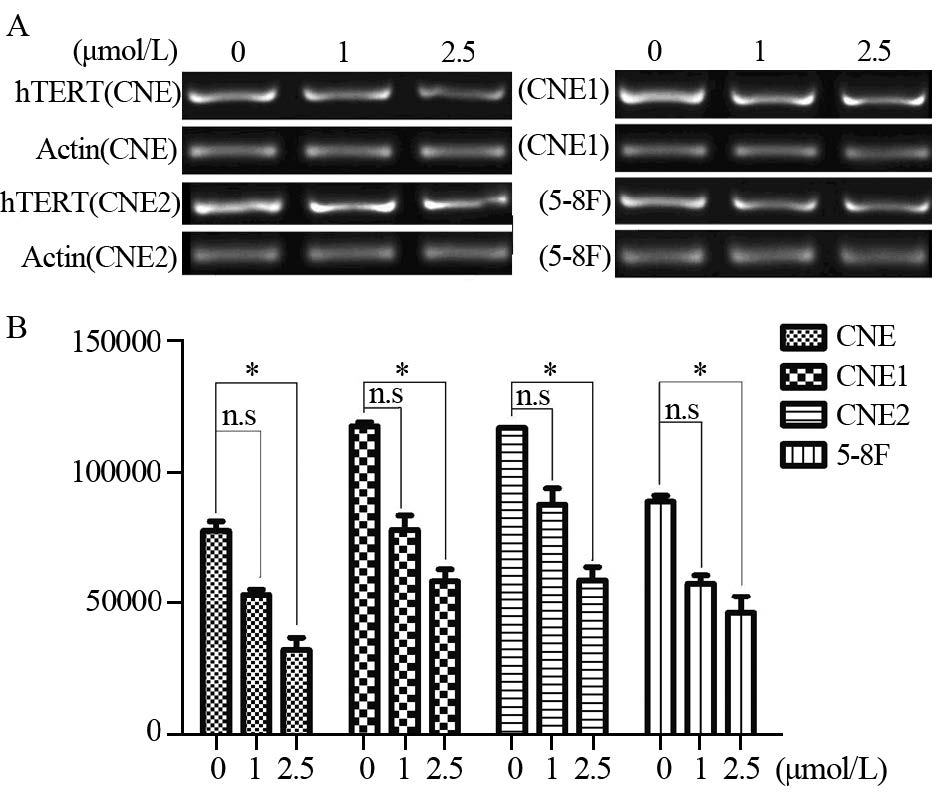
|
| The electrophoresis band of hTERT mRNA in four NPC cell lines showed strong positive strip before treatment. There was significantly decreased hTERT expression following treatment with 2.5μmol/L 5-Aza-C, but not 1μmol/L 5-Aza-C, even though weakened expression signals were observed for both concentrations (*: P=0.005, 0.004, 0.007, 0.006 for CNE, CNE1, CNE2, 5-8F respectively) 图 2 5-Aza-C处理前、后鼻咽癌细胞的hTERT mRNA表达 Figure 2 Expression of hTERT mRNA in NPC cell lines before and after 5-Aza-C treatment |
应用半定量的TRAP法检测处理前后鼻咽癌细胞系中的端粒酶活性。结果表明2.5 μmol/L 5-Aza-C作用后,四种鼻咽癌细胞端粒酶活性显著抑制(CNE、CNE1、CNE2、5-8F的P值分别为0.004、0.008、0.007、0.005),见图 3。
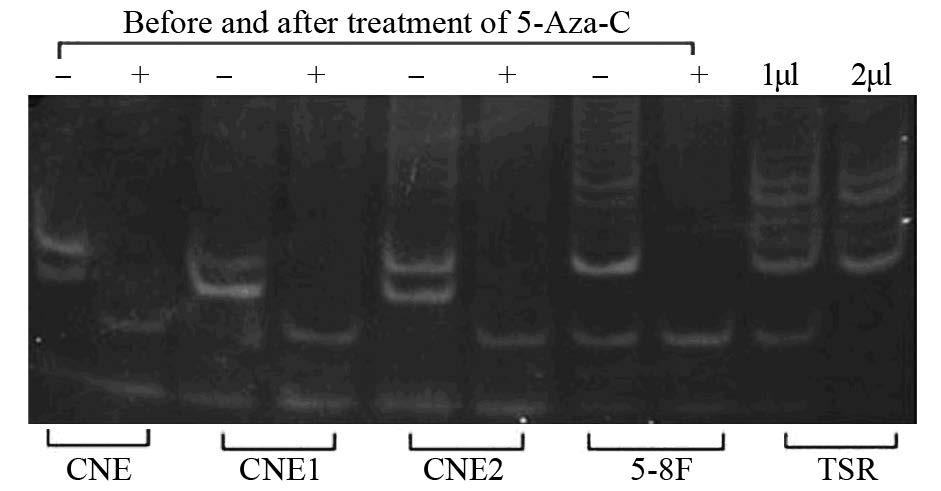
|
| Telomerase activity levels were quantified using the TRAP assay. -: the telomeric repeat band of NPC cell lines before treatment; +: the telomeric repeat band of NPC cell lines after the treatment with 2.5μmol/L 5-Aza-C in four NPC cell lines. TSR was positive control. Separated 6bp ladder banding on the gel electrophoresis represented positive result, the intensity and quality represented the telomerase activity. Telomerase activity was strongly repressed in four cell lines treated with 2.5μmol/L 5-Aza-C (P=0.004, 0.008, 0.007, 0.005 for CNE, CNE1, CNE2, 5-8F respectively); TSR: thrombospondin type I repeat 图 3 5-Aza-C处理前、后鼻咽癌细胞系的端粒酶活性 Figure 3 Telomerase activity in NPC cell lines before and after 5-Aza-C treatment |
鼻咽癌在中国南方和国外中国南方移民及后裔中发病率极高,尤其是中国南方广东省,鼻咽癌发病率较欧美等其他地区高25~30倍[14, 15]。鼻咽癌的发病机制至今仍不明确,提示人们并未认识其本质,有必要寻找新的视角及突破口来重新认识头颈肿瘤的发生机制。过去人们一直认为基因突变对肿瘤的形成具有非常重要的作用,并相继发现了许多癌基因和抑制基因。然而肿瘤并不仅仅是因为基因改变所致,外界环境等诸多因素也均参与了肿瘤的发生、发展。肿瘤细胞的表观遗传学改变比肿瘤细胞的基因突变更早,肿瘤的最早发生可能源自干细胞阶段的表观遗传学改变,DNA甲基化状态改变可发生于细胞恶变之前[2]。近年来,研究者们开展了对鼻咽癌的表观遗传改变研究,特别是启动子甲基化修饰研究[16, 17, 18],这些基因的改变与细胞周期、凋亡相关,可能导致肿瘤细胞生长受抑制。
端粒酶的异常表达与恶性肿瘤的发生、发展、预后密切相关。在恶性肿瘤中,端粒酶活性明显增高,以延长端粒,弥补因细胞分裂而造成的端粒缩短,从而使细胞无限增殖恶化,而其催化亚基hTERT基因是合成端粒酶全酶的限速因素,与肿瘤的关系更为密切[8, 9]。调节hTERT表达的各种因素对端粒酶的表达有不同的影响,这些因素在肿瘤发生、发展的不同时期的作用可能一直在变化。
研究表明,肿瘤细胞的端粒酶活性受亚端粒区的甲基化状态的影响[11]。用去甲基化药物干预后,肿瘤细胞的hTERT基因表达、端粒酶活性会发生一定的改变。Bechter等[19]研究表明,在一部分B细胞慢性淋巴细胞性白血病的患者中,hTERT启动子CpG岛的甲基化程度与端粒酶活性密切相关,改变CpG岛的甲基化程度可能调节hTERT基因表达和端粒酶活性。Kitagawa等[20]研究表明,在前列腺肿瘤中,应用去甲基化药物5-Aza-C可能通过抑制hTERT转录,从而下调端粒酶活性。Dessain等[21]研究则表明,在不同的肿瘤细胞中,hTERT启动子CpG岛表现出不同程度的甲基化,虽然5-Aza-C可以下调hTERT基因的表达,然而hTERT启动子的CpG岛甲基化程度与端粒酶活性之间并没有明显的相关性。Zhang等研究结果表明,在AML细胞系和原代白血病细胞中,5-Aza-C可下调hTERT基因表达,导致细胞DNA受损和细胞凋亡,而对亚端粒区甲基化状态无影响[22]。
上述研究表明,尽管5-Aza-C的抗肿瘤作用机制尚不完全明了,但它可使异常甲基化基因发生去甲基化改变的作用却是肯定的,在不同的肿瘤细胞中,5-Aza-C对端粒酶活性影响的作用机制不同。与Bechter等[19]及Kitagawa等[20]研究结果类似,在本研究中亚端粒区D4Z4序列的甲基化水平下降后,鼻咽癌细胞的hTERT基因表达下调,端粒酶活性下降。5-Aza-C可能是通过下调鼻咽癌细胞的hTERT mRNA的表达,从而抑制端粒酶活性的。
在鼻咽癌的发生中,亚端粒区的DNA甲基化水平紊乱起了一定的作用,去甲基化药物5-Aza-C能下调hTERT表达,抑制端粒酶活性。鼻咽癌亚端粒区CpG岛甲基化状态对hTERT的表达和端粒酶活性有重要影响。5-Aza-C抑制端粒酶活性、下调hTERT表达的具体机制,本研究中尚未涉及,仍有待进一步研究。
| [1] | Rodríguez-Paredes M, Esteller M. Cancer epigenetics reaches mainstream oncology[J]. Nat Med, 2011, 17(3): 330-9. |
| [2] | De Carvalho DD, Sharma S, You JS, et al. DNA methylation screening identifies driver epigenetic events of cancer cell survival[J]. Cancer Cell, 2012, 21(5): 655-67. |
| [3] | Patra SK, Bettuzzi S. Epigenetic DNA-(cytosine-5-carbon) modifications: 5-Aza-2’-deoxycytidine and DNA-demethylation[J]. Biochemistry (Mosc), 2009, 74(6): 613-9. |
| [4] | Passweg JR, Pabst T, Blum S, et al. Azacytidine for acute myeloid leukemia in elderly or frail patients: a phaseⅡtrial (SAKK 30/07)[J]. Leuk Lymphoma, 2014, 55(1): 87-91. |
| [5] | Strati P, Kantarjian H, Ravandi F, et al. Phase Ⅰ/Ⅱ trial of the combination of midostaurin (PKC412) and 5-azacytidine for patients with acute myeloid leukemia and myelodysplastic syndrome[J]. Am J Hematol, 2015, 90(4): 276-81. |
| [6] | Low KC, Tergaonkar V. Telomerase: central regulator of all of the hallmarks of cancer[J]. Trends Biochem Sci, 2013, 38(9): 426-34. |
| [7] | Mocellin S, Pooley KA, Nitti D. Telomerase and the search for the end of cancer[J]. Trends Mol Med, 2013, 19(2): 125-33. |
| [8] | Lamy E, Goetz V, Erlacher M, et al. hTERT: another brick in the wall of cancer cells[J]. Mutat Res, 2013, 752(2): 119-28. |
| [9] | M Daniel, Peek GW, Tollefsbol TO. Regulation of the human catalytic subunit of telomerase (hTERT)[J]. Gene, 2012, 498(2): 135-46. |
| [10] | Schoeftner S, Blasco MA. Chromatin regulation and non-coding RNAs at mammalian telomeres[J].Semin Cell Dev Biol, 2010, 21(2): 186-93. |
| [11] | Ng LJ, Cropley JE, Pickett HA, et al. Telomerase activity is associated with an increase in DNA methylation at the proximal subtelomere and a reduction in telomeric transcription[J]. Nucleic Acids Res, 2009, 37(4): 1152-9. |
| [12] | Wang Y, Duan HG, Chen SM, et al. Effect of RNA interference targeting human telomerase reverse transcriptase on telomerase and its related protein expression in nasopharyngeal carcinoma cells[J]. J Laryngol Otol, 2007, 121(5): 476-82. |
| [13] | Worsham MJ, Chen KM, Meduri V, et al. Epigenetic events of disease progression in head and neck squamous cell carcinoma[J].Arch Otolaryngol Head Neck Surg, 2006, 132(6): 668-77. |
| [14] | Hutajulu SH, Indrasari SR, Indrawati LP, et al. Epigenetic markers for early detection of nasopharyngeal carcinoma in a high risk population[J]. Molecular Cancer, 2011, 10(48): 1-9. |
| [15] | Chang ET, Adami HO. The enigmatic epidemiology of nasopharyngeal carcinoma[J]. Cancer Epidemiol Biomarkers Prev, 2006, 15(10): 1765-5. |
| [16] | Li LL, Shu XS, Wang ZH, et al. Epigenetic disruption of cell signaling in nasopharyngeal carcinoma[J]. Chin J Cancer, 2011, 30(4): 231-9. |
| [17] | Loyo M, Brait M, Kim MS, et al. A survey of methylated candidate tumor suppressor genes in nasopharyngeal carcinoma[J]. J Cancer, 2011, 128(6): 1393-403. |
| [18] | Saito M, Nishikawa J, Okada T, et al. Role of DNA methylation in the development of Epstein-Barr virus associated gastric carcinoma[J]. J Med Viol, 2013, 85(1): 121-7. |
| [19] | Bechter OE, Eisterer W, Dlaska M, et al. CpG island methylation of the hTERT promoter is associated with lower telomerase activity in B-cell lymphocytic leukemia[J]. Exp Hematol, 2002, 30(1): 26-33. |
| [20] | Kitagawa Y, Kyo S, Takakura M, et al. Demethylating reagent 5-azacytidine inhibits telomerase activity in human prostate cancer cells through transcriptional repression of hTERT[J]. Clin Cancer Res, 2000, 6(7): 2868-75. |
| [21] | Dessain SK, Yu H, Reddel RR, et al. Methylation of the human telomerase gene CpG island[J]. Cancer Res, 2000, 60(3): 537-41. |
| [22] | Zhang X, Li B, de Jonge N, et al. The DNA methylation inhibitor induces telomere dysfunction and apoptosis of leukemia cells that is attenuated by telomerase over-expression[J]. Oncotarget, 2015, 6(7): 4888-900. |
 2016, Vol. 43
2016, Vol. 43


