文章信息
- 刘咏梅,赵倩,唐源,张衍,李艳莹,王永生,卢铀. 2015.
- LIU Yongmei, ZHAO Qian, TANG Yuan, ZHANG Yan, LI Yanying, WANG Yongsheng, LU You. 2015.
- EGFR-TKI治疗EGFR敏感突变的晚期肺鳞癌的疗效分析
- Efficacy of Epidermal Growth Factor Receptor-Tyrosine Kinase Inhibitors for Advanced Squamous Cell Lung Carcinoma Patients with Sensitive EGFR Mutations
- 肿瘤防治研究, 2015, 42(09): 911-914
- Cancer Research on Prevention and Treatment, 2015, 42(09): 911-914
- http://www.zlfzyj.com/CN/10.3971/j.issn.1000-8578.2015.09.011
-
文章历史
- 收稿日期:2014-09-25
- 修回日期:2015-01-08
2. 610041 成都,四川大学华西医学中心临床医学院;
3. 610041 成都,四川大学华西医院病理科
2. West China School of Medicine, Sichuan University, Chengdu 610041, China;
3. Department of Pathology, West China Hospital, Sichuan University, Chengdu 610041, China
表皮生长因子受体络氨酸激酶抑制剂(epidermal growth factor receptor-tyrosine kinase inhibitor,EGFR-TKI)在EGFR敏感突变的晚期非小细胞肺癌(non-small cell lung cancer,NSCLC)治疗中的价值已得以充分证实,有效率可达70%~85%,PFS为8~13月[1, 2, 3, 4],已被批准用于这类患者的一线治疗。但临床实践和研究中,大部分突变且EGFR-TKI受益的患者为肺腺癌,EGFR-TKI治疗NSCLC的疗效大多也来自肺腺癌患者。肺鳞癌患者EGFR基因突变率较低,亦有研究显示,病理类型会影响肿瘤对EGFR-TKI的敏感度,如EGFR敏感突变的小细胞肺癌和上皮向间叶转化的肿瘤对EGFR-TKI耐药[5, 6]。目前EGFR敏感突变的晚期肺鳞癌对EGFR-TKI的疗效如何,有关报道尚少。因此,我们对20例在四川大学华西医院接受EGFR-TKI治疗的EGFR敏感突变的晚期肺鳞癌患者进行回顾性研究,以探讨EGFR-TKI对这部分患者的临床治疗价值。
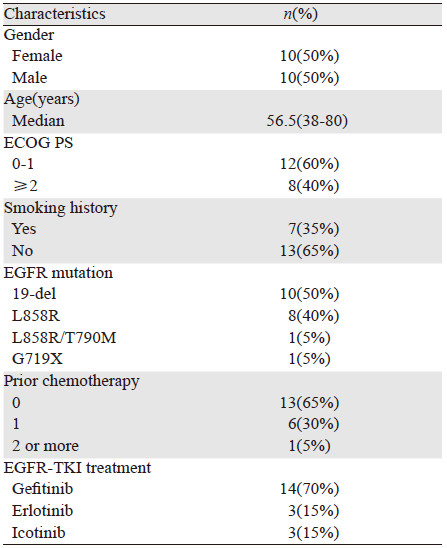
1 资料和方法 1.1 研究对象收集我院2010年1月—2014年6月间经病理确诊的Ⅳ期或术后复发转移的肺鳞癌患者。主要入组标准:病理类型为鳞癌;接受过EGFR基因检测,并存在敏感突变;在治疗过程中接受过EGFR-TKI治疗;在开始接受EGFR-TKI治疗时分期为Ⅳ期;有完整的随访资料。剔除标准:EGFR基因检测阴性;因经济原因或无法耐受药物不良反应;EGFR-TKI治疗不足1月及未进行疗效评价者(因疾病进展使用EGFR-TKI治疗不足1月的患者可纳入本研究)。研究共纳入符合入组标准的20例EGFR基因敏感突变的Ⅳ期肺鳞癌患者。ECOG评分0~3分。女10例,男10例,年龄38~80岁,中位年龄56.5岁。20例患者中,7例有吸烟史,13例无吸烟史。其中EGFR-TKI作为一线治疗的患者13例,作为二线治疗的6例,作为三线治疗的1例。14例使用吉非替尼,3例使用厄洛替尼,3例使用埃克替尼。研究纳入的患者特征详见表 1。
应用扩增突变阻滞系统(amplification refractory mutation system,ARMS)对肿瘤组织或体液标本进行EGFR基因检测。
1.3 治疗方法患者每天口服吉非替尼(250 mg/d)、厄洛替尼(150 mg/d)或埃克替尼(125 mg,3次/天)直至病情进展或死亡。
1.4 疗效评价EGFR-TKI的疗效评价,除服药后第1月外,此后每2月进行1次,若治疗期间出现进展症状,随时复查。末次随访时间为2014年9月2日。中位随访时间10.5月(0.5~26.1月)。疗效评价标准采用实体瘤疗效评价标准(Response Evaluation Criteria in Solid Tumors,RECIST1.0)。分为完全缓解(CR)、部分缓解(PR)、稳定(SD)和进展(PD)。以CR+PR计算客观缓解率(ORR),CR+PR+SD计算疾病控制率(DCR)。无进展生存期(progression-free survival,PFS)定义为从开始EGFR-TKI治疗至疾病进展或死亡,或至最后一次随访。生存期(overall survival,OS)定义为从患者诊断开始,直至死亡或最后一次随访。
1.5 统计学方法采用SPSS19.0软件包进行统计分析。用Kaplan-Meier法进行生存分析。用卡方检验比较EGFR-TKI对不同EGFR状态患者的疾病缓解率和疾病控制率,P>0.05为差异有统计学意义。
2 结果 2.1 基因突变分析20例患者的检测标本均来源于新鲜肿瘤组织或石蜡切片。其中10例患者检出存在外显子19(19-del)突变(50%),8例检出外显子21(L858R)点突变(40%),检测还发现1例同时存在外显子21(L858R)点突变和外显子20(T790M)突变(5%),还有1例存在外显子18(G719X)突变(5%)。
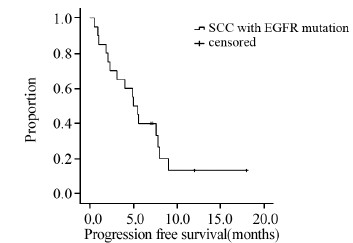
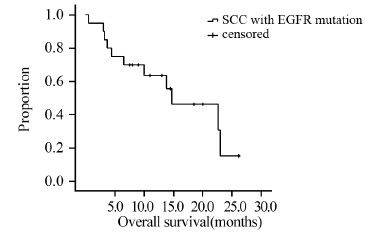
2.2 临床疗效分析接受EGFR-TKI治疗的20例患者,完全缓解(CR)0例,部分缓解(PR)9例,疾病稳定(SD)7例,疾病进展(PD)4例。客观缓解率(ORR)45%,疾病控制率80%。截至最后随访日期(2014年9月2日),4例患者尚未进展,中位无进展生存期(mPFS)为5.0月(95%CI:3.7~6.3),见图 1。11例患者死亡,9例患者存活,中位生存期(mOS)为14.7月(95%CI:5.5~23.9),见图 2。
|
| 图 1 20例EGFR基因敏感突变的肺鳞癌患者的PFS曲线 Figure 1 Progression free survival(PFS) curve of 20 squamous cell lung carcinoma patients with EGFR mutation |
|
| 图 2 20例EGFR基因敏感突变的肺鳞癌患者的OS曲线 Figure 2 Overall survival(OS) curve of 20 squamous cell lung carcinoma patients with EGFR mutation |
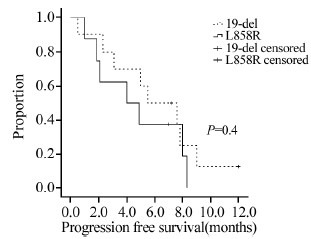
10例19-del缺失的患者PR 6例,SD 3例,PD 1例;8例L858R点突变的患者PR 3例,SD 3例,PD 2例,两组患者的疾病缓解率分别为60%和37.5%(P=0.64),疾病控制率分别为90%和75%(P=0.83)。19-del缺失患者的中位PFS(5.5月)略长于L858R点突变患者的中位PFS(4.0月),但差异无统计学意义,见图 3;1例L858R/T790M突变患者疗效评价PD;1例G719X突变患者疗效评价SD。
|
| 图 3 外显子19与外显子21突变患者的PFS生存曲线 Figure 3 Progression free survival(PFS) curves of squamous cell lung carcinoma patients with 19-Del and L858R mutation |
EGFR-TKI目前推荐为EGFR敏感突变的晚期非小细胞肺癌的标准一线治疗。肺鳞癌是非小细胞肺癌的常见类型之一,但其EGFR突变率较低,为1%~15%[7, 8, 9, 10],亚裔人群的突变高于欧美人群。EGFR-TKI对敏感突变的晚期肺鳞癌疗效如何,能否取得与肺腺癌相似的疗效,文献报道的数据较少。
肺鳞癌的发生大多与吸烟相关,本研究中EGFR敏感突变的晚期肺鳞癌患者65%无吸烟史,提示无吸烟史可能是肺鳞癌患者EGFR突变的临床特征之一。本研究EGFR突变类型外显19(19-del)突变占50%,外显子21(L858R)突变占40%,1例同时存在外显子21(L858R)点突变和外显子20(T790M)突变(5%),还有1例存在外显子18 G719X突变(5%),与文献报道[11]相似。
Shukuya等[12]利用PubMed数据,在15项有关吉非替尼的临床研究中提取非腺癌患者进行分析,其中15例EGFR突变鳞癌患者的缓解率为27%,疾病控制率为67%~70%,中位PFS为3.1月。Hata[13]等报道了EGFR敏感突变,接受EGFR-TKI治疗的20例鳞癌患者,18例可评估疗效,缓解率为25%,疾病控制率50%,中位PFS为1.4月,中位OS为14.9月。国内Fang等[14]报道了15例EGFRR突变阳性,接受EGFR-TKI治疗的患者,缓解率为26.7%,疾病控制率66.7%,中位PFS为3.9月。国内段建春等[15]报道组织标本基因检测阳性的23例晚期肺鳞癌患者,中位PFS为5.0月,中位OS为12.6月。本研究纳入20例EGFR敏感突变的晚期肺鳞癌患者,均可评价疗效,随访数据完整,是现有报道中病例数较多的研究。本研究结果显示,缓解率为45%,疾病控制率为80%,中位PFS为5.0月,中位OS为14.7月。
外显子19缺失突变和外显子21点突变是非小细胞肺癌EGFR敏感突变的两种经典类型。研究报道,相对于外显子21 的L858R突变,外显子19的缺失突变对EGFR-TKI的疗效反应更好一些[16, 17]。本研究对这两类突变类型的患者EGFR-TKI治疗的疗效进行了分析,结果显示,外显子19缺失患者的中位PFS(5.5月)略长于外显子21点突变患者的中位PFS(4.0月)。两组患者的疾病缓解率分别为60%和37.5%,疾病控制率分别为90%和75%。外显子19缺失突变的患者疾病缓解率和疾病控制率有高于外显子21点突变患者的趋势,但因样本量较小,未达统计学差异。
研究数据显示,厄洛替尼治疗肺鳞癌患者比吉非替尼的疗效更高,有学者推测可能与厄洛替尼的血药浓度高于吉非替尼有关[18]。本研究因14例患者使用吉非替尼,只有3例患者使用厄洛替尼,3例患者使用埃克替尼,无法对不同EGFR-TKI对晚期EGFR敏感突变肺鳞癌患者的疗效进行比较,期待扩大病例数的研究。
多项研究显示,EGFR敏感突变的晚期肺腺癌,EGFR-TKIs治疗的缓解率可达70%~85%,中位PFS为8~13月,本研究中,EGFR突变鳞癌患者的缓解率为45%,中位PFS为5.0月,EGFR敏感突变的肺鳞癌患者应用EGFR-TKI的疗效不及EGFR敏感突变的肺腺癌患者。其原因可能与肺鳞癌中存在其他肿瘤基因驱动机制有关。EGFR下游信号通路磷酸化磷脂酰肌醇催化亚单位A抗体/蛋白激酶B(PI3K/Akt)的突变及高拷贝数更多见于肺鳞癌患者[19, 20, 21]。也有研究显示,PIK3CA与EGFR突变为非排他性,二者共存可能导致对吉非替尼的耐药[22]。可以推测EGFR下游的基因突变可能是EGFR敏感突变非腺癌患者EGFR-TKI疗效欠佳的原因。因此,治疗前,对肿瘤组织标本进行KRAS、PI3KCA、MET和非敏感突变EGFR基因的综合检测是有必要的。
我国肺鳞癌患者中EGFR突变的发生率文献报道为3%~20%[15]。尽管EGFR-TKI对EGFR敏感突变的肺鳞癌患者的疗效不及肺腺癌患者,但大多数EGFR敏感突变的肺鳞癌患者还是可从EGFR-TKI的治疗中获益,因此,在临床工作中,应重视对肺鳞癌患者的EGFR基因检测,以便明确获益的患者。同时,也需考虑患者的临床特征,如是否有吸烟史、病理分化等。尽管本研究是回顾性研究,样本量较小,得到的RR、PFS和OS存在一定的偏倚,但提供了有关EGFR敏感突变患者接受EGFR-TKI的疗效信息,能为临床带来一定的参考价值。我们期待针对EGFR敏感突变肺鳞癌患者的前瞻性、扩大病例数的研究,以期为这部分患者提供证据力度更高的治疗方案。
| [1] | Zhou C, Wu YL, Chen G, et al. Erlotinib versus chemotherapy as first-line treatment for patients with advanced EGFR mutation-positive non-smallcell lung cancer (OPTIMAL, CTONG-0802): a multicentre, open-label, randomised, phase 3 study[J]. Lancet Oncol, 2011, 12(8): 735-42. |
| [2] | Mitsudomi T, Morita S, Yatabe Y, et al. Gefitinib versus cisplatin plus docetaxel in patients with non-small-cell lung cancer harbouring mutations of the epidermal growth factor receptor (WJTOG3405): an open label, randomised phase 3 trial[J]. Lancet Oncol, 2010, 11(2): 121-8. |
| [3] | Rosell R, Carcereny E, Gervais R, et al. Erlotinib versus standard chemotherapy as first-line treatment for European patients with advanced EGFR mutation-positive non-small-cell lung cancer (EURTAC): a multicentre, open-label, randomised phase 3 trial[J]. Lancet Oncol, 2012, 13(3): 239-46. |
| [4] | Maemondo M, Inoue A, Kobayashi K, et al. Gefitinib or chemotherapy for non-small-cell lung cancer with mutated EGFR[J]. N Engl J Med, 2010, 362(25): 2380-8. |
| [5] | Arcila ME, Oxnard GR, Nafa K, et al. Rebiopsy of lung cancer patients with acquired resistance to EGFR inhibitors and enhanced detection of the T790M mutation using a locked nucleic acid-based assay[J]. Clin Cancer Res, 2011, 17(5): 1169-80. |
| [6] | Uramoto H, Iwata T, Onitsuka T, et al. Epithelial-mesenchymal transition in EGFR-TKI acquired resistant lung adenocarcinoma[J]. Anticancer Res, 2010, 30(7): 2513-7. |
| [7] | Huang SF, Liu HP, Li LH, et al. High frequency of epidermal growth factor receptor mutations with complex patterns in non-small cell lung cancers related to gefitinib responsiveness in Taiwan[J]. Clin Cancer Res, 2004, 10(24): 8195-203. |
| [8] | Ohtsuka K, Ohnishi H, Fujiwara M, et al. Abnormalities of epidermal growth factor receptor in lung squamous-cell carcinomas, adenosquamous carcinomas, and large-cell carcinomas: Tyrosine kinase domain mutations are not rare in tumors with an adenocarcinoma component[J]. Cancer, 2007, 109(4): 741-50. |
| [9] | Park SH, Ha SY, Lee JI, et al. Epidermal growth factor receptor mutations and the clinical outcome in male smokers with squamous cell carcinoma of lung[J]. J Korean Med Sci, 2009, 24(3): 448-52. |
| [10] | Miyamae Y, Shimizu K, Hirato J, et al. Significance of epidermal growth factor receptor gene mutations in squamous cell lung carcinoma[J]. Oncol Rep, 2011, 25(4): 921-8. |
| [11] | Mitsudomi T, Yatabe Y. Mutations of the epidermal growth factor receptor gene and related genes as determinants of epidermal growth factor receptor tyrosine kinase inhibitors sensitivity in lung cancer[J]. Cancer Sci, 2007, 98(12): 1817-24. |
| [12] | Shakuya T, Takahashi T, Kaira R, et al. Efficacy of gefitinib for non-adenocarcinoma non-small cell lung cancer patients harboring epidermal growth factor receptor mutations: a pooled analysis of published reports[J]. Cancer Sci, 2011, 102(5): 1032-37. |
| [13] | Hata A, Katakami N, Yoshioka H, et al. How sensitive are epidermal growth factor receptor-tyrosine kinase inhibitors for squamous cell carcinoma of the lung harboring EGFR gene-sensitive mutations?[J]. J Thorac Oncol, 2013, 8(1): 89-95. |
| [14] | Fang W, Zhang J, Liang W, et al. Efficacy of epidermal growth factor receptor-tyrosine kinase inhibitors for Chinese patients with squamous cell carcinoma of lung harboring EGFR mutation[J]. J Thorac Dis, 2013, 5(5): 585-92. |
| [15] | Duan JC, An TT, Wu MN, et al. Correlation between the efficacy of epidermal growth factor receptor tyrosine kinase inhibitors and EGFR mutations in advanced squamous cell lung cancer[J]. Zhonghua Jie He He Hu Xi Za Zhi, 2012, 35(5): 323-8.[段建春, 安彤同, 吴梅娜, 等. 晚期肺癌表皮生长因子受体突变与其抑制剂疗效的关系[J]. 中华结核和呼吸杂志, 2012, 35(5): 323-8.] |
| [16] | Mitsudomi T, Kosaka T, Endoh H, et al. Mutations of the epidermal growth factor receptor gene predict prolonged survival after gefitinib treatment in patients with non-small-cell lung cancer with postoperative recurrence[J]. J Clin Oncol, 2005, 23(11): 2513-20. |
| [17] | Jackaman DM, Yeap BY, Sequist LV, et al. Exon 19 deletion mutations of epidermal growth factor receptor are associated with prolinged survival in non-small cell lung cancer patients treated with gefitinb or erlotinib[J]. Clin Cancer Res, 2006, 12(13): 3908-14. |
| [18] | Kim ES, Hirsh V, Mok T, et al. Gefitinib versus docetaxel in previously treated non-small cell lung cancer(INTEREST): a randomized phaseⅢtrial[J]. Lancet, 2008, 372(9652): 1809-18. |
| [19] | Kawano O, Sasaki H, Endo K, et al. PIK3CA mutation status in Japanese lung Cancer patients[J]. Lung Cancer, 2006, 54(2): 209-15. |
| [20] | Yamamoto H, Shigematsu H, Nomura M, et al. PIK3CA mutations and copy number gains in human lung cancers[J]. Cancer Res, 2008, 68(17): 6913-21. |
| [21] | Lee SY, Kim MJ, Jin G, et al. Somatic mutations in epidermal growth factor receptor signaling pathway genes in non-small cell lung cancers[J]. J Thorac Oncol, 2010, 5(11): 1734-40. |
| [22] | Ludovini V, Bianconi F, Pistola L, et al. Optimization of patient selection for EGFR-TKIs in advanced non-small cell lung cancer by combined analysis of KRAS, PIK3CA, MET, and non-sensitizing EGFR mutations[J]. Cancer Chemother Pharmacol, 2012, 69(5): 1289-99. |
 2014, Vol. 42
2014, Vol. 42