文章信息
- 毕炀辉,崔鹤洋,张玲,程彩霞,宋彬,师如意,杨斌,王芳,贾志武,赵振祥,刘静. 2015.
- BI Yanghui,CUI Heyang,ZHANG Ling,CHENG Caixia,SONG Bin,SHI Ruyi,YANG Bin,WANG Fang,JIA Zhiwu,ZHAO Zhenxiang,LIU Jing. 2015.
- 黑色素瘤中癌基因B-RafV600E对B-Raf/ERK/Mps1负反馈抵抗作用的机制
- Mechanism of Oncogenic B-RafV600E Abrogates B-Raf/ERK/Mps1 Signaling Pathway in Melanoma Cells
- 肿瘤防治研究, 2015, 42(09): 867-871
- Cancer Research on Prevention and Treatment, 2015, 42(09): 867-871
- http://www.zlfzyj.com/CN/10.3971/j.issn.1000-8578.2015.09.002
-
文章历史
- 收稿日期:2014-09-19
- 修回日期:2014-11-14
2.030001太原,山西医科大学第一临床医学院普通外科
2.Department of General Surgery,The First Hospital of Shanxi Medical University,Taiyuan 030001,China
RAS/RAF/MEK/ERK信号通路参与了细胞的生长、增殖和分化,与人类肿瘤的发生密切相关[1]。B-Raf是一种丝/苏氨酸激酶,是MEK/ERK强有力的激活剂,它在整个细胞周期以及有丝分裂的关键时期通过多种机制促进细胞增殖。资料表明,人类7%的肿瘤存在B-Raf的体细胞突变,其中恶性黑色素瘤突变率最高,可达70%[2, 3]。目前,已经有超过70个B-Raf基因的错义突变被证实,其中,90%的点突变为T1796A,该点突变导致缬氨酸被谷氨酸所代替(V600E),称为B-RafV600E。该基因在体外激酶活性是野生型的500 倍,可持续激活MEK/ERK信号通路,导致细胞过度增殖,出现恶性转化[4]。Mps1又名单极纺锤体蛋白激酶1,是纺锤体检测点复合物中的一员,为B-Raf的作用底物之一,B-RafV600E通过磷酸化Mps1-S281、S436、S821,分别影响Mps1激酶的蛋白质稳定性、激酶活性、着丝粒定位能力等,进而导致中心体过度复制、多极纺锤体出现,参与黑色素瘤的发生[5, 6]。
我们前期实验表明,Mps1的蛋白表达依赖于B-Raf/MEK/ERK通路,该通路的激活可以增强Mps1的表达;并且,当我们在B-RafWT细胞系中,表达外源性Mps1,ERK活性降低;而敲低内源性Mps1,ERK活性增强,提示Mps1激酶对B-RafWT/MEK/ERK通路存在负反馈调控作用;相反,在B-RafV600E细胞系中,外源性Mps1的表达及内源性Mps1的敲低,均不影响ERK活性,提示癌基因B-RafV600E对上述Mps1和B-Raf/MEK/ERK通路之间的负反馈通路有抵抗作用。但是有关该抵抗作用的具体机制尚不明确。
1 材料与方法 1.1 材料B-Raf野生型SK-MEL-31、Sbcl2和WM35细胞系和B-RafV600E突变型SK-MEL-28、A375细胞系由M. Herlyn(Wistar Institute,Philadelphia, PA)馈赠;B-Raf表达质粒pBabe-puro-GST-B-RafWT、B-RafV600E表达质粒pBabe-puro-GST-B-RafV600E、Mps1表达质粒pBabe-puro-GFP-Mps1-WT和Mps1-KD(无Mps1激酶活性)pBabe-puro-GFP-Mps1-KD均由本室保存;抗phospho-p44/42 MAPK (Thr202/tyr204,E10)单克隆抗体、抗Mps1 N1 单克隆抗体、抗B-Raf多克隆抗体及相应的二抗均购自Sigma公司;Western blot所用发光底物为pierce 公司产品。
1.2 方法 1.2.1 细胞培养Sbcl2细胞和WM35采用2%肿瘤培养液(MCDB15:L15为4:1、2%胎牛血清、5 μg/ml胰岛素、1 mmol/L CaCl2),293T细胞、SK-MEL-31细胞、SK-MEL-28细胞和A375细胞培养在含10%胎牛血清、10 mmol/L Hepes、2 mmol/L L-谷氨酰胺、1 mmol/L MEM丙酮酸钠的DMEM培养液中,37℃、5%CO2培养。
1.2.2 反转录病毒的制备标准磷酸钙法将反转录病毒载体(pBabe-puro-GST-B-RafWT,pBabe-puro-GST-B-RafV600E,pBabe-puro-GFP-Mps1-WT、pBabe-puro-GFP-Mps1-KD)转染293T细胞中包装得到反转录病毒产物:293T细胞达80%左右时进行转染;转染前将表达载体及包装载体按比例共8 μg混合后加入三蒸水至450 μl,再加入50 μl 2.5 mol/L CaCl2,形成DNA/CaCl2混合液;混匀Hepes及DNA/CaCl2混合液,静置20 min形成沉淀,加入293T细胞中;培养6~8 h后,除去培养液,加入6 ml不含双抗的完全培养液培养24~48 h。取上清液过滤,-80℃保存备用。
1.2.3 目的细胞的感染目的细胞(SK-MEL-31、Sbcl2、SK-MEL-28、A375)达70%~80%时弃去培养液,加反转录病毒500 μl(pBabe-puro-GST-B-RafWT,pBabe-puro-GST-B-RafV600E,pBabe-puro-GFP-Mps1-WT、pBabe-puro-GFP-Mps1-KD),加入1~2 ml培养液,培养30min后,补加培养液4~5 ml,轻轻晃动,放入37℃、5%CO2 培养箱中培养;24 h后,换培养液继续培养。24~48 h后收集细胞,裂解,用于Western blot检测各目的蛋白的表达水平。
1.2.4 Western blot检测分别于转染后24、48 h收细胞并裂解细胞内总蛋白,取20 μg 处理后的蛋白样品进行SDS-PAGE电泳并电转移至NC膜,5 g/L 脱脂奶封闭1 h,分别与适当稀释后的一抗孵育1 h、PBST 洗膜,然后与1:4 000二抗孵育1 h,PBST 洗膜后加入发光底物孵育1 min,暗室中用X线片曝光,显影,定影。
2 结果 2.1 Mps1激酶活性对Mps1和B-RafWT/MEK/ERK通路之间的负反馈调节的影响在Sbcl2细胞中转染入Mps1-WT,结果显示p-ERK水平降低,见图 1A~B(第4列);转染入Mps1-KD(Mps1激酶失活突变体),结果显示p-ERK水平降低,见图 1A~B(第5列);同时转染入B-RafWT质粒和Mps1-WT质粒,结果同样显示p-ERK水平降低,见图 1A~B(第6列);同时转染入B-RafWT和Mps1-KD,ERK活性同样被显著抑制,见图 1A~B(第7列)。提示Mps1激酶和B-RafWT/MEK/ERK通路之间的负反馈调节不依赖于Mps1的激酶活性。
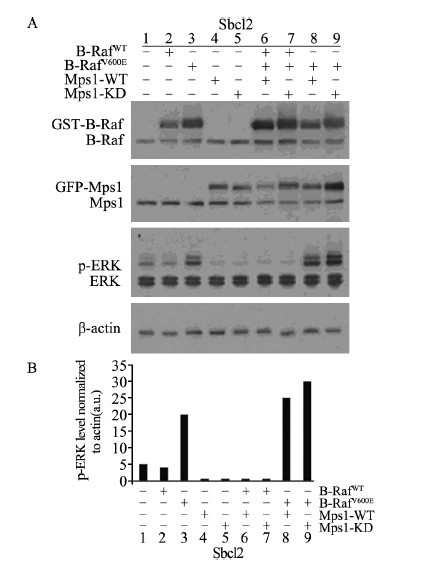
|
| A:Sbcl2 cells were transfected with Mps1-WT or Mps1-KD and B-RafWT.p-ERK,Mps1 and B-Raf expression were analyzed by Western blot.B:Phospho-ERK levels were normalized and analyzed 图 1 Mps1激酶活性对Mps1和B-RafWT/MEK/ERK通路之间的负反馈调节的影响 Figure 1The effect of Mps1 kinase activity on the autoregulatory negative feedback loop of Mps1 on the B-RafWT/MEK/ERK signaling pathway |
在恶性黑色素瘤中,约50%~70%含有B-RafV600E突变,其中70%AKT磷酸化水平升高。根据资料显示,MAPK通路和AKT通路之间可能存在相互调节的作用,比如在B-RafWT/MEK/ERK通路中,AKT可能参与了Mps1的自动负反馈调节[7, 8]。为了证明这一点,我们在B-RafWT和B-RafV600E背景的黑色素瘤细胞系中检测Mps1对phospho-AKT的作用。 结果显示,在野生型B-Raf遗传背景的Sbcl2和SK-ME131的细胞中,外源性的Mps1< /span>诱导AKT磷酸化,抑制ERK的活性,见图 2A。而在B-RAFV600E遗传背景SK-MEL-28、A375细胞中外源性的Mps1不能诱导AKT磷酸化,也不会抑制ERK的活性,见图 2B。以上结果表明,在B-RafWT/MEK/ERK/Mps1负反馈调节通路中,AKT发挥着重要的作用。而AKT在B-RafV600E/MEK/ERK/Mps1通路中不发挥作用,B-RafV600E对该负反馈回路具有抵抗作用。
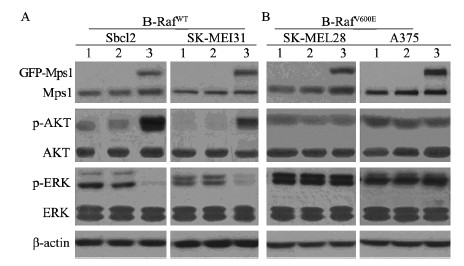
|
| 1:ctrl;2:GFP vector;3:GFP-Mps1 A:Exogenous Mps1 expression in B-RafWT melanoma cell lines;p-AKT and p-ERK expression were analyzed by Western blot.B:Exogenous Mps1 expression in B-Rafv600E melanoma cell lines;p-AKT and p-ERK expression were analyzed by Western blot 图 2 在黑色素瘤细胞中外源性Mps1的表达对p-AKT及p-ERK的影响 Figure 2The effect of exogenous Mps1 expression on p-AKT and p-ERK in melanoma cells |
为了进一步说明B-RafWT/MEK/ERK/Mps1负反馈调节通路需要AKT参与,我们在Sbcl2黑色素瘤细胞系中敲低p-AKT,然后瞬时转染GFP-Mps1。结果表明:与对照组相比,Sbcl2细胞中在p-AKT蛋白含量降低的情况下,Mps1蛋白含量未发生明显变化。在WM35及SK-MEL31细胞株中重复实验,结果一致。说明AKT在B-RafWT/MEK/ERK/Mps1负反馈调节通路中发挥重要作用,见图 3。
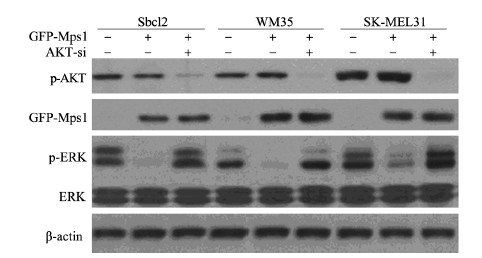
|
| 图 3 敲低p-AKT、过表达Mps1后,p-ERK在B-RafWT的黑色素细胞系中的表达情况 Figure 3p-ERK expression in B-RafWT melanoma cell lines after p-AKT were knocked down and Mps1 were overexpressed |
我们已经证明B-RafV600E对B-Raf/MEK/ERK/Mps1负反馈通路存在抵抗作用,以及AKT在这条通路中发挥关键作用,可以推断B-RafV600E对AKT有抑制作用。为了证实这一点,我们敲低了Sbcl2、WM35及SK-MEL31细胞系中内源性B-RafWT,然后瞬时转染GST-B-RafV600E,48h后裂解细胞用于Wersten blot检测。结果显示,与对照组相比p-AKT表达水平降低,说明B-RafV600E能够抑制AKT的磷酸化,见图 4A。为了进一步证实这一推断,我们选择用一种突变体特异性的ShRNA(pSUPER-Mut-A)敲低A375和SK-MEL-28黑色素瘤细胞系中的B-RafV600E。结果显示,敲低B-RafV600E的细胞系,p-AKT的表达水平升高,见图 4B。以上结果表明, B-RafV600E是通过抑制AKT的磷酸化抵抗B-Raf/MEK/ERK/Mps1负反馈调节作用。
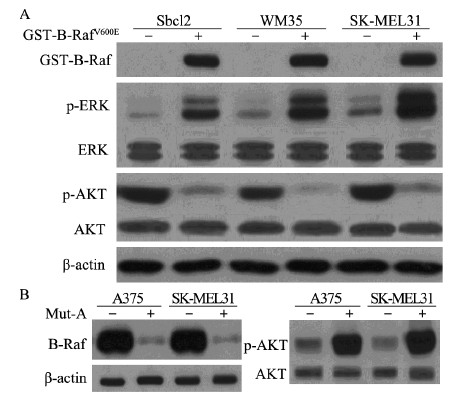
|
| A:Melanoma cell lines with B-RafWT genotypic background were transiently transfected with GST-B-RafV600E;p-ERK and p-AKT expression were analyzed by Western blot.B:Endogenous B-RafV600E protein was selectively knocked down,and p-ERK expression were analyzed by Western blot 图 4 B-RafV600E对AKT的磷酸化的影响 Figure 4The effect of B-RafV600E on phosphorylation activity of AKT |
以往研究认为,B-Raf基因通过RAS/RAF/MEK/ERK信号通路参与调控细胞生长、分化、凋亡等生物学事件,该基因突变后可导致人皮肤癌细胞、黑色素细胞和永生化上皮细胞出现纺锤体异常、染色体不稳定性及非整倍体细胞出现[7, 8]。课题组前期研究发现,有丝纺锤体监测点激酶Mps1,为B-Raf的作用底物之一,Mps1蛋白表达依赖于B-Raf/MEK/ERK通路;突变型B-RafV600E通过增强Mps1的稳定性而使Mps1蛋白水平以及激酶活性显著增加,导致纺锤体检测点过度激活,B-RafV600E信号导致Mps1的异常可能是黑色素瘤发生发展的关键[9, 10];前期研究还发现,Mps1激酶和B-RafWT/MEK/ERK通路之间存在一条自动调节的负反馈回路,即Mps1激酶水平及活性增强可以负反馈性抑制p-ERK水平;B-RafV600E表现出对该负反馈回路具有抵抗作用,由于该抵抗作用,导致Mps1蛋白表达丧失负反馈调控,使其含量增加,影响其在中心体复制、纺锤体检测点激活以及染色体不稳定调控中的功能[11, 12]。
本研究在前期研究的基础上发现,Mps1激酶和B-RafWT/MEK/ERK通路之间自动调节的负反馈回路不依赖于Mps1的激酶活性;且AKT在这一自动调节的负反馈回路中发挥重要作用,即过量的Mps1可以诱导AKT磷酸化,从而抑制ERK活性。更有趣的是,B-RafV600E 可以通过抑制AKT的磷酸化来抵制这一负反馈回路的自我调节作用。与此相一致,有文献报道B-RafV600E可以减弱AKT通路的活性。如Chen等报道,在黑色素瘤细胞中,B-RafV600E可以抑制AKT通路,该抑制作用需要依赖雷帕霉素非敏感度的mTOR伴侣结合蛋白,但是不依赖MEK/ERK以及B-Raf激酶活性[7];Maddodi的近期研究表明,B-RafV600E可通过抑制AKT通路的活性进而诱导自体吞噬[8];在黑色素瘤细胞中,LKB1-AMPK是经B-RafV600E调控的一个AKT的抑制通路[13]。总之,B-RafV600E不仅增强Mps1的稳定性,还对B-Raf/MEK/ERK/Mps1负反馈回路具有抵抗作用,该抵抗作用是由于B-RafV600E抑制AKT磷酸化,导致AKT抑制MAPK通路功能的丧失。
B-RafV600E和Mps1之间的相互作用导致染色体不稳定性与黑色素瘤发生密切相关,本研究揭示了两者之间新的作用机制。目前,B-RafV600E的抑制剂已经应用于黑色素瘤的临床治疗中,对携带B-RAFV600E突变型,而对抑制剂不敏感的黑色素瘤病人可考虑Mps1、AKT作为新的候选药物靶点,该研究为开展新的抗肿瘤策略提供了理论依据。
| [1] | Romeo Y, Moreau J, Zindy PJ, et al. RSK regulates activated BRAF signalling to mTORC1 and promotes melanoma growth[J]. Oncogene, 2012, 32(24): 2917-26. |
| [2] | Davies H, Bignell GR, Cox C, et al. Mutations of the BRAF gene in human cancer[J]. Nature, 2002, 417(6892): 949-54. |
| [3] | Dhomen N, Reis-Filho JS, da Rocha Dias S, et al. Oncogenic Braf induces melanocyte senescence and melanoma in mice[J]. Cancer Cell, 2009, 15(4): 294-303. |
| [4] | Hooijkaas AI, . Gadiot J, van der Valk M, et al. Targeting BRAF(V600E) in an inducible murine model of melanoma[J]. Am J Pathol, 2012, 181(3): 785-94. |
| [5] | Fisk HA, Mattison CP, Winey M. Human Mps1 protein kinase is required for centrosome duplication and normal mitotic progression[J]. Proc Natl Acad Sci USA, 2003, 100(25): 14875-80. |
| [6] | Cui Y, Guadagno TM. B-Raf(V600E) signaling deregulates the mitotic spindle checkpoint through stabilizing Mps1 levels in melanoma cells[J]. Oncogene, 2008, 27(22): 3122-33. |
| [7] | Chen B, Tardell C, Higgins B, et al. BRAFV600E negatively regulates the AKT pathway in melanoma cell lines[J]. PLoS One, 2012, 7(8): e42598. |
| [8] | Maddodi N, Huang W, Havighurst T, et al. Induction of autophagy and inhibition of melanoma growth in vitro and in vivo by hyperactivation of oncogenic BRAF[J]. J Invest Dermatol, 2010, 130(6): 1657-67. |
| [9] | Cui Y, Borysova MK, Johnson JO, et al.Oncogenic B-Raf(V600E) induces spindle abnormalities, supernumerary centrosomes, and aneuploidy in human melanocytic cells[J]. Cancer Res, 2010, 70(2): 675-84. |
| [10] | Liu J, Cheng X, Zhang Y, et al. Phosphorylation of Mps1by BRAFV600E prevents Mps1 degradation and contributes to chromosome instability in melanoma[J]. Oncogene, 2013, 32(6): 713-23. |
| [11] | Wan PT, Garnett MJ, Roe SM, et al. Mechanism of activation of the RAF-MAPK signaling pathway by oncogenic mutations of B-RAF[J]. Cell, 2004, 116(6): 855-67. |
| [12] | Kamata T, Pritchard C. Mechanisms of aneuploidy induction by RAS and RAF oncogenes[J]. Am J Cancer Res, 2011, 1(7): 955-71. |
| [13] | Zheng B, Jeong JH, Asara JM, et al. Oncogenic B-RAF negatively regulates the tumor suppressor LKB1 to promote melanoma cell proliferation[J]. Mol Cell, 2009, 33(2): 237-47. |
 2015, Vol. 42
2015, Vol. 42


