文章信息
- 郑红梅,吴新红,原俊,金立亭. 2015.
- ZHENG Hongmei, WU Xinhong, YUAN Jun, JIN Liting. 2015.
- HER2阳性乳腺癌脑转移3例并文献复习
- Brain Metastases in Patients with HER2 Positive Breast Cancer: Three Cases Report and Literature Review
- 肿瘤防治研究, 2015, 42(06): 637-640
- Cancer Research on Prevention and Treatment, 2015, 42 (06): 637-640
- http://www.zlfzyj.com/CN/10.3971/j.issn.1000-8578.2014.09.002
-
文章历史
- 收稿日期:2014-07-09
- 修回日期:2014-09-13
乳腺癌已成为女性最常见的恶性肿瘤,晚期乳腺癌所占比例越来越高,脑转移成为晚期乳腺癌患者死亡的主要原因之一[1]。在乳腺癌不同亚型里,脑转移最多见的是HER2阳性乳腺癌和三阴乳腺癌[2]。国内外学者对HER2阳性乳腺癌发生脑转移的流行病学、发病机制、治疗方法均进行了大量探索。本文通过回顾湖北省肿瘤医院3例HER2阳性乳腺癌患者脑转移的发生时间、治疗手段、治疗经过以及疾病的转归,探讨HER2阳性乳腺癌脑转移的综合治疗手段以及曲妥珠单抗等靶向治疗药物对脑转移患者预后的影响,试图提高该类患者的总生存期,改善其生活质量。 1 临床资料
病例1:患者,女,60岁,因发现左乳肿块2月,于2011年8月12日在我院行全麻下左乳肿块切除术+术中快速病检+左侧全乳切除术+左腋窝淋巴结清扫术,术后病检示:左乳浸润性导管癌Ⅱ级(肿瘤大小约1.5 cm×2.3 cm),脉管内可见癌栓,左腋窝淋巴结10/24枚可见转移癌,ER(2+),PR(-),HER2(3+)。诊断:左乳浸润性导管癌,pT2N3M0期。术后行多西他赛(75 mg/m2)+吡柔比星(50 mg/m2)3周方案,化疗6周期。化疗后行左胸壁和左锁骨上区域放射治疗,处方剂量为50 Gy/25次。未行靶向治疗。随后行芳香化酶抑制剂内分泌治疗(阿那曲唑,1 mg,口服,每日1次)。于2012年6月因剧烈头部疼痛入院,入院行颅脑MRI示:脑部多发转移瘤,见图 1。测肿瘤标志物正常,同时行全身体检,包括胸片、彩超、全身骨扫描等未发现其他远处转移。行脱水,降低颅内压治疗,同时行颅脑调强放射治疗,其中全脑预防照射剂量40 Gy,转移灶局部放射剂量增至60 Gy。但因病情进展迅速,于2012年7月死亡。
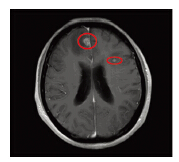
|
| Red circle marks indicated the two metastatic lesions 图 1 病例1脑转移MRI Figure 1 The MRI of brain metastases in the first patient |
病例2:患者,女,49岁,因发现左乳肿块3月,于2012年12月21日在我院行左乳肿块空芯针穿刺活检示:左乳腺浸润性小叶癌,ER(-),PR(-),HER2(2+),进行FISH检测显示HER2基因扩增Ki67(40%+),行环磷酰胺(600 mg/m2)+吡柔比星(60 mg/m2)3周方案新辅助化疗2周期。评估临床疗效达PR。于2013年2月22日在我院行全麻下左侧全乳切除术+左腋窝淋巴结清扫术,术后病检示:左乳浸润性小叶癌(肿瘤大小约1 cm×1.2 cm),Ⅱ级化疗反应,左锁骨下1枚淋巴结转移,左腋窝淋巴结12/13枚可见转移癌,ER(-),PR(-),HER2(3+),Ki67(Li:20%),诊断:左乳浸润性小叶癌,ypT1N3M0期。术后行多西他赛(75 mg/m2)+吡柔比星(50 mg/m2)3周方案化疗4周期,序贯多西他赛(100 mg/m2)3周方案化疗2周期。未行靶向治疗。随后行左胸壁和左锁骨上区域放射治疗,处方剂量为50 Gy/25次。同时口服中成药抗肿瘤。出院三月后于2013年12月因头痛剧烈入院检查,急诊行颅脑CT示:左侧额顶叶及右侧小脑片状影,考虑转移,见图 2。测肿瘤标志物正常,同时行全身体检,包括胸片、彩超、全身骨扫描等未发现其他远处转移。转入放疗科行颅脑调强放射治疗,其中全脑预防照射剂量40 Gy,转移灶局部放射剂量增至60 Gy。但也因病情进展迅速,于2014年2月死亡。
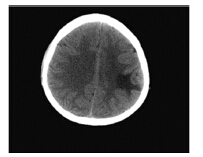
|
| The edema was serious and extensive, which covered the metastatic lesions 图 2 病例2脑转移CT Figure 2 The CT of brain metastases in the second patient |
病例3:患者,女,38岁,因发现左乳肿块一年,产后20天,于2012年3月16日在我院行左乳肿块空芯针穿刺活检示:左乳腺浸润性导管癌,ER(-),PR(-),HER2(3+)。随后行环磷酰胺(600 mg/m2)+吡柔比星(60 mg/m2)3周方案新辅助化疗2周期以及多西他赛(75 mg/m2)+吡柔比星(50 mg/m2)3周方案新辅助化疗2周期,左乳肿块和左腋窝淋巴结明显缩小,评估临床疗效达PR。于2012年6月21日在我院全麻下行左侧全乳切除术+左腋窝淋巴结清扫术,术后病检示:左乳头及基底切缘净(残留肿瘤大小约1.5 cm×1.8 cm),左腋窝淋巴结10/11枚可见转移癌,淋巴结旁组织可见癌结节及脉管内癌栓。诊断:左乳浸润性导管癌,ypT1N3M0期。术后继续行多西他赛(75 mg/m2)+吡柔比星(50 mg/m2)3周方案,化疗2周期,序贯多西他赛(100 mg/m2)3周方案化疗2周期。化疗结束后行左胸壁和左锁骨上区域放射治疗,处方剂量为50 Gy/25次。同时行中成药抗肿瘤治疗。未行靶向治疗。坚持每三月定期复查,病情稳定。于2013年6月出现双眼视力下降,来我院就诊,行颅脑MRI示:左侧额叶占位性病变,病灶最长径为3.5 cm,考虑转移。测肿瘤标志物正常,同时行全身体检,包括胸片、彩超、全身骨扫描等未发现其他远处转移。行颅脑调强放射治疗,其中全脑预防剂量40 Gy,转移灶局部剂量增至60 Gy。同时开始行曲妥珠单抗3周方案靶向治疗和长春瑞滨+紫杉醇化疗2周期,因出现Ⅳ度骨髓抑制等严重化疗不良反应,无法耐受,化疗终止。采取曲妥珠单抗3周方案单药维持治疗。坚持每三月复查一次颅脑MRI和全身检查,最近一次复查颅脑MRI示:左侧额叶转移瘤明显缩小,最长径为0.8 cm,视力明显好转,见图 3。最后一次随访时间为2014年8月,疾病无进展。
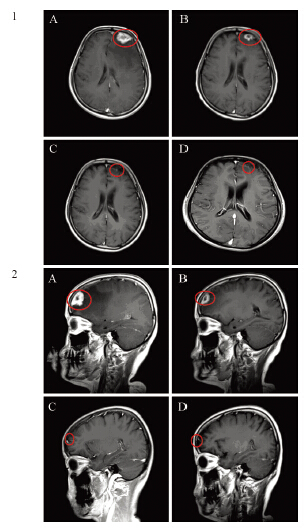
|
| A, B, C, D: the first, second, third, fourth MRI examination. Red circle marks indicated the metastatic lesions; 1. Transverse section; 2: Sagittal view 图 3 病例3脑转移MRI的横断位图和矢状位图 Figure 3 Transverse section and sagittal view of MRI of brain metastases in the third patient |
HER2在25%的乳腺癌患者体内高表达。乳腺癌中枢神经系统转移发生的危险因素包括:HER2高表达、区域淋巴结转移多、激素受体阴性等,其中HER2高表达是主要危险因子[3, 4]。本研究3例脑转移患者均为HER2阳性乳腺癌患者,且均为区域淋巴结转移达N3的患者。HER2阳性乳腺癌易发生脑转移的原因尚不清楚,可能是因为HER2阳性乳腺癌更具侵袭性,并且HER2可以通过调节下游靶点如促癌基因和促转移酶的活性从而增加癌细胞向脑部转移的能力[5]。
最近,ASCO在《临床肿瘤学杂志》在线发布了“2014 ASCO HER2阳性晚期乳腺癌脑转移瘤患者管理建议指南”[6],为HER2阳性晚期乳腺癌脑转移的病例推荐了治疗方案。该指南将HER2阳性晚期乳腺癌脑转移患者进行了分类,分为预后相对较好的和较差的;脑转移病灶孤立和多发弥漫的;是否伴随全身广泛转移;是否进行初始放疗又复发;全身转移病灶是否进展等,相应的治疗选择也有所不同,还对HER2阳性晚期乳腺癌进行脑部MRI筛查的时机进行了规定,见图 4[6]。
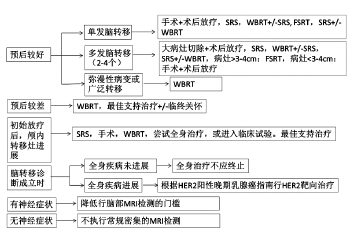
|
| SRS: stereotactic radiosurgery; WBRT: whole-brain radiotherapy; FSRT: fractionated stereotactic radiotherapy 图 4 2014年ASCO HER2阳性晚期乳腺癌脑转移治疗建议指南 Figure 4 Recommendations on disease management for patients with advanced HER2-positive breast cancer and brain metastases: ASCO Clinical Practice Guideline 2014 |
国内外学者探讨了靶向治疗在HER2阳性乳腺癌脑转移患者中的作用。临床试验表明,曲妥珠单抗对HER2阳性早期乳腺癌和包括脑转移在内的晚期乳腺癌患者有效,其可以显著提高晚期乳腺癌脑转移患者的中位生存期,从2~9月提升到9~26月[7, 8, 9, 10]。另有研究表明,当转移的肿瘤细胞在脑实质内生长至1~2 mm时,血脑屏障发生结构和功能上的改变,出现通透性增加和脑水肿的发生,引发相应的临床症状,药物有可能因此通过血脑屏障进入脑部[11]。全脑放疗可以破坏血脑屏障的结构和功能,导致通透性的增加,从而增加曲妥珠单抗和化疗药物进入脑部的能力[12]。另外,有些学者对于鞘内注射靶向药物治疗脑转移的可行性进行了探索。希腊学者[13]发表了一篇鞘内注射曲妥珠单抗治疗HER2阳性乳腺癌脑转移的Meta分析,该文纳入了13篇有效文献,综合分析得出如下结论:(1)鞘内注射曲妥珠单抗对于HER2阳性乳腺癌脑转移是安全有效的;(2)鞘内联合注射其他药物如化疗药物或其他靶向治疗药物也是可行的;(3)本研究的局限是,对于鞘内注射曲妥珠单抗的药物剂量没有明确标准,且病例数较少。
本研究3例病例均为HER2阳性乳腺癌患者,但术后没有及时进行靶向治疗,无病生存时间均很短,如果术后及时应用针对HER2的靶向治疗有可能推迟远处转移的时间。在出现脑转移后,前2例患者依然未行曲妥珠单抗靶向治疗,仅行单纯颅脑放疗,分别于脑转移发生后1月和2月死亡,疾病转归差。而第3例HER2阳性乳腺癌患者在出现脑转移后及时采用了含曲妥珠单抗的综合治疗,症状明显改善,颅脑转移灶缩小,其脑转移后生存期已超过12月。且第3例患者为妊哺期乳腺癌,理论上讲治疗效果欠佳,然而通过含曲妥珠单抗的综合治疗手段的使用,颅脑转移灶显著缩小,说明曲妥珠单抗在某些作用机制下也许可以通过血脑屏障,直接控制颅脑转移灶。
另有研究证明,小分子量靶向药物拉帕替尼也可以明显改善HER2阳性乳腺癌脑转移患者的预后[14, 15]。动物实验表明[16],拉帕替尼可以通过有免疫缺陷小鼠的血脑屏障从而治疗脑转移病灶。然而,在健康动物,拉帕替尼仍然无法通过血脑屏障,原因可能与健康动物体内存在P糖蛋白这样的流出泵有关[17]。法国学者[15]研究了拉帕替尼联合化疗药物卡培他滨治疗初次发生脑转移的HER2阳性乳腺癌患者的疗效,发现中枢神经系统的客观缓解率达2/3,有1/5的患者出现颅脑病灶体积的缩小达到80%,中枢神经系统中位疾病进展时间为5.5月。该文分析,其研究高的客观缓解率可能与该实验对象均为初次接受全脑放疗有关。
通过文献复习和回顾3例乳腺癌脑转移患者的病例特点,我们认识到:(1)对HER2阳性乳腺癌患者尽早进行抗HER2的靶向治疗,有可能延长该类患者的无病生存期;(2)HER2高表达和区域淋巴结转移数目较多是乳腺癌脑转移发生的两个高危因素,因此,对于具备这两个高危因素的乳腺癌患者,要高度警惕脑转移发生的风险,早期监测,早期治疗;(3)乳腺癌脑转移患者预后差,但曲妥珠单抗联合放化疗可以明显缩小颅脑转移灶的大小,可能对HER2阳性乳腺癌脑转移病灶有直接的控制作用。因此,HER2阳性乳腺癌患者发生脑转移后不宜过早放弃治疗,积极有效的综合治疗可以延长患者总生存期。
总之,随着抗HER2靶向药物的进一步开发以及药物通过血脑屏障方法的探索,有望很大程度上提高HER2阳性乳腺癌脑转移患者的远期生存率,改善其预后。
| [1] | Aragon-Ching JB, Zujewski JA. CNS metastasis: an old problem in a new guise[J]. Clin Cancer Res, 2007, 13(6): 1644-7. |
| [2] | Hohensee I, Lamszus K, Riethdorf S, et al. Frequent genetic alterations in EGFR- and HER2-driven pathways in breast cancer brain metastases[J]. Am J Pathol, 2013, 183(1): 83-95. |
| [3] | Arslan C, Dizdar O, Altundag K. Systemic treatment in breast-cancer patients with brain metastasis[J]. Expert Opin Pharmacother, 2010, 11(7): 1089-100. |
| [4] | Steeg PS, Camphausen KA, Smith QR. Brain metastases as preventive and therapeutic targets[J]. Nat Rev Cancer, 2011, 11(5): 352-63. |
| [5] | Zhang L, Sullivan PS, Goodman JC, et al. MicroRNA-1258 suppresses breast cancer brain metastasis by targeting heparanase[J]. Cancer Res, 2011, 71(3): 645-54. |
| [6] | Ramakrishna N, Temin S, Chandarlapaty S, et al. Recommendations on disease management for patients with advanced human epidermal growth factor receptor 2-positive breast cancer and brain metastases: American Society of Clinical Oncology Clinical Practice Guideline[J]. J Clin Oncol, 2014, 32(19): 2100-8. |
| [7] | Bartsch R, Berghoff A, Pluschnig U, et al. Impact of anti-HER2 therapy on overall survival in HER2-overexpressing breast cancer patients with brain metastases[J]. Br J Cancer, 2012, 106(1): 25-31. |
| [8] | Brufsky AM, Mayer M, Rugo HS, et al. Central nervous system metastases in patients with HER2-positive metastatic breast cancer: incidence, treatment, and survival in patients from registHER[J]. Clin Cancer Res, 2011, 17(14): 4834-43. |
| [9] | Witzel I, Kantelhardt EJ, Milde-Langosch K, et al. Management of patients with brain metastases receiving trastuzumab treatment for metastatic breast cancer[J]. Onkologie, 2011, 34(6): 304-8. |
| [10] | Pestalozzi BC, Holmes E, de Azambuja E, et al. CNS relapses in patients with HER2-positive early breast cancer who have and have not received adjuvant trastuzumab: a retrospective substudy of the HERA trial(BIG 1-01)[J]. Lancet Oncol, 2013, 14(3): 244-8. |
| [11] | Hawkins BT, Davis TP. The blood-brain barrier/neurovascular unit in health and disease[J]. Pharmacol Rev, 2005, 57(2): 173-85. |
| [12] | Pestalozzi BC, Brignoli S. Trastuzumab in CSF[J]. J Clin Oncol, 2000, 18(11): 2349-51. |
| [13] | Zagouri F, Sergentanis TN, Bartsch R, et al. Intrathecal administration of trastuzumab for the treatment of meningeal carcinomatosis in HER2-positive metastatic breast cancer: a systematic review and pooled analysis[J]. Breast Cancer Res Treat, 2013, 139(1): 13-22. |
| [14] | Metro G, Foglietta J, Russillo M, et al. Clinical outcome of patients with brain metastases from HER2-positive breast cancer treated with lapatinib and capecitabine[J]. Ann Oncol, 2011, 22(3): 625-30. |
| [15] | Bachelot T, Romieu G, Campone M, et al. Lapatinib plus capecitabine in patients with previously untreated brain metastases from HER2-positive metastatic breast cancer (LANDSCAPE): a single-group phase 2 study[J]. Lancet Oncol, 2013, 14(1): 64-71. |
| [16] | Taskar KS, Rudraraju V, Mittapalli RK, et al. Lapatinib distribution in HER2 overexpressing experimental brain metastases of breast cancer[J]. Pharm Res, 2012, 29(3): 770-81. |
| [17] | Polli JW, Humphreys JE, Harmon KA, et al. The role of efflux and uptake transporters in [N-{3-chloro-4-[(3-fluorobenzyl)oxy]phenyl}-6-[5-({[2-(methylsulfonyl)ethyl]amino}methyl)-2-furyl]-4-quinazolinamine (GW572016, lapatinib) disposition and drug interactions[J]. Drug Metab Dispos, 2008, 36(4): 695-701. |
 2015, Vol. 42
2015, Vol. 42


