文章信息
- 郎博娟,马金阳,胡余昌,陈路,唐立华. 2015.
- LANG Bojuan, MA Jinyang, HU Yuchang, CHEN Lu, TANG Lihua. 2015.
- 胶质瘤中MicroRNA-184的表达及其预后价值
- MicroRNA-184 Expression in Glioma Tissues and Its Prognosis Value
- 肿瘤防治研究, 2015, 42(05): 483-487
- Cancer Research on Prevention and Treatment, 2015, 42 (05): 483-487
- http://www.zlfzyj.com/CN/10.3971/j.issn.1000-8578.2015.05.014
-
文章历史
- 收稿日期:2014-10-13
- 修回日期:2015-01-20
2. 443003 宜昌,宜昌市中心人民医院神经外科
2. Department of Neurosurgery, Yichang Central People's Hospital, Yichang 443003, China
胶质细胞瘤是最常见的脑部原发恶性肿瘤[1],手术及放化疗效果不理想,预后差,寻找胶质瘤预后标志物和有效的靶标分子是目前研究的热点。研究表明miR-184与成神经细胞瘤、舌鳞状细胞癌等肿瘤发生和进展有关[2, 3]。但miR-184在胶质瘤中的表达及其与临床病理特征和预后的关系尚无报道。本研究旨在了解miR-184在胶质瘤和正常脑组织中的表达,分析miR-184的表达与胶质瘤的临床病理因素和预后之间的关系。 1 资料和方法 1.1 病例选择
收集宜昌市中心人民医院神经外科2008年1月—2012年12月手术切除并经病理证实的脑胶质瘤FFPE标本108例,入选患者均为首次手术治疗,术前均未接受放疗和(或)化疗,其中男85例、女23例,年龄18~70岁,平均53岁。按照世界卫生组织(2007年)神经系统肿瘤分类标准对上述肿瘤组织进行分级,其中Ⅰ级11例,Ⅱ级24例,Ⅲ级50例,Ⅳ级23例。KPS评分≥80分24例,<80分84例。另选取脑外伤行内减压的32例正常脑组织作对照。该研究通过了宜昌市中心人民医院伦理委员会批准和研究对象知情同意。 1.2 RNA的提取、纯化和浓度测定
TRIzol(Invitrogen公司)法抽提总RNA,对RNA进行纯化,用Nanodrop 2000(Thermo公司)测定总RNA浓度。RNA提取、纯化和浓度测定均按照试剂盒说明书操作。 1.3 miRNA微阵列芯片法检测
为探索胶质瘤和正常脑组织FFPE中miR-184的表达模式,选取6例胶质瘤和6例正常脑组织的FFPE,用miRNA3.0仪器(Affymetrix公司)进行检测。依据操作说明对总RNA进行加多聚A尾、生物素标记、杂交、洗涤、染色和扫描等操作。用Expression Console软件(1.3.1版本,Affymetrix公司)分析阵列图像以获得原始数据,并使RNA标准化。GeneSrping软件(12.5版本,Agilent Technologies公司)用于数据分析。探针至少含有一个所有样品都有的基团,用 “P”标识并被用于进一步的数据分析。聚类分析用于显示样品miRNAs表达谱之间的差别,miRNAs的差异表达主要通过变化倍数和P值比较来确定,基因上调和下调的统一标准是变化倍数≥2.0且P≤0.05。 1.4 RT-PCR检测miR-184的表达
为验证微阵列芯片法分析的miRNAs表达变化,用RT-PCR检测胶质瘤和正常脑组织中miR-184的表达,RNU6B用作内参。miR-184的引物为:5'-GCTAGCAGCACATAATGGTTTGTG-3'(正向);5'-GTGCAGGGTCCGAGGTAT TC-3'(反向)。RNU6B的引物为:5'-CTCGCTTCGGCAGCACA-3'(正向);5'-AACGCT TCACG AATTTGCGT-3'(反向)。RNU6B和miR-184的引物由上海生工生物科技公司合成。候选miRNAs根据内参基因RNU6校正miR-184的表达量,以公式2-ΔΔCT表示,其中ΔCt = Ct目的基因-Ct参照样本,ΔΔCt = ΔCt目的基因-ΔCt对照基因。所有样品重复3次。 1.5 随访
受试者从手术之日起每3月以电话或信件形式随访,随访资料同时进行更新。末次随访时间为2013年12月31日。其中有9人因联系方式变更,无法联系而失访,其余99位患者中位随访时间为38.7月(5.6~59.3月)。 1.6 统计学方法
采用SPSS17.0软件进行统计分析。miR-184的表达与临床病理特征之间的关系用Mann-Whitney检验或秩和检验。采用Kaplan-Meier法和Log rank检验分析生存曲线。进行单因素和多因素Cox分析,用风险比(HR)及95%置信区间(CI)评价不同临床病理特征与生存期的相关性。以α=0.05为检验水准,P<0.05表示差异有统计意义。 2 结果 2.1 胶质瘤FFPE中miRNAs表达谱分析结果
对6例胶质瘤和6例正常脑组织的FFPE进行miRNAs微阵列芯片分析,结果显示在35个候选miRNAs的表达谱中,可见miR-184在胶质瘤中表达下调,见图 1。

|
| Color gradation indicated the relative expression levels of miRNAs from low expression (green) to high expression (red) 图1 miRNAs在胶质瘤中差异表达谱 Figure 1 Differentially-expressed miRNAs in glioma |
采用RT-PCR方法检测108例胶质瘤和32个正常脑组织FFPE中miR-184的表达。结果显示miR-184在胶质瘤的相对表达量为(2.73±0.96),正常脑组织为(7.42±1.68),两组间差异有统计学意义(P<0.001)。RT-PCR检测的miR-184与微阵列芯片法分析miR-184的结果相一致(P<0.05),见图 2。
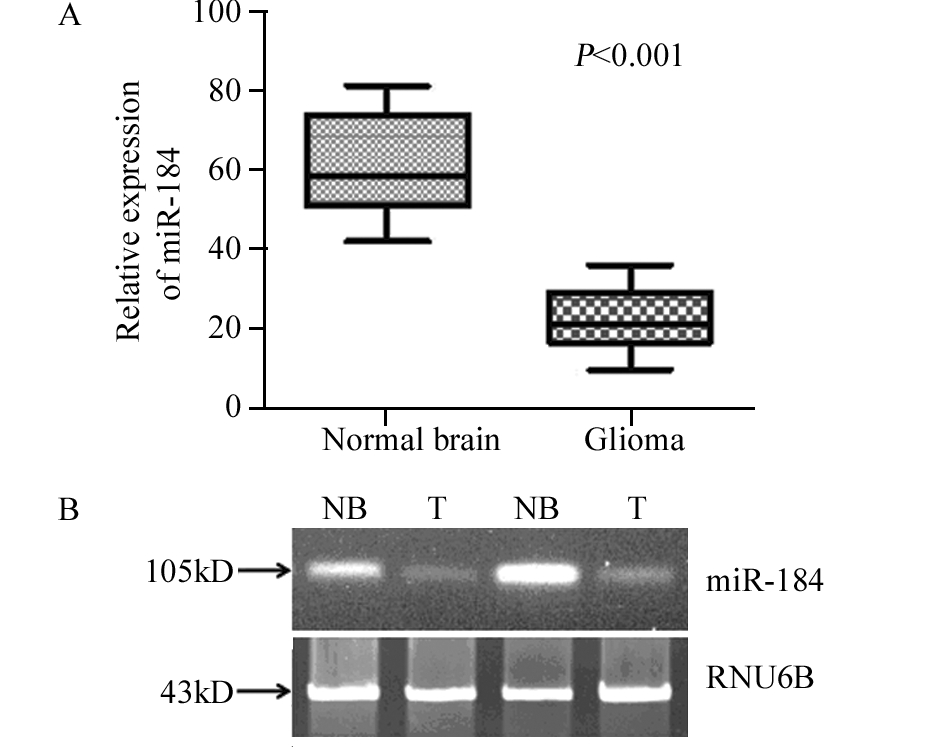
|
| NB: Normal brain; T: Tumor; RNV6B: RNU6B was used as an internal control 图2 三维培养观察各组细胞管腔样结构形成能力 Figure 2 Luminal-like structures forming ability of cells in each group in three-dimensional culture |
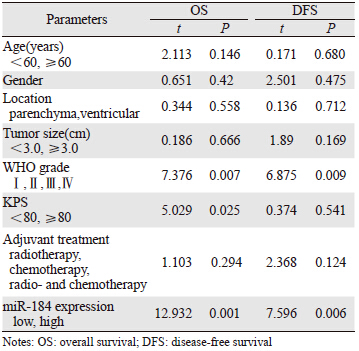
比较miR-184的表达情况与临床病理变量的关系时发现,miR-184的表达与WHO分级(P=0.007)、KPS评分(P=0.029)、复发时间(P=0.037)和生存时间(P=0.019)之间存在显著性相关,见表 1。
 |
分析胶质瘤FFPE中miR-184表达的预后价值,进行包括年龄、性别、肿瘤位置、肿瘤大小、WHO分级、KPS评分、辅助治疗及miR-184的表达等影响因素的单因素生存分析,结果见表 2。Log-rank检验表明,胶质瘤miR-184高表达的患者DFS较miR-184低表达的患者DFS更长,差异有统计学意义(P=0.013),见图 3A;胶质瘤miR-184高表达的患者OS较miR-184低表达的患者OS更长,差异有统计学意义(P=0.035),见图 3B。

|
| A: disease-free survial; B: overall survival 图3 miR-184在胶质瘤中表达的无进展生存和总生存曲线图 Figure 3 Disease-free survival and overall survival curves of patients with low or high expression of miR-184 |
 |
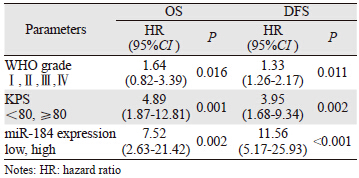
为了进一步研究miR-184的表达是否是胶质瘤预后的独立因素,对OS和DFS进行多因素回归分析,结果显示:miR-184的表达(P=0.002)、WHO分级(P=0.016)和KPS评分(P=0.001)与OS显著性相关。miR-184的表达(P<0.001),KPS评分(P=0.002),WHO分级(P=0.011)均与DFS显著性相关。结果表明miR-184的表达是预测胶质瘤预后的独立因素,见表 3。
 |
miRNA是近年来发现的一类长度为19~25个核苷酸的非编码小分子RNA,通过与靶miRNA的3’端非翻译区(3’UTR)的碱基序列完全或部分互补结合清除靶miRNA或者抑制蛋白的合成而发挥其生物学功能。其功能失调与乳腺癌、肺癌等多种恶性肿瘤密切相关[4, 5, 6, 7, 8]。
伴随越来越多肿瘤相关miRNA的发现,脑胶质瘤中miRNA分布和作用也逐渐被人们所了解,其在胶质瘤组织中表达异常,胶质瘤的生物学行为与此密切相关[9],包括细胞存活、增殖、分化、侵袭、肿瘤血管生成和干细胞生成等。目前研究证实,胶质瘤细胞中有23种miRNA表达上调,如miR-21、miR-221/222等;另有34种下调,如miR-7、miR-451及mi-R128等。本研究首次用微阵列芯片法检测到miR-184在胶质瘤中的表达低于正常脑组织,用RT-PCR法再对此进行验证,两种方法结果一致。从而提示miR-184表达下调可能与胶质瘤的发生发展有关,为胶质瘤分子水平的研究及分子靶向治疗提供了新的探索方向。本研究发现miR-184在胶质瘤中的表达与WHO分级、KPS评分、复发时间和总生存期等具有密切的关联性,这表明miR-184在胶质瘤中可能发挥着抑制作用。miRNA可通过调节抑癌基因和凋亡前基因等多种靶点而在胶质瘤发生中发挥癌基因作用,其在胶质瘤细胞高表达会导致第10号染色体缺失的磷酸酶及张力蛋白同源的基因(phosphatase and tensin homolog deleted on chromosome ten,PTEN)表达下降;同时miRNA可通过靶向结合胞外信号调节激酶1(extracellular signal-regulated kinase1,ERK1)基因转录产物的3’非翻译区,抑制ERK1蛋白的产生,进而抑制胶质瘤的增殖[10]。就本研究而言,其可能的内在机制是:(1)低表达的miR-184通过上调靶基因促进胶质瘤的侵袭性[11];(2)低表达的miR-184可以通过作用靶基因提高肿瘤细胞增殖能力[12, 13];(3)低表达的miR-184可以通过作用靶基因促进细胞的生长和加强了其生存能力[14]。
同时有研究证实,特定miRNA表达水平异常可能与胶质瘤的进展有关[15, 16],检测miRNA可以预测胶质瘤的预后。本研究中,胶质瘤患者miR-184的表达水平越低其预后也越差,单因素和多因素Cox回归分析表明,miR-184的表达水平低是胶质瘤患者不良OS和DFS密切相关的预后因素,进而证实miR-184可以作为胶质瘤独立预测预后的分子标志物。其可能的机制是miR-184通过靶向作用丝氨酸/苏氨酸激酶AKT2抑制细胞生存,同时促进细胞凋亡,当miR-184低表达时就促进肿瘤细胞生长,抑制细胞凋亡,从而导致患者较差的预后[17]。
总之,对胶质瘤细胞中miR-184异常表达的研究,有助于了解胶质瘤的发病机制以及miR-184在胶质瘤发生发展中的作用。此研究表明miR-184在胶质瘤中低表达,它在胶质瘤的进展过程中可能发挥抑癌基因的作用,并且可作为一个潜在的独立的预测预后的因素。更为重要的是miR-184潜在的分子机制可能对胶质瘤治疗的创新战略带来新的思路。miR-184的生物学功能及其对肿瘤抑制的作用机制,是否还有更多的靶基因和信号通路参与其中,都还有待于进一步研究。
| [1] | Louis DN, Ohgaki H, Wiestler OD, et al. The 2007 WHO classification of tumours of the central nervous system[M]. Acta Neuropathol, 2007, 114: 97-109. |
| [2] | Tivnan A, Foley NH, Tracey L, et al. MicroRNA-184-mediated inhibition of tumor growth in an orthotopic murine model of neuroblastoma[J]. Anticancer Res, 2010, 30(11): 4391-5. |
| [3] | Wong TS, Ho WK, Chan JY, et al. Mature miR-184 and squamous cell carcinoma of the tongue[J]. Scientific World Journal, 2009, 9: 130-2. |
| [4] | Harquail J, Benzina S, Robichaud GA. MicroRNAs and breast cancer malignancy: an overview of miRNA-regulated cancer processes leading to metastasis[J]. Cancer Biomark, 2012, 11(6): 269-80. |
| [5] | Rossi S, Di Narzo AF, Mestdagh P, et al. microRNAs in colon cancer: a roadmap for discovery[J]. FEBS Lett, 2012, 586(19): 3000-7. |
| [6] | Solomides CC, Evans BJ, Navenot JM, et al. MicroRNA profiling in lung cancer reveals new molecular markers for diagnosis[J]. Acta Cytol, 2012, 56(6): 645-54. |
| [7] | Ali S, Saleh H, Sethi S, et al. MicroRNA profiling of diagnostic needle aspirates from patients with pan-creatic cancer[J]. Br J Cancer, 2012, 107(8): 1354-60. |
| [8] | Moussay E, Wang K, Cho JH, et al. MicroRNA as biomarkers and regulators in B-cell chronic lymphocytic leukemia[J]. Proc Natl Acad Sci USA, 2011, 108(16): 6573-8. |
| [9] | Bartel DP. MicroRNAs: Target recognition and regulatory functions[J]. Cell, 2009, 136(2): 215-33. |
| [10] | Wang L, Shi M, Hou S, et al. miR-483-5p suppresses the proliferation of glioma cells via directly targeting ERK1[J]. FEBS Lett, 2012, 6(9): 1312-7. |
| [11] | Emdad L, Janjic A, Alzubi MA, et al. Suppression of miR-184 in malignant gliomas upregulates SND1 and promotes tumor aggressiveness[J]. Neuro Oncol, 2014. [Epub aead of print] |
| [12] | Cui QK, Liu WD, Zhu JX, et al. MicroRNA-184 promotes proliferation ability of glioma cells by regulating FOXO3[J]. Asian Pac J Trop Med, 2014, 7(10): 776-9. |
| [13] | Wu GG, Li WH, He WG, et al. miR-184 post-transcriptionally regulates SOX7 expression and promotes cell proliferation in human hepatocellular carcinoma[J]. PLoS One, 2014, 9(2): e88796. |
| [14] | Zhen Y, Liu Z, Yang H, et al. Tumor suppressor PDCD4 modulates miR-184-mediated direct suppression of C-MYC and BCL2 blocking cell growth and survival in nasopharyngeal carcinoma[J]. Cell Death Dis, 2013, 4: e872. |
| [15] | Ciafrè SA, Galardi S, Mangiola A, et al. Extensive modulation of a set of microRNAs in primary glioblastoma[J]. Biochem Biophys Res Commun, 2005, 334(4): 1351-8. |
| [16] | Wang Y, Wang X, Zhang J, et al. MicroRNAs involved in the EGFR/PTEN/AKT pathway in gliomas[J]. J Neurooncol, 2012, 106(2): 217-24. |
| [17] | Foley NH, Bray IM, Tivnan A, et al. MicroRNA-184 inhibits neuroblastoma cell survival through targeting the serine/threonine kinase AKT2[J]. Mol Cancer, 2010, 9: 83. |
 2015, Vol. 42
2015, Vol. 42


