文章信息
- 崔小川,丁军利,万小蔹,朱建荣. 2015.
- CUI Xiaochuan, DING Junli, WAN Xiaolian, ZHU Jianrong. 2015.
- 肺癌上皮间质转化后引发Nrf2介导的多药耐药的研究
- Nrf2-mediated Multidrug Resistance after Epithelial-mesenchymal Transition in Lung Cancer Cells
- 肿瘤防治研究, 2015, 42(05): 432-435
- Cancer Research on Prevention and Treatment, 2015, 42 (05): 432-435
- http://www.zlfzyj.com/CN/10.3971/j.issn.1000-8578.2015.05.002
-
文章历史
- 收稿日期:2015-01-15
- 修回日期:2015-03-06
2. 214023 无锡,南京医科大学附属无锡市人民医院肿瘤科
2. Department of Medical Oncology, The AffiliatedWuxi People’s Hospital, Nanjing Medical University, Wuxi 214023, China
上皮-间质转化(epithelial-mesenchymal transition,EMT)是指上皮细胞通过特定程序转化为具有间质表型细胞的生物学过程。通过EMT,上皮细胞失去了细胞极性,失去与基底膜的连接等上皮表型,获得了较高的迁移与侵袭、抗凋亡和降解细胞外基质的能力等间质表型[1]。目前已发现EMT存在于多种上皮来源的恶性肿瘤包括肺癌中,并且可引起多药耐药,促进肿瘤进展[2]。
NF-E2(NF-E2-related factor 2,Nrf2)是调节细胞产生保护性应答反应的重要转录因子,但新近研究表明Nrf2在产生保护性应答反应的同时,也显著诱导了肿瘤细胞的多药耐药[3]。研究显示,肺癌细胞A549细胞核内Nrf2累积可引起对顺铂、卡铂、依托泊苷的耐药[4],但Nrf2的调控机制未明。EMT是肿瘤进展中的重要生物学过程,它能否引起Nrf2的表达变化并共同参与肺癌的多药耐药还未见报道。为探讨肺癌细胞EMT转化与Nrf2表达的关系,我们以TGF-β1(10 ng/ml)诱导肺癌细胞A549发生上皮间质转化,然后检测Nrf2及其下游信号分子的表达和细胞耐药指数的改变。
1 材料与方法 1.1 材料A549人肺腺癌细胞购自中国上海中科院生化细胞所,兔抗人抗体E-钙黏连素(E-cadherin)、波形蛋白(Vimentin)、蜗牛蛋白(Snail)购自英国Abcam公司。Nrf2抗体购自美国Santa-Cruz公司,小鼠抗兔IgG及内参Actin购自美国cell signaling公司,重组人TGF-β1细胞因子购自美国Peprotech公司。谷胱甘肽-S转移酶测试盒、谷胱甘肽测试盒购自中国南京建成生物工程研究所。
1.2 方法 1.2.1 细胞培养和EMT诱导人肺癌细胞A549培养在含有10%胎牛血清的RPMI1640培养液中,并于37℃、5%CO2培养箱中持续培养,待细胞融合率达到80%以上时以TGF-β(10 ng/ml)加入培养液中干预24 h后,倒置显微镜下观察细胞形态,收集细胞,提取蛋白。
1.2.2 采用免疫印迹法(Western blot)检测E-钙黏连素、波形蛋白、蜗牛蛋白、Nrf2的表达用常规方法提取细胞胞质蛋白、核蛋白,用Bradford法测定蛋白浓度。计算蛋白样品浓度,每孔上样20 µg,然后进行SDS-PAGE电泳。用4%浓缩胶,10%的分离胶,浓缩胶电压80 V、15 min,分离胶电压120 V、50 min,然后用Bio-Rad的半干电转仪将蛋白转移到PVDF膜上,电压20 V、90 min。室温封闭60 min,分别加入一抗(分别含稀释度为1:200的E-cadherin; 1:200的Vimentin; 1:400的Snail;1:200的Nrf2)、二抗(HRP标记的羊抗兔抗体和羊抗鼠抗体),用Pierce公司化学发光试剂盒显影并压片曝光,最后用凝胶成像仪进行吸光度分析。
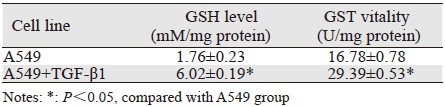
1.2.3 谷胱甘肽(glutathione,GSH)含量及谷胱甘肽转硫酶(glutathione S-transferase,GST)活力测定GSH含量及GST活力以分光光度计采用比色法测定,按南京建成生物工程研究所试剂盒中说明书操作。显色反应后在722分光光度计上调零,在波长412 nm,光径0.5 cm处比色测OD值。GSH(mM/mg protein)= [(测定管OD值-测定空白管OD值)/(标准管OD值-空白管OD值)]×标准管浓度(0.5 mmol/L)×GSH分子量(307)。1个酶活力单位在25°C,pH7.5的条件下,在1 min内可以还原化1微摩尔GSSG。1 u=1 000 mu。
1.2.4 通过siRNA降低Nrf2的表达Nrf2 siRNA干扰转染前一天,(4~5)×104细胞接种在24孔板上,0.5 ml含FBS的RPMI1640细胞培养液。选择用于初期接种的细胞数量,应能在24 h内使细胞融合达到30%~50%,将20 pmol siRNA加入50 µl无血清RPMI1640培养液中,轻轻混匀。用之前轻轻摇匀Lipo2000,将1 µl Lipo2000加入50 µl无血清RPMI1640培养液中,轻轻混匀后室温静置5 min。将稀释好的siRNA和稀释后的Lipo2000轻轻混匀,室温静置20 min,形成siRNA/Lipo2000混合物。将100 µl混合物加到含有细胞和培养液的孔板中,来回轻柔摇晃细胞培养板。细胞在CO2培养箱中37℃温育72 h,进行转染后的耐药检测。
1.2.5 MTT法检测细胞耐药指数的改变用0.25%胰酶消化处理对数生长期细胞,用含8%FBS的RPMI1640培养液配成细胞悬液,细胞浓度为2×104个/毫升,每孔接种4×103个,共200 µl。接种在96孔板上,设有空白对照组、阴性对照组、DDP组。其中空白对照组不含细胞,只加含8%FBS的RPMI1640培养液,作为调零孔值,阴性对照组是不加DDP的细胞。DDP组,设浓度分别为5、10、20、40、80 μmol/L,每种浓度设4个复孔。接种完毕后96孔板培养过夜,细胞贴壁后加入含药培养液200 μl,呈色48 h后,加入MTT继续孵育4 h后加入DMSO,在酶联免疫检测仪上选定490 nm波长处测定吸光度(A)值,参比波长620 nm。细胞生长抑制率(%)=(1-给药组平均A值/对照组平均A值)×100%; lgIC50=Xm-I[P-(3-Pm-Pn)/4],Xm: lg最大剂量;I: lg(最大剂量/相邻剂量);P:阳性反应率之和;Pm:最大阳性反应率;Pn:最小阳性反应率。耐药指数=实验组IC50/对照组IC50。
1.3 统计学方法采用SPSS13.0统计软件分析,计数资料采用χ2检验。计量资料以均数±标准差(x±s)表示,两组间比较采用t检验,多组间比较采用方差分析。以P<0.05为差异具有统计学意义。
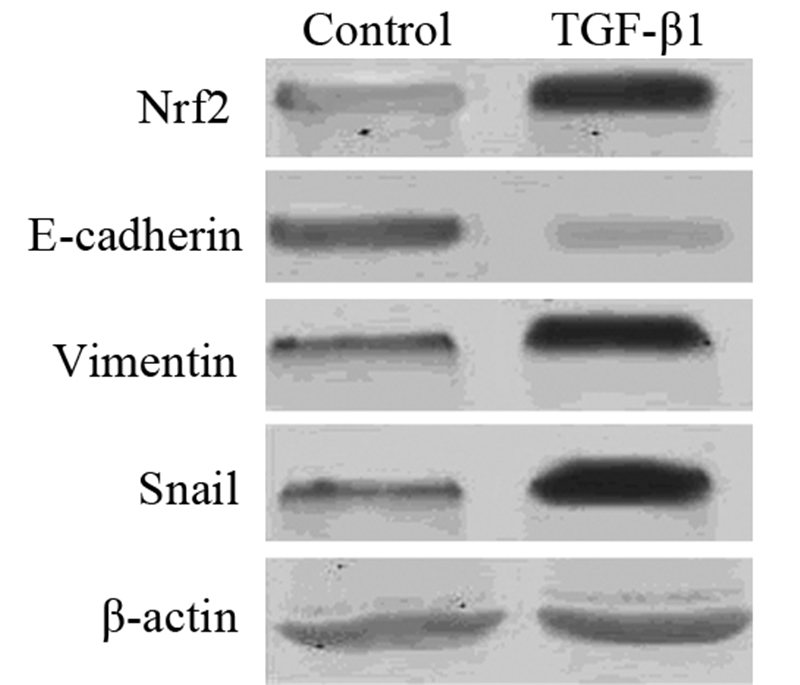
2 结果 2.1 TGF-β1作用后肺癌细胞的形态变化TGF-β1(10 ng/ml)使肺腺癌细胞A549由上皮形态(A)向间质形态(B)转换:由紧密、鹅卵石样转变为松散、梭形样,细胞极性消失,见图 1。同时Western blot结果显示加入TGF-β1后,癌细胞的上皮标志物E-cadherin下降,而间质标志物Vimentin、Snail显著上升,见图 2,表明TGF-β1促使了肺腺癌细胞A549发生上皮间质转化。

|
| A: The morphology of A549 cell line before TGF-β1 intervention; B:The morphology of A549 cell line after TGF-β1 intervention 图1 A549细胞在TGF-β1干预前后的形态变化(结晶紫染色 ×200) Figure 1 The morphology of A549 cell line before and afterTGF-β1 intervention (crystal violet staining ×200) |
|
| 图2 加入TGF-β1前后EMT标志分子E-cadherin、Vimentin (胞质蛋白)及Snail、Nrf2(胞核蛋白)的表达变化 Figure 2 The protein expression of E-cadherin, Vimentin(cytoplasmic protein), Snail and Nrf2(nuclear protein) before and after treatment of TGF-β1 |
TGF-β加入培养液后,肺腺癌细胞A549核内蛋白Nrf2表达显著增加,提示上皮间质转化影响Nrf2通路活性,见图 2。加入TGF-β后,Nrf2通路的下游靶分子谷胱甘肽转硫酶的活力变化和还原型谷胱甘肽含量增加,较空白对照组(A549组)差异具有统计学意义,见表 1。提示肺腺癌细胞A549发生上皮间质转化后Nrf2通路活力增强,两者之间存在密切关系。
 |
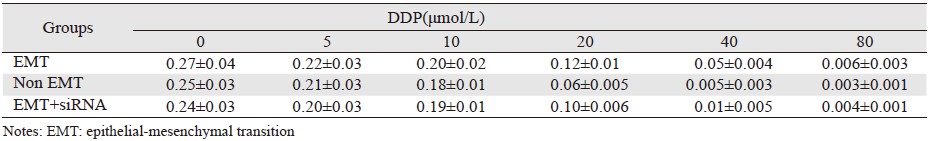
MTT法测得EMT组(加入TGF-β1)的阴性对照组A值为(0.27±0.04),非EMT组(未加TGF-β1)的阴性对照组的A值为(0.25±0.03),EMT+Nrf2 siRNA的阴性对照组的A值为(0.24±0.03)。三组经DDP干预后的A值,单因素方差分析后结果见表 2,各组A值均为以空白对照组调零后的值,空白对照组A均值为(0.02±0.003)。计算各组肿瘤细胞抑制率,结果见表 3。按上述公式计算IC50,得到DDP对EMT组的IC50为69.48 μmol/L,非EMT组的IC50为9.02 μmol/L,EMT联合Nrf2 siRNA组的IC50为20.24 μmol/L。与非EMT组比较,EMT组耐药指数提高至7.7倍,而Nrf2 siRNA部分逆转了耐药,EMT+Nrf2 siRNA组耐药指数只提高至2.24倍。
 |
 |
上皮间质转化是上皮细胞在一些生理或病理因素的作用下,逐渐丧失细胞极性,丢失细胞间的黏附连接,变成具有间质细胞形态和特征的细胞过程,发生EMT后,细胞不仅发生形态学变化,而且发生分子标志物变化:上皮细胞标志分子E-cadherin、CK19蛋白等表达减少,而间质细胞的分子标志物Vimentin、Snail等表达增加,重要的是细胞发生EMT后生物学行为发生改变:迁移与侵袭能力增强、抗凋亡能力增强、而新近研究显示EMT可引发肿瘤细胞耐药。肺癌组织中EMT与恶性程度呈正相关,而且,发生EMT的肺癌细胞表现为对多种化疗药物和EGFR抑制剂的多药耐药[5, 6]。
Nrf2是细胞调节抗氧化应激反应的重要转录因子[7],生理状态下Nrf2与胞质蛋白伴侣分子keap1(Kelch-like ECH-associated protein 1)结合,使活性处于相对抑制状态,应激源作用下keap1构象发生变化导致Nrf2-keap1解偶联,同时激活Nrf2,活化的Nrf2入核,与小Maf蛋白等转录因子形成异二聚体识别抗氧化反应元件ARE,启动第Ⅱ相解毒酶、抗氧化酶及ATP依赖性耐药泵基因的表达,增强细胞对氧化应激的抗性,其中Ⅱ相代谢酶和氧化还原酶是目前的研究热点。谷胱甘肽转硫酶广泛存在于生物体内,是一种重要的Ⅱ相代谢酶,其主要作用是催化还原型谷胱甘肽与亲电子物质结合,继而排出体外。新近研究显示Nrf2在发挥对细胞的保护作用同时也介导了多药耐药的发生[8, 9],但Nrf2的表达调控机制不详。本实验基于EMT、Nrf2与肺癌耐药的密切关系及EMT是肿瘤进展中的重要生物学过程,提出EMT可能通过影响Nrf2通路介导了肺癌的多药耐药的设想。
EMT受各种因素调控,可被许多信号分子如转化生长因子(TGF-β)、肝细胞生长因子(HGF)、成纤维细胞生长因子(FGF)以及Ras、PI3K、Wnt、micRNA、Notch等信号分子诱导。研究已显示TGF-β1可诱导肺腺癌细胞A549发生EMT[10],本实验采用TGF-β1干预A549细胞,使细胞发生了EMT改变:细胞极性丧失,呈纺锤样,出现伪足,而且分子标志物显示E-cadherin明显下降,而Vimentin、Snail表达增加。
为研究EMT对Nrf2通路的影响,本实验检测了Nrf2的蛋白表达及其下游分子GST和GSH的活性及含量。结果显示肺腺癌细胞发生EMT改变后Nrf2蛋白表达显著升高,GST活性和GSH含量明显增加,提示EMT和Nrf2/GST/GSH通路存在密切关系。为探索两者与耐药之间的关系,检测了发生EMT前后,肺腺癌细胞A549对顺铂耐药指数的改变,结果显示细胞发生EMT后对顺铂的抑制率下降,细胞耐药指数是非EMT的7.7倍。而对Nrf2进行siRNA后,细胞的耐药指数是非EMT的2.24倍,显著逆转了耐药。以上结果提示EMT可能通过Nrf2/GST/GSH通路引起了多药耐药的发生。需进一步深入研究Nrf2通路引起耐药的分子机制。
| [1] | De Craene B, Berx G. Regulatory networks defining EMT during cancer initiation and progression[J]. Nat Rev Cancer, 2013, 13(2): 97-110. |
| [2] | Shang Y, Cai X, Fan D. Roles of epithelial-mesenchymal transition in cancer drug resistance[J]. Curr Cancer Drug Targets, 2013, 13(9): 915-29. |
| [3] | Jaramillo MC, Zhang DD. The emerging role of the Nrf2-Keap1 signaling pathway in cancer[J]. Genes Dev, 2013, 27(20): 2179-91. |
| [4] | Lim J, Lee SH, Cho S, et al. 4-methoxychalcone enhances cisplatin-induced oxidative stress and cytotoxicity by inhibiting the Nrf2/ARE-mediated defense mechanism in A549 lung cancer cells[J]. Mol Cells, 2013, 36(4): 340-6. |
| [5] | Suda K, Tomizawa K, Fujii M, et al. Epithelial-to-mesenchymal transition in an epidermal growth factor receptor-mutant lung cancer cell line with acquired resistance to erlotinib[J]. J Thorac Oncol, 2011, 6(7): 1152-61. |
| [6] | Shintani Y, Okimura A, Sato K, et al. Epithelial-to-mesenchymal transition is a determinant of senditivity to chemoradiotherapy in non-small cell[J]. Ann Thorac Surg, 2011, 92(5): 1794-804. |
| [7] | Cui W, Ma HY, Kong L. Research progress in the Nrf2/ARE pathway and the mechanism of antioxidation[J]. Jilin Da Xue Xue Bao: Yi Xue Ban, 2011, 37(1): 187. [崔俣, 马海英, 孔力. Nrf2/ARE通路与机体抗氧化机制的研究进展[J]. 吉林大学学报: 医学版, 2011, 37(1): 187.] |
| [8] | Zhao CR, Gao ZH, Qu XJ. Nrf2-ARE signaling pathway and natural products for cancer chemoprevention[J]. Cancer Epidemiol, 2010, 34 (5): 523-33. |
| [9] | Zhang KR, Yan HQ, Wang Y. Expression and significance of Nrf2 and its target genes in pulmonary adenocarcinoma A549 cells resistant to cisplatin[J]. Zhongguo Fei Ai Za Zhi, 2009, 12(11): 1150-4. [张凯茹, 闫惠琴, 王燕. Nrf2及其靶基因在人肺腺癌A549顺铂耐药细胞株中的表达和意义[J]. 中国肺癌杂志, 2009, 12(11): 1150-4.] |
| [10] | Kim JH, Jang YS, Eom KS, et al. Transforming growth factor beta1 induces epithelial-to-mesenchymal transition of A549 cells[J]. J Korean Med Sci, 2007, 22(5): 898-904. |
 2015, Vol. 42
2015, Vol. 42
