文章信息
- 谭莉,周茜,王艺蓁,祖旭宇.2015.
- TAN Li, ZHOU Xi, WANG Yizhen, ZU Xuyu. 2015.
- 三阴性乳腺癌的分子分型及应用
- Molecular Classification of Triple Negative Breast Cancer and Its Applications
- 肿瘤防治研究, 2015, 42(03): 300-304
- Cancer Research on Prevention and Treatment, 2015, 42(03): 300-304
- http://www.zlfzyj.com/CN/10.3971/j.issn.1000-8578.2015.03.019
-
文章历史
- 收稿日期:2014-03-14
- 修回日期:2014-05-05
乳腺癌是目前女性最常见的恶性肿瘤之一, 近年来,由于诊断技术和治疗水平的提高,乳腺 癌的生存率有了明显的改善。然而,三阴性乳腺 癌(triple negative breast cancer,TNBC)的生存率 却仍没有提高。由于三阴性乳腺癌的异质性及缺 乏特定的分子治疗靶点,目前三阴性乳腺癌的治 疗面临着严峻的挑战[1,2]。TNBC是一类生物学特性 高度异质性的肿瘤,根据组织学、分子生物学等 技术,可将其分为不同的亚型,研究表明其至少 可分为6种亚型,不同分子亚型的三阴性乳腺癌将 表现出不同的临床表现、治疗反应及预后。近期 研究发现,在三阴性乳腺癌中,不同的基因表达 亚型表现出不同的遗传事件(例如:Luminal AR 亚型似乎更容易发生PIK3CA突变),这些重要的 遗传事件可能为TNBC的基因靶向治疗提供重要依 据[3,4]。随着基因芯片及组织微阵列等高通量研究 技术的出现,更为乳腺癌基因分型的进一步研究 提供了技术支持。加深对三阴性乳腺癌分子分型 的认识,对于指导临床上三阴性乳腺癌的针对性 治疗具有较高的价值。 1 三阴性乳腺癌的病理特性 研究表明,三阴性乳腺癌表现出特殊的临床病 理学特性。大多数三阴性乳腺癌属于无特殊类型 高度浸润性导管癌,其病理特征为高核分级、高 有丝分裂指数、间质淋巴细胞浸润、中心坏死以 及压迫临近组织[5]等。TNBC病理特征分析发现, 此类乳腺癌的组织学分级多为三级,细胞增殖比 例较高,C-KIT、P53和EGFR表达多为阳性[6]。
高侵袭性三阴性乳腺癌大部分由无特殊类型 浸润性导管癌组成,此外,一些罕见的特殊病理 类型的乳腺癌几乎全部是三阴性表型。化生性癌 的特点是一组在形态结构和生物化学成分上沿多 胚层分化产生异源性成分的乳腺癌(例如:梭形 细胞癌、鳞状细胞癌等),其免疫表型常为三阴 型[7,8]。此外,一些类型的大汗腺癌也是三阴性表 型[9],它们属于三阴性乳腺癌的一个特殊的分子亚 型,即Luminal雄激素受体(Luminal AR)或分子 大汗腺亚型。 2 三阴性乳腺癌的分子特性 2.1 三阴性乳腺癌的基因表达亚型
Perou等[10]利用基因芯片和组织微阵列等技 术,发现不同类型乳腺癌之间基因表达存在较大 差异,提出将乳腺癌分为5个基本亚型,即Luminal A、Luminal B、ERBB-2(+)、basal-like和normallike 亚型,其中有一些亚型属于三阴性表型。这些 亚型包括:(1)低紧密连接蛋白(claudin-low) 肿瘤[11,12,13],其富含干细胞样细胞和EMT(上皮间质 化)特征;(2)富含IFN(IFN-rich)肿瘤[14],其 预后显著好于其他三阴性乳腺癌;(3)分子大汗 腺肿瘤(molecular apocrine cancer)[15,16],以雄激 素受体通路激活为特征[14,15,16,17]。
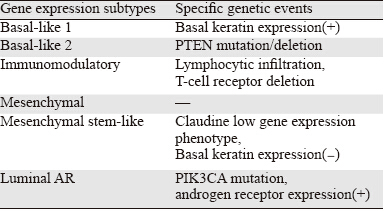
Lehmann等[18]研究发现三阴性乳腺癌由不同 的分子亚型组成。他们通过对587例三阴性乳腺癌 患者的数据分析,确定了6种三阴性乳腺癌基因表 达亚型——基底细胞样1(BL1)、基底细胞样2 (BL2)、免疫调节(IM)、间充质样(ML)、 间充质干细胞样(MSL)和腔上皮样雄激素受体 (Luminal AR)亚型。基底样三阴性乳腺癌亚型 可以分为两个子亚型——BL1和BL2,基底样亚型 1(BL1)乳腺癌增殖相关基因和DNA损伤反应相 关基因表达活跃,基底样亚型2(BL2)乳腺癌生 长因子信号通路相关基因表达活跃。研究表明基 底细胞样亚型1乳腺癌对顺铂等特异性DNA损伤药 物敏感[19]。Luminal AR亚型约占三阴性乳腺癌的 10%,它是一个独特的基因表达亚型,具有许多雌 激素受体阳性Luminal乳腺癌的特性。间质细胞样 三阴性乳腺癌亚型,由于上皮组织间质化相关基 因高表达而命名,其增殖活性低于基底细胞样三 阴性乳腺癌[18]。 2.2 基因突变亚型
大规模并行测序的出现(也称为新一代测 序)大大提高了我们研究三阴性乳腺癌生物学特 点和遗传特性的能力[20,21]。Shah等[20,21]发现三阴 性乳腺存在大量的基因突变事件,三阴性乳腺癌 的共同遗传事件是TP53的突变,其发生在约80% 的三阴性乳腺癌中,而其他的基因突变发生频率 较低,例如:PTEN突变和(或)纯合子的缺失、 EGFR的上调和FGFR2的上调在三阴性乳腺癌中发 生的频率分别为10%、5%、4%[20,21,22]。在ER/HER2 阳性乳腺癌中较常见的突变,例如PIK3CA突变, 也发生于约7%~10%三阴性乳腺癌中[23]。大多数 三阴性乳腺癌存在Retinoblastoma 通路(RB pathway) 功能缺失。ER阳性乳腺癌中,RB通路是由 CCND1上调和获得CKD4激活形成,而在三阴性 乳腺癌中,这条通路的失活是由于RB1的缺失或突 变(-20%)和CCNE1的上调(-9%)所引起。 2.3 基因表达亚型和基因突变之间的联系
统计学分析揭示三阴性乳腺癌基因表达亚型 和特定的基因突变事件之间存在关联,Luminal AR亚型似乎更容易发生PIK3CA突变[18,24]。乳腺癌 细胞系SUM52和MFM223存在FGFR-2上调,它们 都属于Luminal AR表型。因此,Luminal AR亚型 可能富含酪氨酸激酶受体上调的遗传事件[22]。
 |
在non-Luminal三阴性乳腺癌中(例如:基底 样或间质样组织类型),由于PTEN或INPP4B的缺 失,磷酸肌醇3激酶(PI3K)通路被频繁的激活。 研究表明70%~85%的BRCA1突变的乳腺癌属于三 阴性表型,且BRCA1种系突变和PTEN缺失之间似 乎存在联系[25]。 3 三阴性乳腺癌个体化治疗所面临的挑战 3.1 基因表达或基因突变事件定义亚型
三阴性乳腺癌的高度异质性给三阴性乳腺癌 的靶向治疗带来挑战。根据三阴性乳腺癌特殊的 分子特性,同一种亚型群体可能需要两种互补的 靶向治疗:一种以基因表达亚型为基础;另一种 以基因突变事件为依据。
由于易控制的突变取代了基因表达分型,基 因表达亚型在许多肿瘤中还未能应用于临床。例 如小细胞肺癌目前已经确定了多种基因表达亚 型,但其临床分类方法仍以基因突变(例如: EGFR突变、ALK和ROS基因重排)为依据,以预 测它们对特定靶向治疗的反应[26]。然而,根据我 们目前对三阴性乳腺癌基因突变的定义,许多三 阴性乳腺癌并没有一个可操作的突变[24],说明在 三阴性乳腺癌中基因突变和基因表达在三阴性乳 腺癌分型中同样重要,这对于乳腺癌亚型特异性 治疗研究也至关重要[27]。 3.2 三阴性乳腺癌分子分型存在的问题
三阴性乳腺癌的分子分型,对临床上提高三 阴性乳腺癌治疗的特异性和有效性具有重要作 用,不过由于目前对乳腺癌分子分型的认识还不 完善,分型的方法也不完全一致,有约10%的肿 瘤尚不能分型。近年来,随着基因芯片和组织微 阵列等技术的发展,大大加深了我们对三阴性乳 腺癌分子分型的认识。但不同的基因芯片平台对 肿瘤的分型检测结果可能会出现差异,且费用昂 贵、实际操作困难,只能局限于实验室,很难广 泛应用于临床。临床上大多采用免疫组织化学法 检测分子生物学标志物的表达从而对乳腺癌进行 分子分型[28]。但肿瘤组织的异质性可能会导致不 同部位的肿瘤组织表现出不同的结果[29]。因此免 疫组织化学法尚不能完全取代基因芯片技术对乳 腺癌进行分子分型。 3.3 肿瘤内的遗传异质性
尽管大多数肿瘤是单克隆起源,但人们逐渐 认识到个体肿瘤的内部存在异质性[30]。分子生物 学研究也证实肿瘤演进过程中不断产生新的突 变,这为肿瘤遗传异质性提供了基础[31]。三阴性 乳腺癌表现出高度的基因不稳定性,会导致肿瘤 遗传的多样性。因此以单一的突变位点代表的只 是肿瘤内的一个亚克隆,可能不会产生显著地临 床反应,这将为三阴性乳腺癌的个体化治疗带来 困难[32]。
原发灶的遗传异质性只是肿瘤遗传异质性的 一方面,肿瘤是一种全身系统性疾病,恶性肿瘤 可通过血管和淋巴等方式发生转移。因此,仅了 解原发灶肿瘤异质性是不全面的,还应当分析转 移的肿瘤细胞,那么肿瘤转移灶的活组织检查对 评估生物学标志物的临床意义也将显得非常重 要。Houssami等[33,34]研究表明在乳腺癌的原发灶 和转移灶中,其ER和Her-2表达状态是不同的,这 说明原发灶和转移灶的肿瘤细胞可能也存在遗传 异质性。虽然在三阴性乳腺癌中肿瘤细胞来自不 同的转移处是否拥有其特有的突变尚不清楚,但 是已有报道证明其原发灶和转移灶的突变种类存 在不同之处。因此,仅针对原发灶制定的诊断和 治疗策略可能并不合理。 4 三阴性乳腺癌分子分型的临床意义
EGFR表达于大约60%的三阴性乳腺癌,说 明EGFR可能是三阴性乳腺癌一个潜在的治疗靶 点[35]。然而研究发现以EGFR为靶点的药物西妥 昔单抗在三阴性乳腺癌的治疗中只表现出低活 性,其作为单药治疗仅有6%的有效性,与顺铂 联合的化疗有效率(20%)比单用顺铂的有效率 (10.3%)只有少许的提高[36]。这些临床有效性 的研究都未充分考虑三阴性乳腺癌的异质性,那 么我们有必要进一步评估西妥昔单抗对三阴性乳 腺癌特定的亚型或EGFR表达上调的三阴性乳腺 癌是否有治疗效果。
不同亚型三阴性乳腺癌表现出其特殊的生物 学特性,因此,特定基因表达亚型的三阴性乳腺 癌对其针对性的治疗方法可能具有高反应性。基 底样亚型乳腺癌增殖相关基因和DNA损伤相关 基因表达活跃,表明这种亚型可能对抗有丝分裂 的药物紫衫烷类(例如:紫杉醇或多西他赛)较 敏感,研究已证实,TNBC患者在应用以紫衫烷 类为基础的化疗方案后,basal-like亚型(BL1和 BL2)得到的临床缓解率比MSL亚型和Luminal AR(LAR)亚型均高出4倍[37,38]。BL亚型TNBC 对顺铂化疗的敏感度也高于其他亚型的三阴性乳 腺癌。
MSL亚型较易发生上皮组织间质化和细胞迁 移。许多研究已表明Src基因在高侵袭性肿瘤中发 挥重要作用(包括处于EMT过程中的肿瘤)。由 于MSL亚型中EMT相关基因表达较高,而Scr基因 在EMT和肿瘤迁移过程中发挥重要作用,那么Scr 抑制剂达沙替尼可能对间质样三阴性乳腺癌具有 治疗作用。Lehmann等[18]研究结果发现间质样亚 型三阴性乳腺癌细胞系(ML和MSL)对Scr抑制 剂达沙替尼的敏感度高于LAR亚型。Wnt/β-catenin 通路可调节EMT过程从而促进肿瘤细胞转移[39], 而MSL亚型乳腺癌中存在此通路的突变[40],因 此,Wnt/β-catenin通路的抑制剂对MSL亚型TNBC 的治疗可能具有重要的价值。
AR亚型的三阴性乳腺癌细胞系对AR受体拮 抗剂比卡鲁胺和HSP90抑制剂17-DMAG较敏感, 这表明雄激素受体可能是LAR亚型三阴性乳腺癌 治疗的重要靶点。Tabchy等[41]通过筛选三阴性乳 腺癌AR的表达来鉴别Luminal AR表型,结果发现 AR拮抗剂比卡鲁胺治疗AR阳性的三阴性乳腺癌 患者能提高19%的临床有效率,虽然增加的有效 率相对较低,但是正在研究的更有效的AR拮抗剂 恩杂鲁胺(enzalutamide),可能对这一类三阴性 乳腺癌患者的治疗带来希望。此外,LAR亚型对 PI3K抑制剂NVP-BEZ235同样敏感,这种敏感度 和PIK3CA突变存在相关性,这表明AR拮抗剂和 PI3K抑制剂联合治疗对LAR亚型可能具有较高的 有效率,这可能为Luminal AR亚型乳腺癌提供一 种新型、有效的化疗方法[42]。
综上所述,6种不同亚型的三阴性乳腺癌表现 出不同的分子特性及不同的遗传事件,对治疗表 现出不同的敏感度,深入了解三阴性乳腺癌的分 子分型后,我们可依据不同亚型三阴性乳腺癌的 分子生物学特点制定特异性的化疗方案,这对实 现三阴性乳腺癌的个体化治疗具有重要意义。
| [1] | Pegram MD, Lipton A, Hayes DF, et al. PhaseⅡstudy of receptorenhancedchemosensitivity using recombinant humanized antip185HER2/neu monoclonal antibody plus cisplatin in patientswith HER2/neu-overexpressing metastatic breast cancer refractoryto chemotherapy treatment[J]. J Clin Onco, 1998, 16(8): 2659-71. |
| [2] | Carey LA, Dees EC, Sawyer L, et al. The triple negative paradox:primary tumor chemosensitivity of breast cancer subtypes[J]. ClinCancer Res, 2007, 13(8): 2329-34. |
| [3] | Rakha EA, Elsheikh SE, Aleskandarany MA, et al. Triplenegativebreast cancer: distinguishing between basal andnonbasal subtypes[J]. Clin Cancer Res, 2009, 15(7): 2302-10. |
| [4] | Foulkes WD, Smith IE, Reis-Filho JS, et al. Triple-negative breastcancer[J]. N Engl J Med, 2010, 363(20): 1938-48. |
| [5] | Turner NC, Reis-Filho JS. Basal-like breast cancer and the BRCA1phenotype[J]. Oncogene, 2006, 25(43): 5846-53. |
| [6] | Rakha EA, El-Sayed ME, Green AR, et al. Prognostic markers intriple-negative breast cancer[J]. Cancer, 2007, 109 (1): 25-32. |
| [7] | Weigelt B, Kreike B, Reis-Filho JS. Metaplastic breast carcinomasare basal-like breast cancers:a genomic profiling analysis[J].Breast Cancer Res Treat, 2009, 117(2): 273-80. |
| [8] | Hennessy BT, Giordano S, Broglio K, et al. Biphasic metaplasticsarcomatoid carcinoma of the breast[J]. Ann Oncol, 2006, 17(4):605-13. |
| [9] | Lehmann-Che J, Hamy AS, Porcher R, et al. Molecular apocrinebreast cancers are aggressive estrogen receptor negative tumorsoverexpressing either HER2 or GCDFP15[J]. Breast Cancer Res,2013, 15(3): R37. |
| [10] | Perou CM, S?rlie T, Eisen MB, et al. Molecular portraits of humanbreast tumours[J]. Nature, 2000, 406(6797): 747-52. |
| [11] | Prat A, Parker JS, Karginova O, et al. Phenotypic and molecularcharacterization of the claudin-low intrinsic subtype of breastcancer[J]. Breast Cancer Res, 2010, 12(5): R68. |
| [12] | Hennessy BT, Gonzalez-Angulo AM, Stemke-Hale K, et al.Characterization of a naturally occurring breast cancer subsetenriched in epithelial-to-mesenchymal transition and stem cellcharacteristics[J]. Cancer Res, 2009, 69(10): 4116-24. |
| [13] | Herschkowitz JI, Simin K, Weigman VJ, et al. Identification ofconserved gene expression features between murine mammarycarcinoma models and human breast tumors[J]. Genome Biol,2007, 8(5): R76. |
| [14] | Hu Z, Fan C, Oh DS, et al. The molecular portraits of breasttumors are conserved across microarray platforms[J]. BMCGenomics, 2006,7: 96. |
| [15] | Farmer P, Bonnefoi H, Becette V, et al. Identification of molecularapocrine breast tumours by microarray analysis[J]. Oncogene,2005, 24(29): 4660-71. |
| [16] | Doane AS, Danso M, Lal P, et al. An estrogen receptor-negativebreast cancer subset characterized by a hormonally regulatedtranscriptional program and response to androgen[J]. Oncogene,2006, 25(28): 3994-4008. |
| [17] | Guedj M, Marisa L, de Reynies A, et al. A refined moleculartaxonomy of breast cancer[J]. Oncogene, 2012, 31(9): 1196-206. |
| [18] | Lehmann BD, Bauer JA, Chen X, et al. Identification of humantriple-negative breast cancer subtypes and preclinical models forselection of targeted therapies[J]. J Clin Invest, 2011, 121(7):2750-67. |
| [19] | Prat A, Adamo B, Cheang MC, et al. Molecular characterizationof basal-like and non-basal-like triple-negative breast cancer[J].Oncologist, 2013, 18(2): 123-33. |
| [20] | Shah SP, Roth A, Goya R, et al. The clonal and mutationalevolution spectrum of primary triple-negative breast cancers[J].Nature, 2012, 486(7403): 395-9. |
| [21] | Cancer Genome Atlas Network. Comprehensive molecular portraitsof human breast tumours[J]. Nature, 2012, 490(7418): 61-70. |
| [22] | Turner N, Lambros MB, Horlings HM, et al. Integrative molecularprofiling of triple negative breast cancers identifies amplicondrivers and potential therapeutic targets[J]. Oncogene, 2010,29(14): 2013-23. |
| [23] | Stemke-Hale K, Gonzalez-Angulo AM, Lluch A, et al. Anintegrative genomic and proteomic analysis of PIK3CA, PTEN,and AKT mutations in breast cancer[J]. Cancer Res, 2008, 68(15):6084-91. |
| [24] | Gonzalez-Angulo AM, Stemke-Hale K, Palla SL, et al. Androgenreceptor levels and association with PIK3CA mutations andprognosis in breast cancer[J]. Clin Cancer Res, 2009, 15(7):2472-8. |
| [25] | Saal LH, Gruvberger-Saal SK, Persson C, et al. Recurrent grossmutations of the PTEN tumor suppressor gene in breast cancerswith deficient DSB repair[J]. Nat Genet, 2008, 40(1): 102-7. |
| [26] | Weigelt B, Pusztai L, Ashworth A, et al. Challenges translatingbreast cancer gene signatures into the clinic[J]. Nat Rev ClinOncol, 2012, 9(1): 58-64. |
| [27] | Kaelin WG Jr. The concept of synthetic lethality in the context ofanticancer therapy[J]. Nat Rev Cancer, 2005, 5(9): 689-98. |
| [28] | Marusyk A, Almendro V, Polyak K. Intra-tumour heterogeneity:alooking glass for cancer?[J]. Nat Rev Cancer, 2012, 12(5): 323-34. |
| [29] | Longo DL. Tumor heterogeneity and personalized medicine[J]. NEngl J Med, 2012, 366(10): 956-7. |
| [30] | Shibata D. Cancer. Heterogeneity and tumor history[J]. Science,2012, 336(6079): 304-5. |
| [31] | Gerlinger M, Rowan AJ, Horswell S, et al. Intratumor heterogeneityand branched evolution revealed by multiregion sequencing[J]. NEngl J Med, 2012, 366(10): 883-92. |
| [32] | Torres L, Ribeiro FR, Pandis N, et al. Intratumor genomicheterogeneity in breast cancer with clonal divergence betweenprimary carcinomas and lymph node metastases[J]. Breast CancerRes Treat, 2007, 102(2): 143-55. |
| [33] | Yang YL, Fan Y, Lang RG, et al. Genetic heterogeneity of HER2in breast cancer:impact on HER2 testing and its clinicopathologicsignificance[J]. Breast Cancer Res Treat, 2012, 134(3): 1095-102. |
| [34] | Houssami N, Macaskill P, Balleine RL, et al. HER2 discordancebetween primary breast cancer and its paired metastasis: tumorbiology or test artefact? Insights through meta-analysis[J]. BreastCancer Res Treat, 2011, 129(3): 659-74. |
| [35] | Corkery B, Crown J, Clynes M, et al. Epidermal growth factorreceptor as a potential therapeutic target in triple- negative breastcancer[J]. Ann Oncol, 2009, 20(5): 862-7. |
| [36] | Carey LA, Rugo HS, Marcom PK, et al. TBCRC 001:randomizedphase Ⅱ study of cetuximab in combination with carboplatinin stage Ⅳ triple-negative breast cancer[J]. J Clin Oncol, 2012,30(21): 2615-23. |
| [37] | Bauer JA, Chakravarthy AB, Rosenbluth JM, et al. Identificationof markers of taxane sensitivity using proteomic and genomicanalyses of breast tumors from patients receiving neoadjuvantpaclitaxel and radiation[J]. Clin Cancer Res, 2010, 16(2): 681-90. |
| [38] | Juul N, Szallasi Z, Eklund AC, et al. Assessment of an RNAinterference screen-derived mitotic and ceramide pathwaymetagene as a predictor of response to neoadjuvant paclitaxel forprimary triple-negative breast cancer: a retrospective analysis offive clinical trials[J]. Lancet Oncol, 2010, 11(4): 358-65. |
| [39] | Shin SY, Rath O, Zebisch A, et al. Functional roles of multiplefeedback loops in extracellular signal-regulated kinase andWnt signaling pathways that regulate epithelial-mesenchymaltransition[J]. Cancer Res, 2010, 70(17): 6715-24. |
| [40] | Hayes MJ, Thomas D, Emmons A, et al. Genetic changes of Wntpathway genes are common events in metaplastic carcinomas ofthe breast[J]. Clin Cancer Res, 2008, 14(13): 4038-44. |
| [41] | Tabchy A, Ma CX, Bose R, et al. Incorporating genomics intobreast cancer clinical trials and care[J]. Clin Cancer Res, 2013,19(23): 6371-9. |
| [42] | Stemke-Hale K, Gonzalez-Angulo AM, Lluch A, et al. Anintegrative genomic and proteomic analysis of PIK3CA, PTEN,and AKT mutations in breast cancer[J]. Cancer Res, 2008, 68(15):6084-91 |
 2015, Vol. 42
2015, Vol. 42


