文章信息
- 张素欣,包阳,张敬,高岚,陈中,李天客,段玉芹. 2015.
- ZHANG Suxin, BAO Yang, ZHANG Jing, GAO Lan, CHEN Zhong, LI Tianke, DUAN Yuqin. 2015.
- 口腔鳞癌患者外周血及癌组织中IL-17和Foxp3的表达及意义
- Clinical Significance of IL-17 and Foxp3 Expression in Peripheral Blood and Tumor Tissues in Patients with Oral Squamous Cell Carcinoma
- 肿瘤防治研究, 2015, 42(03): 246-251
- Cancer Research on Prevention and Treatment, 2015, 42(03): 246-251
- http://www.zlfzyj.com/CN/10.3971/j.issn.1000-8578.2015.03.008
-
文章历史
- 收稿日期:2014-04-03
- 修回日期:2014-10-13
2. 050011石家庄,河北医科大学第二医院口腔科
2.Department of Stomatology, The Second Hospital of Hebei Medical University, Shijiazhuang 050000, China
口腔癌作为头颈部较为常见的一类恶性肿 瘤,以鳞状细胞癌最为多见,传统的综合治疗方 法难以提高口腔癌的5年生存率,较高的局部复发 率是口腔颌面外科医师必须面对的棘手问题。近 年来,国内外研究表明,机体免疫系统监视着恶 性肿瘤的发生和转移,虽然免疫功能低下不直接 导致恶性肿瘤发生,但却影响着其发展、转归及 预后等状况。因此,应用免疫治疗来辅助并巩固 口腔癌的治疗成为我们关注的焦点。
白介素17(IL-17)作为辅助性T细胞17(Th17) 分泌的一类特征性细胞因子及主要效应因子,具有 强大的促炎性反应能力[1, 2],CD4+CD25+Foxp3+调节 性T细胞(CD4+CD25+Foxp3+Treg)是一种免疫抑制 性细胞,通过高表达CD4、CD25及Foxp3分子来发 挥强烈的抑制功能,导致肿瘤免疫逃逸的发生[3]。 Foxp3基因是目前公认的Treg细胞特异性的标记, 在Treg细胞的发育及调控中起着关键作用[4, 5]。
本研究拟通过检测口腔鳞癌(oral squamous cell carcinoma,OSCC)患者外周血及癌组织中 IL-17和Foxp3的表达,探讨IL-17和Foxp3在口腔鳞 癌发生发展中的作用,为其应用于临床免疫治疗 及评估预后提供依据。 1 资料与方法 1.1 临床资料
随机选取2011年9月—2012年10月河北医科大 学第四医院口腔科40例原发初诊经病理证实的口 腔鳞癌患者,发病部位包括舌、颊、腭、牙龈、 口底等,年龄40~72岁,中位年龄60岁,男女比例 为1.35∶1,按照国际抗癌协会(UICC)2002年公 布的TNM分期标准分为:Ⅰ期7例,Ⅱ期19例,Ⅲ 期6例,Ⅳ期8例。选取20例良性肿瘤患者的瘤旁 经病理证实的正常口腔黏膜作组织对照。研究对 象分为3组,A组26例(Ⅰ+Ⅱ期)、B组14例(Ⅲ +Ⅳ)、C组20例(健康者),各组对象均为非急 性感染期并排除全身系统性疾病,实验已取得患 者及家属知情同意。 1.2 主要试剂及仪器
FITC-鼠抗人CD4单抗、PE-鼠抗人IL-17单 抗、CD4-FITC/CD8-PE双标抗体、CD3-FITC/ CD56-PE双标抗体(美国Beckman Coulter公司), Cy5-鼠抗人Foxp3单抗(美国eBioscience公司), 兔抗人IL-17多克隆抗体、兔抗人Foxp3多克隆抗体 (武汉博士德生物工程有限公司),SP免疫组织 化学染色试剂盒、DAB显色试剂盒(北京中杉金 桥生物科技有限公司),流式细胞仪Epics-XL Ⅱ 型(美国Beckman Coulter公司)。 1.3 实验方法 1.3.1 标本采集及处理
清晨空腹状态下,抽取各组对象外周静脉血 3 ml,抗凝管收集血样,用于流式细胞术检测。 手术切除新鲜标本均用10%中性福尔马林液固 定,常规脱水、石蜡包埋,每例连续切片4张, 切片厚度4 μm,置于经预处理的载玻片上,于 68℃培养箱中放置8 h以上,备免疫组织化学IL-17 和Foxp3染色用。 1.3.2 外周血中IL-17、Foxp3的测定
取各组肝素抗凝外周静脉血100 μl,加入10 μl FITC标记的CD4单抗,室温、避光标记30 min, 加入破膜剂(0.1% triton-x100)1 ml作用1 min, 加入PBS洗涤细胞1次,分别加入10 μl PE标记的鼠 抗人IL-17、Foxp3抗体,同时设同型对照管,轻轻 振荡混匀后,室温、避光标记30 min,加入红细胞 裂解液裂解红细胞。流式细胞仪测定,CD4+T细胞 设门,分析门中IL-17阳性细胞比例,应用Expo 32 ADC软件进行免疫荧光数据分析。 1.3.3 T淋巴细胞表面标志的测定
取肝素抗凝外周静脉血各100 μl,分别加入 CD4-FITC/CD8-PE及CD3-FITC/CD56-PE双标抗体 各10 μl,在室温下避光放置30 min,加入红细胞裂 解液裂解红细胞,上流式细胞仪进行检测,应用 Expo 32 ADC软件进行免疫荧光数据分析。 1.3.4 组织中IL-17、Foxp3的测定
采用免疫组 织化学SP(streptavidill-perosidase)法分别观察各 组组织中IL-17与Foxp3的表达。IL-17的阳性染色 为细胞质或细胞膜内有棕黄色颗粒,Foxp3的阳性 染色为细胞核内有棕黄色颗粒,以PBS代替一抗 的正常口腔黏膜上皮组织免疫组织化学染色结果 作阴性对照,以试剂盒自带阳性片免疫组织化学 染色结果作阳性对照。每张切片随机选取5个高倍 视野,读取100个细胞中的阳性细胞数,取其平均值。先根据阳性细胞所占的百分数计分:<5%计 为0分;5%~25%计为1分;>25%~50%计为2分; >50%~75%计为3分;>75%计为4分。再根据阳性 细胞染色强度计分:无着色计为0分;淡黄色计为1 分;棕黄色计为2分;棕褐色计为3分。两者积分相 加所得的总分按照:0~1分计为(-);2~3分计为 (+);4~5分计为(++);6~7分计为(+++)[6]。 阴性(-)和弱阳性(+)归为阴性(-),中度阳 性(++)和强阳性(+++)归为阳性(+)。 1.4 统计学方法
实验数据均采用均数±标准差(x ±s)来表 示,应用SPSS 13.0统计软件进行分析,采用t检 验、χ2检验和Pearson相关性分析等方法进行相关检 验,若资料不符合正态分布或方差不齐,则应用 非参数检验,P<0.05为差异有统计学意义。 2 结果 2.1 外周血中IL-17及Foxp3的测定
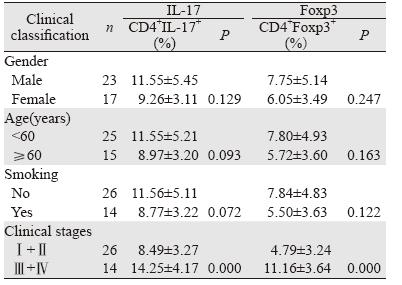
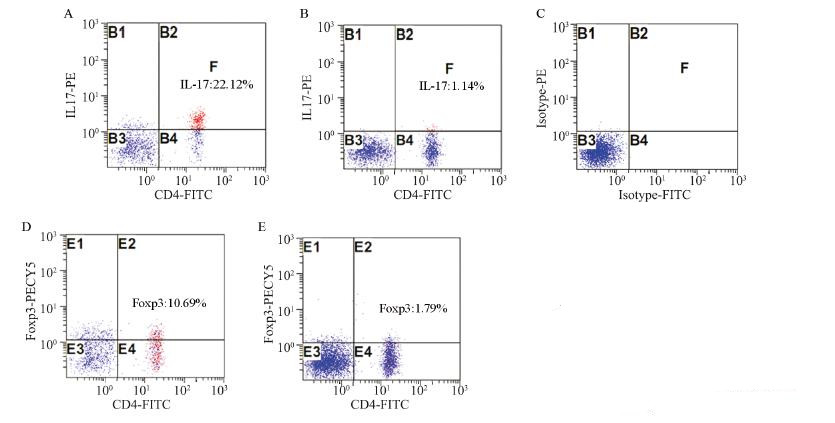
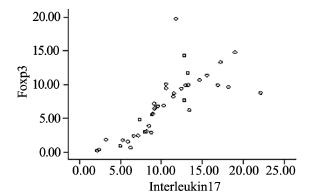
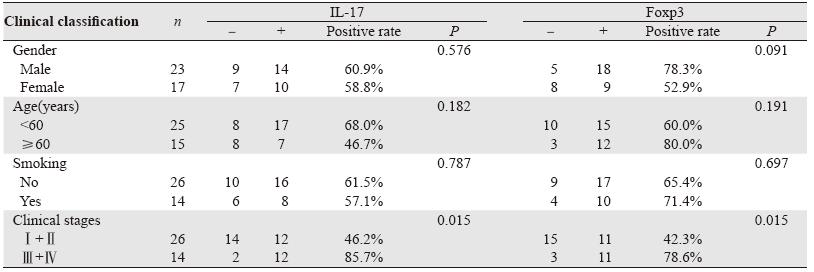
A和B组外周血中CD4+IL-17+、CD4+Foxp3+ 细胞的比例分别为(10.50±4.52)%、(7.02± 4.54)%,均显著高于C组(1.45±0.19)%、 (2.73±0.60)%(P<0.01),并且二者的表达 水平呈正相关(r=0.772,P<0.05)。B组患 者CD4+IL-17+、CD4+Foxp3+细胞的比例分别 为(14.25±4.17)%、(11.16±3.64)%,显 著高于A组(8.49±3.27)%、(4.79±3.24)% (P<0.05)。IL-17、Foxp3的表达与性别、年龄及 吸烟与否无相关性(P>0.05),见表 1、图 1~2。
 |
|
| A: IL17-PE in the peripheral blood of patients with oral squamous cell carcinoma(OSCC); B: IL17-PE in the peripheral blood of normal subjects; C: Isotype control; D: Foxp3-PE of in the peripheral blood of OSCC patients; E: Foxp3-PE in the peripheral blood of normal subjects 图 1 流式细胞术检测外周血中CD4+IL-17+T细胞和CD4+Foxp3+T细胞比例 Figure 1 The proportion of CD4+IL-17+T and CD4+Foxp3+T cells in peripheral blood determined by flow cytometry(FCM) |
|
| 图 2 外周血中CD4+IL-17+T细胞和CD4+Foxp3+T细胞表达水平的相关性 Figure 2 Correlation of CD4+IL-17+T and CD4+Foxp3+T cell expression in peripheral blood specimen |
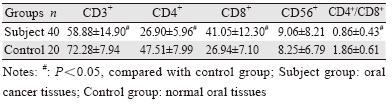
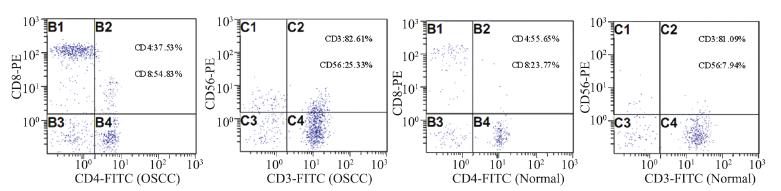
与对照组相比,实验组外周血中CD3+和 CD4+细胞的百分率、CD4+/CD8+的比值降低,CD8+细胞的百分率升高,差异均有统计学意义 (P<0.05);CD56+细胞的表达较对照组高,但差 异无统计学意义(P>0.05),见表 2、图 3。
 |
|
| 图 3 流式细胞术检测外周血中CD3+、 CD4+、 CD8+和CD56+ T细胞比例 Figure 3 The proportion of CD3+,CD4+,CD8+ and CD56+ T cells in peripheral blood determined by FCM |
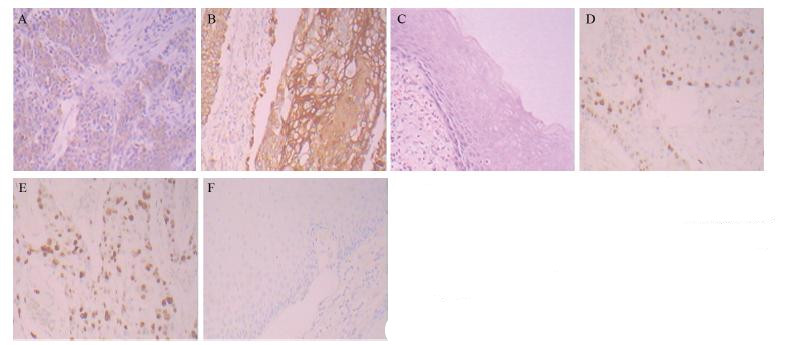
IL-17、Foxp3在实验组中阳性率分别为60.0% (24/40)、67.5%(27/40),均明显高于对照组 [10.0%(2/20)、0%(0/20)],差异具有统计学 意义 (P<0.01)。IL-17在Ⅲ+Ⅳ期口腔癌癌组织 中的阳性表达率为85.7%(12/14),显著高于Ⅰ +Ⅱ期的阳性表达率46.2%(12/26)(P<0.05); Foxp3在Ⅲ+Ⅳ期癌组织中阳性表达率为78.6% (11/14),显著高于Ⅰ+Ⅱ期的阳性表达率42.3% (11/26)(P<0.05)。癌组织中IL-17与Foxp3表 达水平呈正相关性(r=0.386,P<0.05)。性别、 年龄及吸烟与否与癌组织中IL-17、Foxp3的表达未 见明显相关性(P>0.05),见表 3、图 4 。
 |
|
| A: OSCC tissues(IL-17-); B: OSCC tissues (IL-17+); C: normal group (IL-17); D: OSCC tissues(Foxp3-); E: OSCC tissues (Foxp3+); F: normal group (Foxp3) 图 4 口腔鳞癌组织和正常组织中IL-17和Foxp3的表达 (HE ×200) Figure 4 The expression of IL-17 and Foxp3 in OSCC and normal tissues (HE ×200) |
口腔鳞状细胞癌简称口腔鳞癌,是最常见的 口腔恶性肿瘤,5年生存率只有40%~50%,因发 病部位位于口腔颌面部,无论是在发病过程中, 还是应用传统方法进行治疗,颜面部的畸形都严 重影响了患者的生活质量。如何早期发现肿瘤并 进行针对性的个体预防及治疗,成为现代医疗发 展的方向。随着近代分子细胞生物学的发展,人 们发现免疫系统与肿瘤的发生、发展及转归密切 相关。Schreiber等[6]提出,在肿瘤发展过程中, 存在免疫监视、免疫相持和免疫逃逸三个不同阶 段;其中免疫监视主要指免疫系统杀伤破坏肿瘤 细胞或抑制肿瘤细胞增殖的能力,而一旦肿瘤细 胞适应了生存环境,开始具有逃避免疫系统识别 和攻击能力的时候,肿瘤细胞就会大量繁殖。因 此,免疫监视的逃逸成为癌症的主要特征之一[7]。
CD4+T细胞通过不同细胞因子的释放,在肿瘤 免疫监视中起着重要调节作用。根据最新研究, CD4+T细胞分为4类:Th1、Th2、Treg及Th17。 IL-17和Foxp3作为Th17和Treg细胞的特征性因子, 在肿瘤中的作用已经成为研究热点,但IL-17在肿 瘤中的功能效应目前存在争议。本实验发现IL-17 在口腔鳞癌患者外周血及癌组织中的表达均明显高于健康者,并且随着肿瘤分期的进展,IL-17的 比例逐渐增加,提示IL-17在口腔癌的发展中起到 促进作用。实验中部分早期口腔癌患者外周血中 IL-17的表达水平低于健康者,分析其原因在于早 期患者外周血中的Th17细胞能被特异性地招募至 口腔癌组织中,Th17在CD4+细胞中的比率降低, 导致外周血中IL-17减少;而晚期癌症患者中肿瘤 血管浸润和转移现象多见,导致被招募的Th17细 胞又循环至外周血中,从而出现晚期患者外周血 中IL-17细胞比率比健康者和早期癌症患者高的现 象。这种淋巴细胞循环方式导致了不同临床分期 患者的外周血中IL-17所占比例有所不同。
为了解口腔癌患者机体免疫状态和IL-17的关 系,本实验还进行了外周血中CD3、CD4、CD8、 CD56的测定,发现随着肿瘤的进展,机体内以T 细胞为主的细胞免疫功能进行性降低,IL-17水平 逐渐增高。据此,我们推测IL-17与其他细胞因子 类似,在肿瘤中的作用具有多效性,其促进或抑 制肿瘤的作用很大程度上依赖于肿瘤免疫原性; 随着机体免疫功能愈加受到抑制,肿瘤微环境中 浸润的IL-17表面抗原发生改变,进而更多的发 挥其促瘤作用,具体机制需要进一步分子实验证 实。本实验结果提示,IL-17与口腔鳞癌的发生、 发展密切相关,其表达水平对于评估预后具有很 大的临床价值。
Foxp3作为CD4+CD25+调节性T细胞发育的 一个关键转录因子,不仅是Treg细胞(主要指 CD4+CD25+Treg)发育、分化及发挥免疫抑制功能 的关键性因素,它自身在肿瘤微环境中对肿瘤免 疫逃逸过程还起着非常重要的作用,并且这种作 用是通过非Treg依赖途径实现的[3, 8, 9, 10]。本实验研究 结果显示Foxp3在口腔鳞癌患者的外周血及癌组织 中的表达均明显高于正常组,且Foxp3的表达情况 与患者TNM分期存在相关性,提示Foxp3与口腔癌 的发生密切相关,在癌的进展过程中,Foxp3抑制 肿瘤免疫反应的作用逐渐增强,导致肿瘤细胞的 免疫逃逸,它的增殖促进了肿瘤的发展。从本实 验的结果看,无论是Foxp3本身高表达发挥作用, 参与非Treg途径抑制肿瘤免疫,还是Foxp3的表达 间接代表了Foxp3+Treg细胞浸润状态,Foxp3对于 机体免疫系统来说都是一个重要的负调节因素。 通过分子生物手段,控制肿瘤微环境中的Foxp3和 Foxp3+Treg细胞数量并调节其生物学功能,将提高 肿瘤的免疫治疗效果。
在大多数免疫相关疾病 [11, 12] 如类风湿性关节 炎(RA)、哮喘、系统性红斑狼疮(SLA)等 中,Th17与Treg起着截然不同的作用:Th17细胞 主要通过分泌IL-17来募集中性粒细胞,从而介导 促炎性反应;Treg细胞则主要在保持机体的自身耐 受性中发挥决定性的免疫抑制作用。但在口腔癌 的发生发展中,我们发现外周血及癌组织中IL-17 和Foxp3表达水平呈正相关,而并非“此消彼长”的 关系。这与Larmonier等[13]对胃癌的研究及王维维 等[14]对肝癌的研究结果一致。提示在肿瘤局部微 环境中IL-17和Foxp3可能存在相互调节作用,共同 促进肿瘤的发生、发展。
但是,IL-17和Foxp3在肿瘤微环境中是如何发 挥协同作用的?是否具有共同的分子信号转导通 路?有待于进一步研究。深入了解IL-17与Foxp3之 间协同作用的机制,将有利于口腔癌的临床早期 诊断和治疗,更好的完善临床免疫治疗方案。
| [1] | Lohr J, Knoechel B, Wang JJ, et al. Role of IL-17 and regulatoryT lymphocytes in a systemic autoimmune disease[J]. J Exp Med,2006, 203(13): 2785-91. |
| [2] | Sutton C, Brereton C, Keogh B, et al. A crucial role forinterleukin(IL)-l in the induction of IL-17-producing T cells thatmediate autoimmune encephalomyelitis[J]. J Exp Med, 2006,203(7): 1685-91. |
| [3] | Ma HB, Zhu SB, Liu RM, et al. The expression of Foxp3 in lungcancer cell and its significance[J]. Mian Yi Xue Za Zhi, 2012,28(2): 112-5.[马红冰, 朱诗白, 刘瑞敏, 等. 转录因子Foxp3在肺癌细胞的表达及其意义[J]. 免疫学杂志, 2012, 28(2): 112-5.] |
| [4] | Williams LM, Rudensky AY. Maintenance of the Foxp3-dependentdevelopmental program in mature regulatory T cells requirescontinued expression of Foxp3[J]. Nat Immunol, 2007, 8(3):277-84. |
| [5] | Wan YY, Flavell RA. Regulatory T-cell functions are subvertedand converted owing to attenuated Foxp3 expression[J]. Nature,2007, 445(7129): 766-70. |
| [6] | Schreiber RD, Old LJ, Smyth MJ. Cancer immunoediting:integrating immunity’s roles in cancer suppression andpromotion[J]. Science, 2011, 331(6024): 1565-70. |
| [7] | Mantovani A, Romero P, Palucka AK, et al. Tumour immunity:effector response to tumour and role of the microenvironment[J].Lancet, 2008, 371(9614): 771-83. |
| [8] | Hori S, Nomura T, Sakaguchi S. Control of regulatory T celldevelopment by the transcription factor Foxp3[J]. Science, 2003,299(5609): 1057-61. |
| [9] | Tian Y, Wu YZ, Ni B. Research progress in the regulation ofFoxp3 expression[J]. Mian Yi Xue Za Zhi, 2010, 26(9): 823-6. [田易, 吴玉章, 倪兵. Foxp3表达调控的研究进展[J]. 免疫学杂志,2010, 26(9): 823-6.] |
| [10] | Klages K, Mayer CT, Lahl K, et al. Selective depletion of Foxp3+regulatory T cells improves effective therapeutic vaccinationagainst established melanoma[J]. Cancer Res, 2010, 70(20):7788-99. |
| [11] | Park H, Li Z, Yang XO, et al. A distinct lineage of CD4 T cellsregulates tissue inflammation by producing interleukin17[J]. NatImmunol, 2005, 6(11): 1133-41. |
| [12] | Izcue A, Hue S, Buonocore S, et al. Interleukin-23 restrainsregulatory T cell activity to drive T cell-dependent colitis[J].Inmunity, 2008, 28(4): 559-70. |
| [13] | Larmonier N, Marron M, Zeng Y, et al. Tumor-derivedCD4+CD25+ regulatory T cell suppression of dendritic cellfunction involves TGF-beta and IL-10[J]. Cancer ImmunolImmunother, 2007, 56(1): 48-59. |
| [14] | Wang WW, Wang ZM, Liu YY, et al. Increased 1evel of Thl7cells in peripheral blood correlates with the development ofhepatocellular carcinoma[J]. Zhonghua Zhong Liu Za Zhi, 2010,32(10): 757-61. [王维维, 王振猛, 刘耀阳, 等. 肝细胞癌患者外周血Thl7细胞水平的变化及其与肿瘤进展的关系[J]. 中华肿瘤杂志, 2010, 32(10): 757-61.] |
 2015, Vol. 42
2015, Vol. 42


