文章信息
- 郑红梅, 原俊, 吴新红.2015.
- ZHENG Hongmei, YUAN Jun,WU Xinhong .2015.
- 三阴性乳腺癌的分子学分类和靶向治疗
- Molecular Stratification and Targeted Therapy for Triple-negative Breast Cancer
- 肿瘤防治研究, 2015, 42(02): 209-212
- Cancer Research on Prevention and Treatment, 2015, 42(02): 209-212
- http://www.zlfzyj.com/CN/10.3971/j.issn.1000-8578.2015.02.024
-
文章历史
- 收稿日期:2014-08-21
- 修回日期:2014-10-30
乳腺癌是全球女性高发的一种恶性肿瘤,近年发病率有明显升高趋势。乳腺癌根据免疫组织化学ER、PR、HER2和Ki67表达可分为以下4类[1]:(1)luminal A型:占60%,ER和PR(+),HER2(-),Ki67表达<14%;(2)luminal B型:占4%~19%,分为HER2阳性型(ER阳性,HER2高表达或高增殖)和HER2阴性型(ER阳性,HER2阴性,且Ki67表达>14%);(3)HER2阳性型:占7%~12%,HER2阳性,且ER、PR均为阴性;(4)基底细胞样亚型:占14%~20%,包括三阴性乳腺癌(triple negative breast cancer,TNBC),即ER(-),PR(-),HER2(-)。2013年St Gallen共识[2]进一步对乳腺癌分子分型进行了重新定义,将PR表达≥20%和多基因表达分析提示复发风险“低”作为luminal A型的筛选条件,而将PR表达<20%和多基因表达分析提示复发风险“高”作为luminal B(HER2阴性)型的筛选条件。
三阴性乳腺癌作为乳腺癌的一种特殊类型,多发生于年轻女性,肿瘤体积较大,具有较高的淋巴结转移率和较高的临床分期,5年复发率高,且以内脏转移如肝转移、肺转移多见,具有极差的预后[3]。因此,有必要对三阴性乳腺癌进行更为详细的分类,为探索有针对性的靶向治疗药物提供理论指导。本文就三阴性乳腺癌的分子学分类和靶向治疗手段作一综述。 1 三阴性乳腺癌分子学分类
目前已有的分子学分类法多是通过DNA微阵列和基因序列表达来进行的,主要有以下两种分类方法[3,4,5]。 1.1 六亚型分类法
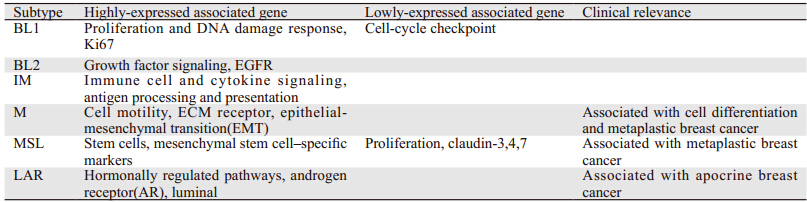
Le h ma n n等[4]通过基因集群序列表达法检测了5 8 7名三阴性乳腺癌患者体内2 1 8 8组基因序列的表达,将三阴性乳腺癌分为六种亚型:基底细胞样1型(b as al- lik e 1,BL1)、基底细胞样2型(b as al- lik e 2,BL2)、免疫调节亚型(immu n o mo d u lato r y,I M)、间质型(mes en ch y mal,M)、间质干细胞样亚型(mesenchymal stem-like,MSL)和管腔雄激素受体亚型(luminal androgen receptor,LAR)。该分类方法对各亚型的基因表达特点进行了阐述,每种亚型有各自的高表达和低表达基因谱,并对各亚型与临床的相关性进行了阐述。该分类法为探索针对三阴性乳腺癌各亚型有效的靶向治疗手段提供了理论基础。这六种亚型的基因表达特点和临床意义总结于表 1。
 |
另有学者[3,5,6]运用基因序列分类法将三阴乳腺癌分为两种亚型:(1)基底细胞样亚型:此种类型占三阴性乳腺癌的大多数,达49%,也有个别文献报道占90%以上[7]。(2)非基底细胞样亚型,较少见,包括:Claudin-low亚型(占30%);HER2-Enriched亚型(占9%);luminal A亚型(占5%);luminal B亚型(占6%);normal-like亚型(占1%)。后面三种亚型在三阴性乳腺癌中所占比例较低,且预后相对较好。 1.2.1 基底细胞样亚型
从生物学角度来说,可以认为基底细胞样乳腺癌是从乳腺上皮细胞的变异细胞衍生而来,或者是乳腺上皮细胞发生与发展的不同阶段。过去基底细胞样肿瘤的命名是因为他们表达细胞角蛋白5、6、17、14(CK5\6\17\14),而这些角蛋白主要存在于皮肤或气管的基底上皮层。目前,有关基底细胞样乳腺癌的很多分子生物学特征得到广泛研究[5],包括:(1)大多数存在P53基因突变;(2)具有较高增殖性,该增殖性在很大程度上是由于RB1蛋白功能的缺失造成的;(3)存在BRCA1 基因突变。研究发现[5],由于P53、RB基因缺失和BRCA1旁路的存在,导致了基底细胞样乳腺癌细胞的非整倍性增加,包括染色体的突变、易位和缺损等。 1.2.2 非基底细胞样亚型
(1)Claudin-low亚型Claudin-low亚型由Herschkowitz等[8]于2007年首次报道,成为乳腺癌的一种新亚型。后在三阴性乳腺癌中也发现该亚型的存在[9]。该亚型低表达Claudin基因-3、4、7。Claudin基因存在于上皮细胞紧密连接处。另外一个上皮细胞连接蛋白是E钙黏蛋白。这些低表达Claudin基因的肿瘤缺乏细胞间连接蛋白,包括E钙黏蛋白的缺乏。其与基底细胞样乳腺癌临床特征相似却又不同,存在密集的免疫细胞浸润,并且还具备肿瘤干细胞的特征和上皮间质转换的特征。它们常常是低分化的,具有较高的肿瘤分级。与其他亚型相比,只有这种亚型具备肿瘤始动细胞的特征。通过检测这种亚型的比例可以用来进一步研究肿瘤始动细胞和肿瘤干细胞[5,6]。
(2)HER2-Enriched亚型尽 管 免 疫 组 织 化 学 或 荧 光 原 位 杂 交 显 示HER2阴性,但从基因序列来看,HER2-Enriched亚型却具备HER2的基因表达标志。部分临床上HER2阳性肿瘤可以发展成HER2-Enriched亚型,有学者推测可能是在激酶作用下发生了HER2基因的突变[5]。 1.3 各种亚型之间的联系
从生物学角度推断,与乳腺癌演变类似,三阴性乳腺癌内在的亚分类可能是乳腺上皮细胞发展停留的不同阶段[5]。最原始的阶段是Claudin-low亚型,类似于乳腺癌干细胞。下一阶段是基底细胞样亚型,BRCA1基因突变与该亚型联系紧密,因此,缺乏BRCA1基因可能阻止细胞的进一步分化,从而导致肿瘤细胞停留在该亚型。再下一阶段是HER2-Enriched亚型,此型是基底细胞亚型特征的丢失和luminal亚型特征的获取。最后一个分化最好的阶段就是luminal A和luminal B亚型。 2 三阴性乳腺癌的靶向治疗
三阴性乳腺癌预后差,对内分泌治疗和曲妥珠单抗治疗不敏感,也没有特异性的针对该特殊类型的有效治疗指南。不少学者在靶向治疗方面做了大量探索,是目前研究的热点。主要的靶向治疗药物集中于以下几种类型。 2.1 聚腺苷酸二磷酸核糖转移酶[(poly(ADP-ribose)polymerase,PARP]抑制剂
PA R P抑制剂治疗三阴性乳腺癌的机制与BACA1基因突变相关。研究表明,PARP抑制剂BSI-201联合吉西他滨和卡铂化疗后,临床获益率从34%提高到56%(P=0.01),PFS从3.6月提高到5.9月(P=0.01),OS从7.7月提高到12.3月(P=0 .0 1)[1 0]。体外实验研究表明将PARP抑制剂的四种类型(AG-014699、AZD-2281、ABT-888和BSI-201)分别作用于三阴性乳腺癌的三种细胞株(MDA-MB-468、MDA-MB-231和Cal-51),均可增加三阴性乳腺癌细胞对铂类化疗药物的敏感度,且对三阴性乳腺癌细胞抑制作用的强度依次为AG-014699 > AZD-2281 > ABT-888 > BSI-201[11]。2.2 贝伐单抗(Bevacizumab)
贝伐单抗是一种人源化的VEGF单克隆抗体,用于抑制乳腺癌的新生血管而达到治疗目的。新生血管的形成在三阴性乳腺癌的发生和发展中起重要作用。一篇Meta分析表明,联合贝伐单抗新辅助化疗治疗三阴性乳腺癌后的pCR率由常规新辅助化疗的38.1%提高到45.5%(P=0.003)[12]。另一份来自德国临床试验机构关于663例三阴性乳腺癌新辅助治疗研究报告[13]也得出类似结论,即联合贝伐单抗组治疗后的pCR率由常规化疗的27.9%提高到39.3%(P=0.003)。但GBG 44-GeparQuinto试验[14]结论为:联合贝伐单抗组和常规化疗方案组新辅助治疗三阴性乳腺癌相比,两组患者DFS和OS差异无显著意义(P=0.941和0.841);英国BEA TRICE 3期研究[15]结论为:联合贝伐单抗辅助化疗组和常规辅助化疗组的DFS和OS差异无统计学意义(P=0.18和0.23)。上述研究结论说明,贝伐单抗仅能改善三阴性乳腺癌患者新辅助化疗后的pCR率,而不能明显改善新辅助化疗和辅助化后的DFS与OS。因此,贝伐单抗治疗三阴性乳腺癌的有效性尚需进一步的临床试验考证。 2.3 检验点激酶1(checkpoint kinase 1, Chk1)抑制剂
Chk1的治疗机制与TP53基因突变有关。Chk1抑制剂通过对DNA的损伤使细胞停滞在细胞周期G2期或S期。UCN-01,一种非选择性Chk1抑制剂,与伊立替康联合治疗在晚期三阴性乳腺癌患者中取得明显疗效[16]:总体缓解率(CR+PR)为4%,临床获益率(CR+PR+SD>6月)为12%。统计学数据表明,对UCN-01有效的乳腺癌类型主要为基底细胞样亚型(占69%),且大多携带TP53基因突变(占53%)。 2.4 表皮生长因子受体(epidermal growth factor receptor,EGFR)抑制剂
EGFR在三阴性乳腺癌患者高表达,且高于HER2阳性乳腺癌,但是EGFR抑制剂治疗三阴性乳腺癌的疗效却不如HER2阳性乳腺癌[17]。研究表明,吉非替尼联合卡铂、多西他赛比单独运用其中任何一种药物对三阴性乳腺癌细胞株的抑制作用都要明显,说明吉非替尼可以增加化疗药物的疗效,三者有明显的协同作用[17]。TBCRC001临床试验[18]比较西妥昔单抗单药和联合卡铂治疗三阴性乳腺癌患者的临床疗效,结果显示,西妥昔单抗/卡铂组耐受良好,但是TTP和OS均较短,分别为2.1月和10.4月。相关性分析显示,西妥昔单抗仅抑制小部分三阴性乳腺癌患者体内EGFR的作用,说明可能有除了EGFR旁路激活方式以外的作用机制存在。 2.5 达沙替尼(Dasatinib)
Dasatinib是一种口服的针对src和abl蛋白的小分子激酶抑制剂。SFKS(丝氨酸家族PTKs)在调节ER信号中扮演了一个整体的角色,并且通过促进细胞增殖、存活、侵袭和化疗抵抗来参与基底细胞样乳腺癌的发生与发展[19,20]。Finn等[21]选取了39种人类乳腺癌细胞株,将它们分为luminal亚型和基底细胞样亚型,各自的标志物为CK8/18和CK5/17。加入1 μm Dasatinib,结果显示,8种是高度敏感的(大于60%的生长抑制),10种是中度敏感的(40%~59%的生长抑制),21种是耐药的。经过卡方检验统计学分析,基底细胞样乳腺癌敏感。该实验数据为临床上使用Dasatinib治疗基底细胞样三阴性乳腺癌提供了有力的科学依据。2.6 褪黑激素和褪黑激素受体激动剂
动物和人类乳腺癌细胞的体外和体内试验证明,松果体的褪黑激素可以抵抗肿瘤的发生和进展。这种作用主要是通过褪黑激素受体1a(MT1)实现的。国外学者[22]收集167例三阴性乳腺癌患者,检测其体内MT1受体的表达。在欧美人和高加索人种中,存在显著的MT1阳性发病率差异和染色体浓度差异。欧美人显示出较高的MT1阴性肿瘤发病率和较低的平均体重指数(WI)。在三阴性乳腺癌中,MT1阳性与肿瘤早期和较小的肿瘤直径相关。在多变量因素分析中,MT1阴性三阴性乳腺癌显示出较高的疾病进展风险比率,较短的无进展生存期,较多的疾病相关性死亡和较短的总生存期,与种族无关联性。在欧美组中尤其显著,但在高加索人种中却没有差异。这些结果表明,褪黑激素或褪黑激素受体激动剂可能是三阴性乳腺癌有效的生物治疗药物,尤其是病程具有高度侵袭性的欧美人群。 3 总结
综上所述,三阴性乳腺癌的分子学分类有助于更进一步了解该类型肿瘤的异质性,为临床上合理使用更有效的靶向治疗药物提供有力的理论依据。三阴性乳腺癌生物靶向治疗研究正在广泛开展,关于PARP抑制剂治疗BRCA突变型三阴性乳腺癌的研究已经取得了令人振奋的结果,但贝伐单抗和EGFR抑制剂治疗三阴性乳腺癌的疗效尚存在争议,且大多限于体外实验和初期临床试验阶段,尚需要更多的数据来证实。
| [1] | Reddy KB. Triple-negative breast cancers: an updated review ontreatment options[J]. Curr Oncol, 2011, 18(4): e173-9. |
| [2] | Goldhirsch A, Winer EP, Coates AS, et al. Personalizing thetreatment of women with early breast cancer: highlights of the StGallen International Expert Consensus on the Primary Therapy ofEarly Breast Cancer 2013[J]. Ann Oncol, 2013, 24(9): 2206-23. |
| [3] | Prat A, Adamo B, Cheang MC, et al. Molecular characterizationof basal-like and non-basal-like triple-negative breast cancer[J].Oncologist, 2013, 18(2): 123-33. |
| [4] | Lehmann BD, Bauer JA, Chen X, et al. Identification of humantriple-negative breast cancer subtypes and preclinical models forselection of targeted therapies[J]. J Clin Invest, 2011, 121(7):2750-67. |
| [5] | Perou CM. Molecular stratification of triple-negative breastcancers[J]. Oncologist, 2011, 16 Suppl 1: 61-70. |
| [6] | Prat A, Perou CM. Deconstructing the molecular portraits ofbreast cancer[J]. Mol Oncol, 2011, 5(1): 5-23. |
| [7] | Rakha EA, Tan DS, Foulkes WD, et al. Are triple-negativetumours and basal-like breast cancer synonymous?[J]. BreastCancer Res, 2007, 9(6): 404. |
| [8] | Herschkowitz JI, Simin K, Weigman VJ, et al. Identification ofconserved gene expression features between murine mammarycarcinoma models and human breast tumors[J]. Genome Biol,2007, 8(5): R76. |
| [9] | Prat A, Parker JS, Karginova O, et al. Phenotypic and molecularcharacterization of the claudin-low intrinsic subtype of breastcancer[J]. Breast Cancer Res, 2010, 12(5): R68. |
| [10] | O’Shaughnessy J, Osborne C, Pippen JE, et al. Iniparib pluschemotherapy in metastatic triple-negative breast cancer[J]. NEngl J Med, 2011, 364(3): 205-14. |
| [11] | Chuang HC, Kapuriya N, Kulp SK, et al. Differential antiproliferative activities of poly(ADP-ribose) polymerase (PARP)inhibitors in triple-negative breast cancer cells[J]. Breast CancerRes Treat, 2012, 134(2): 649-59. |
| [12] | Chen XS, Yuan Y, Garfield DH, et al. Both Carboplatin andbevacizumab improve pathological complete remission rate inneoadjuvant treatment of triple negative breast cancer: a metaanalysis[J]. PLoS One, 2014, 9(9): e108405. |
| [13] | von Minckwitz G, Eidtmann H, Rezai M, et al. Neoadjuvantchemotherapy and bevacizumab for HER2-negative breastcancer[J]. N Engl J Med, 2012, 366(4): 299-309. |
| [14] | von Minckwitz G, Loibl S, Untch M, et al. Survival afterneoadjuvant chemotherapy with or without bevacizumab oreverolimus for HER2-negative primary breast cancer (GBG44-GeparQuinto) [J]. Ann Oncol, 2014, 25(12): 2363-72. |
| [15] | Cameron D, Brown J, Dent R, et al. Adjuvant bevacizumabcontaining therapy in triple-negative breast cancer (BEATRICE):primary results of a randomised, phase 3 trial[J]. Lancet Oncol,2013, 14(10): 933-42. |
| [16] | Ma CX, Ellis MJ, Petroni GR, et al. A phase Ⅱ study of UCN-01in combination with irinotecan in patients with metastatic triplenegative breast cancer[J]. Breast Cancer Res Treat, 2013, 137(2):483-92. |
| [17] | Corkery B, Crown J, Clynes M, et al. Epidermal growth factorreceptor as a potential therapeutic target in triple-negative breastcancer[J]. Ann Oncol, 2009, 20(5): 862-7. |
| [18] | Carey LA, Rugo HS, Marcom PK, et al. TBCRC 001: randomizedphase Ⅱ study of cetuximab in combination with carboplatinin stage Ⅳ triple-negative breast cancer[J]. J Clin Oncol, 2012,30(21): 2615-23. |
| [19] | Hochgr?fe F, Zhang L, O'Toole SA, et al. Tyrosine phosphorylationprofiling reveals the signaling network characteristics of Basalbreast cancer cells[J]. Cancer Res, 2010, 70(22): 9391-401. |
| [20] | Kim EM, Mueller K, Gartner E, et al. Dasatinib is synergistic withcetuximab and cisplatin in triple-negative breast cancer cells[J]. JSurg Res, 2013, 185(1): 231-9. |
| [21] | Finn RS, Dering J, Ginther C, et al. Dasatinib, an orally activesmall molecule inhibitor of both the src and abl kinases,selectively inhibits growth of basal-type/"triple-negative" breastcancer cell lines growing in vitro[J]. Breast Cancer Res Treat,2007, 105(3): 319-26. |
| [22] | Oprea-Ilies G, Haus E, Sackett-Lundeen L, et al. Expression ofmelatonin receptors in triple negative breast cancer (TNBC) inAfrican American and Caucasian women: relation to survival[J].Breast Cancer Res Treat, 2013, 137(3): 677-87. |
 2014, Vol. 42
2014, Vol. 42


