文章信息
- 张聪,戴天阳.2015.
- ZHANG Cong, DAI Tianyang .2015.
- 食管鳞状细胞癌中miRNAs的研究进展
- Progress on miRNAs in Esophageal Squamous Cell Carcinoma
- 肿瘤防治研究, 2015, 42(02): 204-208
- Cancer Research on Prevention and Treatment, 2015, 42(02): 204-208
- http://www.zlfzyj.com/CN/10.3971/j.issn.1000-8578.2015.02.023
-
文章历史
- 收稿日期:2014-07-25
- 修回日期:2014-09-24
2.646000 泸州,泸州医学院附属医院胸心外科
2. Department of Cardiothoracic Surgery , Affiliated Hospital of Luzhou Medical College, Luzhou 646000, China
miRNAs调控着人类约1/3的基因表达,在许多疾病的发病机制中起着重要作用。越来越多的研究表明,miRNAs对食管鳞癌(esophagealsquamouscellcarcinoma,ESCC)的发生发展有着重要作用。本文将从miRNAs及其功能、ESCC中的miRNAs及其靶基因、miRNAs在ESCC诊治中的作用三个方面的研究进展作一综述。 1 miRNAs及其功能
microRNAs(miRNAs)是一个长度为19~24个核苷酸的非编码单链小RNA。miRNAs的主要功能是通过干扰mRNA的翻译,负调控其靶基因,影响靶基因的蛋白表达。miRNAs的作用机制有两种:(1)miRNAs与靶mRNA的3’UTR完全配对或近似完全配对,使靶基因互补区特异性断裂,引起基因沉默;(2)miRNAs与靶mRNA的3’UTR不完全配对,在转录后水平抑制功能蛋白的合成。
miRNAs在肿瘤中的作用是近年来研究的一个热点,miRNAs表达谱与肿瘤的发病、分类、进展、预后等密切相关。目前,许多基因已被确定与肿瘤相关,miRNAs根据其功能分为致癌miRNAs和抑癌miRNAs。在正常细胞中,抑癌miRNAs高度表达使致癌蛋白表达下调。而在肿瘤细胞中,抑癌miRNAs沉默导致致癌蛋白表达上调,与此同时,致癌miRNAs在肿瘤细胞中的表达使抑癌蛋白的表达下调。超过一半的miRNAs基因位于与肿瘤发生相关的区域或脆性位点。在肿瘤中过度表达的miRNAs,如miR-21、miR-17~92家族,作为致癌基因通过下调抑癌基因促进肿瘤进展,同时抑癌基因let-7、miR-34家族表达下降[1]。致癌miRNAs和抑癌miRNAs都参与细胞分化、增殖、凋亡和代谢等,有望成为肿瘤起源和类型识别的高度组织特异性标志物,具有潜在的临床应用价值。 2 食管鳞癌中的miRNAs及其靶基因 2.1 miRNAs在ESCC中的表达
随着研究的深入,与ESCC相关的miRNAs也有了新的研究进展。近年来许多研究报道了miRNAs在ESCC中表达,上调的miRNAs比下调的多,即致癌miRNAs多于抑癌miRNAs。Zhang等[2]利用Solexa测序技术发现,与对照组相比,ESCC患者的血清中有25个miRNAs高表达,利用实时荧光定量PCR(Real-timePCR,RT-PCR)测出血清中7个miRNAs(miR-10a,miR-22,miR-100,miR-148b,miR-223,miR-133a,miR-127-3p)对诊断ESCC有约70%的敏感度和100%的特异性。Chen等[3]研究发现,miR-34a、miR-34b/c、miR-129-2的CpG岛甲基化是常见的,是一个重要的致病机制,在ESCC患者中miR- 34a、miR- 34b/c及miR-129-2甲基化水平分别是67%、41%和96%。miR-129-2的甲基化水平显著高于非肿瘤组织,miR-129-2的高度甲基化率可能成为ESCC早期诊断的一个潜在的甲基化标志物。 2.2 ESCC中miRNAs的靶基因
越来越多的研究集中在miRNAs的靶基因,意在阐明其在ES CC发生发展中的致癌作用。miRNAs的靶基因是抑癌基因或致癌基因,如生长因子、生长因子受体、信号转导转录因子、人程序性细胞死亡因子(humanprogrammedcelldeath,PDCD)的调控者、控制细胞分裂的基因和DNA修复基因,致癌miRNAs可能是通过下调抑癌基因起作用[4]。
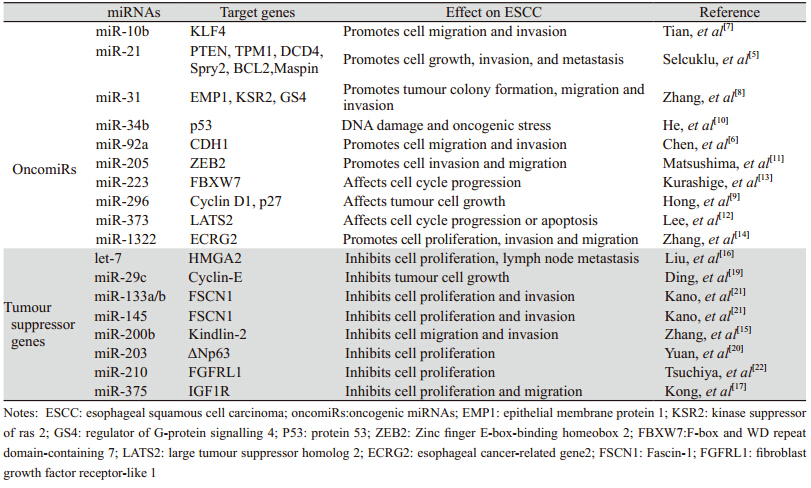
文献报道了一些致癌miRNAs通过调控其靶基因在ESCC的发生、侵袭和转移中扮演着重要的角色,见表 1。许多研究表明miR- 21的靶基因包括PTEN(phosphataseandtensinhomolog),肿瘤抑制基因原肌球蛋白1(tumoursuppressorgenetropomyosin1,TPM1)、PDCD4(programmedcelldeath4),Sprouty2(Spry2),BCL2(B-cellCLL/lymphoma2),肿瘤抑制基因蛋白(Maspin),从而证明miR-21参与肿瘤的生长、侵袭和转移[5]。Ch en等[6]指出miR- 9 2 a可通过抑制E-钙黏蛋白(E-cadherin)基因的表达来促进ESCC细胞的迁移和侵袭,miR-92a的上调与淋巴结转移、远处转移和TNM分期密切相关。Tian等[7]指出,Kruppel样因子4(Krüppel-likefactor4,KLF4)的锌指蛋白在调控细胞周期、细胞分化和提高DNA损伤反应中发挥重要作用,miR-10b通过调控KLF4促进ESCC细胞迁移和侵袭。另外,一些miRNAs如miR-34b、miR-205等已被证实在ESCC中表达上调,并通过调节其对应的靶基因促进ESCC发生、发展、转移等[8,9,10,11,12,13,14]。
同样,肿瘤细胞中的抑癌miRNAs将会使抑癌基因上调,导致致癌基因下调,抑制肿瘤生长,见表 1。Zhang等[15]研究发现,ESCC肿瘤的miR-200b表达水平显著降低,miR-200b的下调与ESCC患者生存期缩短、淋巴结转移、分期晚密切相关,其肿瘤抑制效应可能是抑制黏着斑蛋白Kindlin-2,从而调节ESCC的肌动蛋白细胞骨架、黏着斑(FA)形成、侵袭性和转移性。Liu等[16]证明抑癌基因Let-7在ESCC中表达可抑制细胞增殖,另外,ESCC患者的淋巴结转移与Let-7低表达致高迁移率族蛋白A2(highmobilitygroupAT-hook2,HMGA2)过度表达相关。Kong等[17]报道miR-375可通过抑制下游促癌基因胰岛素样生长因子1受体(Isulin-likegrowthfactor1receptor,IGF1R)而抑制ESCC生长,但miR-375编码基因启动子的高度甲基化引起miR-375下调,从而不能抑制IGF1R的表达,促进了ESCC的进展。然而一项针对IGF1R的单克隆抗体治疗ESCC的Ⅱ期临床试验结果并不理想[18],需要更多的研究来验证其调控机制和治疗作用。除此之外,文献还报道了miR-29c、miR-133a/b等通过影响其靶基因的功能进而抑制ESCC的进展、侵袭及转移[19,20,21,22]。3 miRNAs在食管鳞癌诊治中的作用 3.1 ESCC的miRNAs与病理分级、分化
Guo等[4]第一次用miRNAs微阵列技术报道了ESCC中miRNAs的表达,与正常鳞状上皮组织相比,3个miRNAs(miR-25,miR-424,miR-151)上调,4个miRNAs(miR-100,miR-99a,miR-29c,mmu-miR-140*)下调,另外,5个miRNAs(miR-335,miR-181d,miR-25,miR-7,miR-495)与病理分级相关(蕈伞型和髓样型),2个miRNAs(miR-25,miR-130b)与病理分化程度相关。 3.2 循环中的miRNAs
在血清和血浆中相对容易获取循环标志物,是诊断肿瘤最有前途的方法之一。许多研究表明,ESCC患者血清中一些miRNAs的表达存在明显差异,这些miRNAs具有稳定性和特异性,有望成为诊断ESCC的新型生物标志物。Zhang等[8]报道ESCC组织和血清中miR-31均上调,血清中高表达miR-31的患者预后差、肿瘤易复发、肿瘤相关的死亡风险更高。Kurashige等[23]指出ESCC患者血清中miR-21的表达明显高于对照组,血清中的miR-21可作为ESCC的一个生物标志物。Komatsu等[24]也分析了ESCC患者和对照组循环中miR-21、miR-184、miR-375的表达水平,研究结果提示ESCC患者循环中miR-21明显高于对照组(P=0.0649),而miR-375则明显降低(P<0.0001),虽然这些结果表明在不同组织中miR-21的表达有很大差异,血清miR-21是潜在的诊断ESCC的特异性生物标志物,但由于目前研究有限,还需更多的研究来证实其在ESCC诊断中的作用。3.3 miRNAs与食管鳞癌的诊断
为了使miRN A s成为诊断食管癌的一种工具,必须了解正常组织、癌前病变和肿瘤组织中miRNAs的表达情况,以及这些组织中特异的miRNAs显著上调或下调的情况,用微阵列或测序技术可以对miRNAs全基因组进行检测,也可以定量检测,如定量检测感兴趣的已知的miRNAs的表达情况。Kano等[21]分析了10对标本发现15个miRNAs在ESCC组织中的表达高于癌旁正常组织。Ogawa等[25]分析了30对配对标本(ESCC组织和正常组织)发现ESCC组织中有22个miRNAs上调2倍(其中有6个miRNAs上调了4倍),有4个miRNAs下调了2倍。Zhu等[26]获得5例ESCC患者的正常基底组织、分化组织及肿瘤组织,发现ESCC组织中的miR-21,miR-25,miR-10b上调。全基因组评估可以根据不同miRNAs的表达情况来区分组织和疾病类型。另一项研究分析了35个样本[10个食管腺癌(esophagealadenocarcinoma,EAC)、10个ESCC、5个巴雷特食管癌(Barrett,sesophaguscancer,BE)、1个重度不典型增生(chighgradedysplasia,HGD)、9个正常食管黏膜(normalesophagealmucosa,NE)],Feber等[27]发现无监督层次聚类可将其分成4个分支,对应4个组织群,这利于我们区分肿瘤组织、正常组织及不同的病理类型。研究还提示与NE相比,ESCC中miR-203、miR-205表达低2~10倍,miR-21高3~5倍。ESCC的miRNAs表达谱与正常组织不同,可作为生物标志物,有利于ESCC的早期诊断。 3.4 miRNAs与ESCC的进展
近年来许多研究表明,一些miRNAs参与ESCC的侵袭、转移、复发等。Ma等[28]报道高表达miR-21的ESCC患者肿瘤易侵入食管壁,另外,肿瘤组织的miR-21靶基因PTEN明显降低。Akagi等[29]报道ESCC淋巴结转移患者miR-21和miR-205高表达,术后复发患者组织中miR-143,miR-145,miR-205表达水平高。Komatsu等[24]研究发现血浆miR-21水平增高患者更易发生血管侵袭,且与肿瘤复发密切相关,同时也发现术后患者血浆中的miR-21水平明显降低。Xu等[30]分析了60例ESCC组织与癌旁正常组织miR-25的表达水平,发现ESCC中miR-25明显升高,且通过抑制抑癌基因E-钙黏蛋白(CDH1)促进ESCC的浸润、远处转移。综上所述,以miRNAs作为治疗靶点,将有助于延缓ESCC患者的病情进展,改善预后。 3.5 miRNAs与ESCC治疗的反应和敏感度
化疗是治疗E S C C的重要策略之一,化疗耐药是导致化疗失败的重要原因。一些学者对miRNAs的表达能否预测治疗反应进行了研究,指出miRNAs的表达可能与化疗耐药、化疗敏感度密切相关。Kurashige等[23]指出术后患者血清miR-21水平明显低于术前患者,且miR-21表达低的ESCC患者对化疗敏感度较好。ESCC患者miR-27a的表达下降可以使肿瘤细胞对长春新碱、阿霉素、顺铂和氟尿嘧啶的化疗敏感度提高[31]。然而,也有报道miR-27a的下调与化疗耐药相关[32]。ESCC患者治疗前活检中Let-7b、Let-7c的低表达与化疗疗效差相关,Let-7c的低表达与预后差相关,而转染Let-7c的细胞恢复了对铂类化疗药物的敏感度[33]。因此,miRNAs可能成为治疗反应标志物,是潜在的药物作用靶点,有望逆转化疗耐药,提高治疗的反应和敏感度。3.6 miRNAs与ESCC的预后
肿瘤预后标志物可有效地预测患者治疗效果、生存情况,ESCC患者预后差,目前缺乏特异的敏感的预后标志物。近年研究发现,特定miRNAs表达谱有望成为预后生物标志物。Ogawa等[25]研究显示ESCC患者高表达的6个miRNAs与生存率差相关,miR-129的过度表达所致的早期死亡率是低表达的18.11倍,miR-129被认为是手术后ESCC患者重要的独立预后因素。Kurashige等[13]报道miR-223高表达ESCC患者的预后明显低于miR-223低表达患者。但Li等[34]研究显示ESCC的miR-223的高表达降低了细胞的迁移性和侵袭性,他们还发现在ESCC中miR-223的靶基因是ARTN(arreman),ARTN是一个已知的肿瘤转移相关基因。Kong等[17]报道ESCC中miR-375的低表达与病情进展、远处转移、短的总生存率和无病生存率密切相关。Li等[35]也指出,用miRNAs原位杂交技术(MISH)分析发现,miR-375的低表达与ESCC患者预后差相关。因此,miRNAs表达谱有可能成为ESCC患者一种新的、有效的预后标志物。 4 问题与展望
虽然关于ESCC中的miRNAs的研究已有一些进展,但还面临着许多问题与挑战。在单一肿瘤样本中,ESCC相关miRNAs的表达存在显著差异,即肿瘤内异质性。基于肿瘤内异质性有学者指出,在肿瘤不同部位、相关淋巴结进行取样有利于miRNAs对肿瘤进行诊断或判断预后。已有报道称,血清或血浆中miRNAs作为潜在的诊断ESCC或判断其预后的生物标志物,但红细胞含有miRNAs,在血液采集过程中溶血是难以避免的,血细胞来源的miRNAs的高表达可能会掩盖肿瘤细胞或相关基质细胞分泌的miRNAs。miRNAs具有不稳定性、有负电荷,而这些特点对其在基因沉默中的应用提出了挑战,尤其是对靶组织的传递效应。miRNAs在治疗方面也面临一些潜在挑战,包括缺乏组织特异性、摄取差以及全身不良反应风险等。随着研究的深入,相信这些困难将会得到克服,有利于推进miRNAs应用于临床。
miRNAs作为一种新型的肿瘤标志物,是目前的一个研究热点,已初步了解了miRNAs的基本结构及其生物学功能。许多研究致力于ESCC组织中miRNAs的表达谱,miRNAs在ESCC的发生、发展、侵袭、转移及复发的过程中起着重要作用,但其作用机制还没有完全阐明。miRNA对ESCC的预测、诊断、治疗和预后等有潜在的巨大的应用价值。随着研究的进展,将会更好地认识miRNAs及其靶基因,阐明其作用机制,miRNAs作为ESCC治疗的一个新靶点,将为ESCC患者带来新的治疗策略与希望。
| [1] | Garzon R, Calin GA, Croce CM. microRNAs in cancer[J]. Annu Rev Med, 2009, 60: 167-79. |
| [2] | Zhang C, Wang C, Chen X, et al. Expression profile of microRNAs in serum: a fingerprint for esophageal squamous cell carcinoma[J]. Clin Chem, 2010, 56(12): 1871-9. |
| [3] | Chen X, Hu H, Guan X, et al. CpG island methylation status of miRNAs in esophageal squamous cell carcinoma[J]. Int J Cancer, 2012, 130(7): 1607-13. |
| [4] | Guo Y, Chen Z, Zhang L, et al. Distinctive microRNA profiles relating to patient survival in esophageal squamous cell carcinoma[J]. Cancer Res, 2008, 68(1): 26-33. |
| [5] | Selcuklu SD, Donoghue MT, Spillane C. miR-21 as a key regulator of oncogenic processes[J]. Biochem Soc Trans, 2009, 37(Pt 4): 918-25. |
| [6] | Chen ZL, Zhao XH, Wang JW, et al. microRNA-92a promotes lymph node metastasis of human esophageal squamous cell carcinoma via E-cadherin[J]. J Biol Chem, 2011, 286(12): 10725-34. |
| [7] | Tian Y, Luo A, Cai Y, et al. microRNA-10b promotes migration and invasion through KLF4 in human esophageal cancer cell lines[J]. J Biol Chem, 2010, 285(11): 7986-94. |
| [8] | Zhang T, Wang Q, Zhao D, et al. The oncogenetic role of microRNA-31 as a potential biomarker in oesophageal squamous cell carcinoma[J]. Clin Sci (Lond), 2011, 121(10): 437-47. |
| [9] | Ho n g L, Ha n Y, Zh a n g H, e t a l. Th e p r o g n o s tic a n d chemotherapeutic value of miR-296 in esophageal squamous cell carcinoma[J]. Ann Surg, 2010, 251(6): 1056-63. |
| [10] | He L, He X, Lim LP, et al. A microRNA component of the p53 tumour suppressor network[J]. Nature, 2007, 447(7148): 1130-4. |
| [11] | Matsushima K, Isomoto H, Yamaguchi N, et al. miRNA-205 modulates cellular invasion and migration via regulating zinc finger E-box binding homeobox 2 expression in esophageal squamous cell carcinoma cells[J]. J Transl Med, 2011, 9: 30. |
| [12] | Lee KH, Goan YG, Hsiao M, et al. microRNA-373 (miR-373) post-transcriptionally regulates large tumor suppressor, homolog 2(LATS2) and stimulates proliferation in human esophageal cancer[J]. Exp Cell Res, 2009, 315(15): 2529-38. |
| [13] | Kurashige J, Watanabe M, Iwatsuki M, et al. Overexpression of microRNA-223 regulates the ubiquitin ligase FBXW7 in oesophageal squamous cell carcinoma[J]. Br J Cancer, 2012, 106(1): 182-8. |
| [14] | Zhang T, Zhao D, Wang Q, et al. microRNA-1322 regulates ECRG2 allele specifically and acts as a potential biomarker in patients with esophageal squamous cell carcinoma[J]. Mol Carcinog, 2012, 52(8): 581-90. |
| [15] | Zhang HF, Zhang K, Liao LD, et al. miR-200b suppresses invasiveness and modulates the cytoskeletal and adhesive machinery in esophageal squamous cell carcinoma cells via targeting Kindlin-2[J]. Carcinogenesis, 2014, 35(2): 292-301. |
| [16] | Liu Q, Lv GD, Qin X, et al. Role of microRNA let-7 and effect to HMGA2 in esophageal squamous cell carcinoma[J]. Mol Biol Rep, 2012, 39(2):1239-46. |
| [17] | Kong KL, Kwong DL, Chan TH, et al. microRNA-375 inhibits tumour growth and metastasis in oesophageal squamous cell carcinoma through repressing insulin-like growth factor 1 receptor[J]. Gut, 2012, 61(1): 33-42. |
| [18] | Pollak M. The insulin and insulin-like growth factor receptor family in neoplasia: an update[J]. Nat Rev Cancer, 2012, 12(3): 159-69. |
| [19] | Ding DP, Chen ZL, Zhao XH, et al. miR-29c induces cell cycle arrest in esophageal squamous cell carcinoma by modulating cyclin E expression[J]. Carcinogenesis, 2011, 32(7): 1025-32. |
| [20] | Yuan Y, Zeng ZY, Liu XH, et al. microRNA-203 inhibits cell proliferation by repressing DeltaNp63 expression in human esophageal squamous cell carcinoma[J]. BMC Cancer, 2011, 11: 57. |
| [21] | Kano M, Seki N, Kikkawa N, et al. miR-145, miR-133a and miR-133b: Tumor-suppressive miRNAs target FSCN1 in esophageal squamous cell carcinoma[J]. Int J Cancer, 2010, 127(12): 2804-14. |
| [22] | Tsuchiya S, Fujiwara T, Sato F, et al. microRNA-210 regulates cancer cell proliferation through targeting fibroblast growth factor receptor-like 1(FGFRL1)[J]. J Biol Chem, 2011, 286(1): 420-8. |
| [23] | Kurashige J, Kamohara H, Watanabe M, et al. Serum microRNA-21 is a novel biomarker in patients with esophageal squamous cell carcinoma[J]. J Surg Oncol, 2012, 106(2): 188-92. |
| [24] | Komatsu S, Ichikawa D, Takeshita H, et al. Circulating microRNAs in plasma of patients with oesophageal squamous cell carcinoma[J]. Br J Cancer, 2011, 105 (1): 104-11. |
| [25] | Ogawa R, Ishiguro H, Kuwabara Y, et al. Expression profiling of micro-RNAs in human esophageal squamous cell carcinoma using RT-PCR[J]. Med Mol Morphol, 2009, 42(2): 102-9. |
| [26] | Zhu L, Yan W, Rodriguez-Canales J, et al. microRNA analysis of microdissected normal squamous esophageal epithelium and tumor cells[J]. Am J Cancer Res, 2011, 1(5): 574-84. |
| [27] | Feber A, Xi L, Luketich JD, et al. MicroRNA expression profiles of esophageal cancer[J]. J Thorac Cardiovasc Surg, 2008, 135 (2): 255-60. |
| [28] | Ma WJ, Lv GD, Tuersun A, et al. Role of microRNA-21 and effect on PTEN in Kazakh’s esophageal squamous cell carcinoma[J]. Mol Biol Rep, 2011, 38(5): 3253-60. |
| [29] | Akagi I, Miyashita M, Ishibashi O, et al. Relationship between altered expression levels of MIR21, MIR143, MIR145, and MIR205 and clinicopathologic features of esophageal squamous cell carcinoma[J]. Dis Esophagus, 2011, 24(7): 523-30. |
| [30] | Xu X, Chen Z, Zhao X, et al. microRNA-25 promotes cell migration and invasion in esophageal squamous cell carcinoma[J]. Biochem Biophys Res Commun, 2012, 421(4): 640-5. |
| [31] | Zhang H, Li M, Han Y, et al. Down-regulation of miR-27a might reverse multidrug resistance of esophageal squamous cell carcinoma[J]. Dig Dis Sci, 2010, 55(9): 2545-51. |
| [32] | Feng DD, Zhang H, Zhang P, et al. Down-regulated miR-331-5p and miR-27a are associated with chemotherapy resistance and relapse in leukaemia[J]. J Cell Mol Med, 2011, 15(10): 2164-75. |
| [33] | Sugimura K, Miyata H, Tanaka K, et al. Let-7 expression is a significant determinant of response to chemotherapy through the regulation of IL-6/STAT3 pathway in esophageal squamous cell carcinoma[J]. Clin Cancer Res, 2012, 18(18): 5144-53. |
| [34] | Li S, Li Z, Guo F, et al. miR-223 regulates migration and invasion by targeting Artemin in human esophageal carcinoma[J]. J Biomed Sci, 2011, 18: 24. |
| [35] | Li J, Li X, Li Y, et al. Cell-specific detection of miR-375 downregulation for predicting the prognosis of esophageal squamous cell carcinoma by miRNA in situ hybridization[J]. PLoS One, 2013, 8(1): e53582. |
 2014, Vol. 42
2014, Vol. 42