文章信息
- 李泽朝,周勇,罗诗樵. 2015.
- LI Zechao, ZHOU Yong, LUO Shiqiao. 2015.
- 胰腺癌肝转移患者多学科综合治疗临床分析
- Clinical Analysis of Multimodality Treatments for Pancreatic Cancer Patients with Liver Metastases
- 肿瘤防治研究, 2015, 42(02): 154-158
- Cancer Research on Prevention and Treatment, 2015, 42(02): 154-158
- http://www.zlfzyj.com/CN/10.3971/j.issn.1000-8578.2015.02.012
-
文章历史
- 收稿日期:2014-05-13
- 修回日期:2014-06-23
胰腺癌是高度恶性消化道肿瘤之一,近年来发病率呈明显上升趋势,其预后极差,据研究报道[1, 2],80%的胰腺癌患者明确诊断时已是中晚期,其中约50%已发生远处转移,而肝转移最为常见,胰腺癌总的中位生存期(MST)为6~8月,伴远处转移者,生存期更短,治疗手段有限。本研究总结分析了我院收治胰腺癌肝转移患者的临床资料,探讨其临床特征及不同治疗方式与预后的关系,以指导临床治疗。
1 资料与方法1.1 基本资料2009年1月—2012年1月,重庆医科大学附属第一医院共收治经病理或影像学诊断胰腺癌肝转移者80例,排除资料不完整的16例,纳入研究64例。57例(89%)入院首诊同时发现胰腺癌伴肝转移,7例(11%)先诊断胰腺癌,随后病程中发现肝转移。
1.2 治疗方式及随访采用手术、全身化疗、介入化疗栓塞/介入化疗(TACE/TAE)和高强度聚焦超声(HIFU)、肿瘤无水酒精注射及对症支持治疗。16例仅予以保肝、止痛对症支持治疗;19例接受手术治疗,其中,7例仅行胆肠吻合术,7例行胰腺原发病灶及肝转移灶同期切除术,5例予以单纯肝转移病灶切除;全身静脉化疗共11例,其中,单用吉西他滨化疗5例,吉西他滨+奥沙利铂方案3例,吉西他滨+顺铂1例,奥沙利铂+亚叶酸钙+替加氟1例,腹腔内注射氟尿嘧啶1例;9例患者接受HIFU治疗;15例予以经股动脉穿刺介入化疗栓塞或介入化疗。除对症支持治疗外,6例接受2种以上的多学科联合治疗。随访患者6月、1年及2年生存情况,随访截止日期2014年2月。
1.3 统计学方法采用SPSS19.0软件统计分析,终止事件为从确诊肝转移到死亡或目前随访日期。用Kaplan-Meier法计算生存期,Log rank法进行组间差异比较,并对影响生存的变量用Cox回归模型行多因素分析,P<0.05有统计学意义。
2 结果2.1 临床特点中晚期胰腺癌常表现为明显的体重减轻、食欲下降、乏力及腹痛等,影像学常能发现胰腺肿瘤及转移病灶,生化检测常见CA19-9、GGT等异常升高。本研究64例患者中,89%胰、肝同时发现肿瘤,均为肝内多发转移,40.6%合并肝外转移,其中最常见转移部位为:腹腔淋巴结(14例)、肺(8例)、腹膜(7例)、肾上腺(5例),其他如骨、肾脏等也可见转移。年龄介于39~82岁,中位年龄60岁。胰腺肿瘤位于胰头/颈部占64%(41/64)。肿瘤标志物中以CA19-9变化最明显,64例中有56例CA19-9异常升高,其中28例>1 000u/ml。另外GGT升高也十分显著。胰腺癌肝转移最常见临床表现依次为:腹痛89.0%(57/64)、食欲下降64.0%(41/64)、消瘦37.5%(24/64)、腹胀35.9%(23/64)、黄疸20.3%(13/64)、恶心呕吐14%(9/64)、腹部包块7.8%(5/64)。
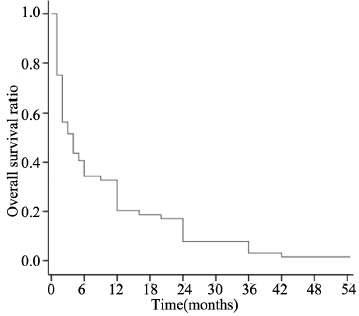
2.2 生存情况分析到2014年2月随访截止,该64例患者总的MST为6月。6月、1年及2年生存率分别为39.1%、21.9%和7.8%。4例仍存活,其中1例生存时间超过5年,总的生存曲线见图 1。
|
| 图 1 全组64例胰腺癌肝转移病例总的生存曲线 Figure 1 Overall survival curve of 64 pancreatic cancer patients with liver metastasis |
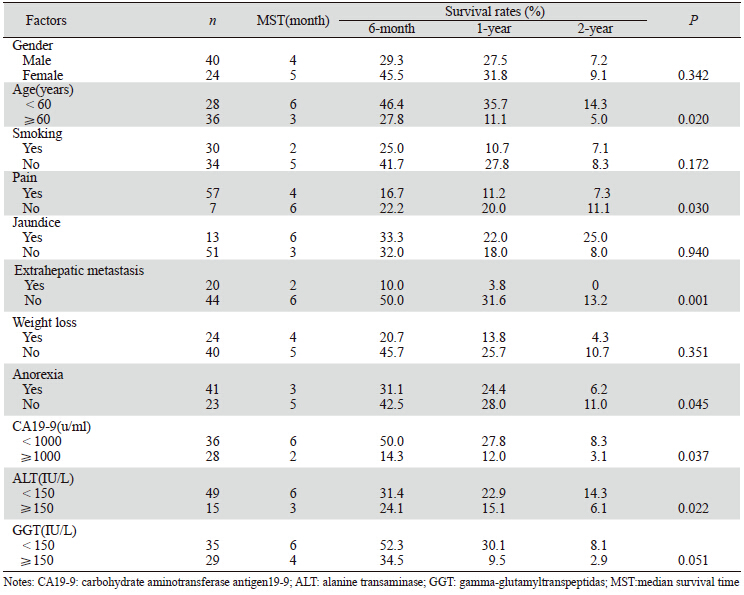
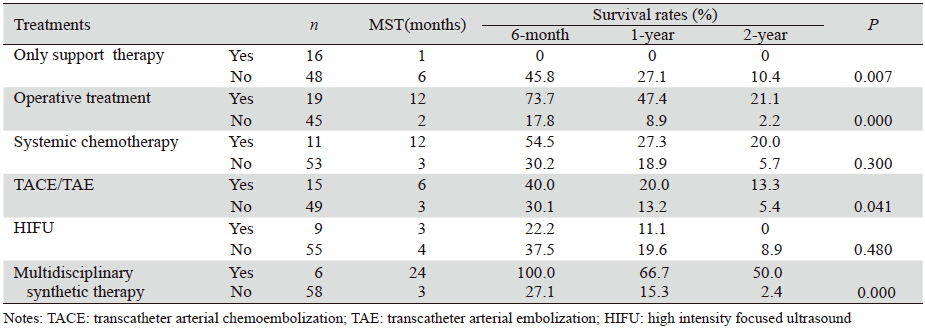
采用Kaplan-Meier及Log rank法分别对患者的临床特征及治疗方式进行单因素分析,结果显示:年龄大、疼痛、肝外转移、厌食、CA19-9及ALT水平较高与患者预后较差相关(P<0.05),其中,是否伴肝外转移差异有统计学意义,见表 1。手术、TACE/TAE、多学科综合治疗等积极治疗方式可明显延长生存期,见表 2(P<0.05)。
 |
 |
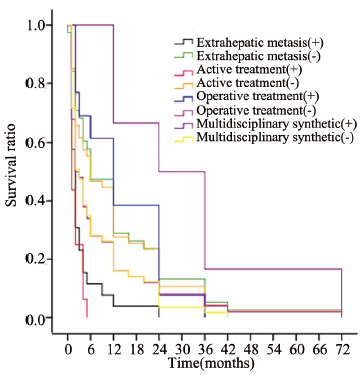
采用COX比例风险模型行多因素分析后得出:肝外转移、疼痛、CA19-9、积极治疗以及手术、TACE/TAE、多学科综合治疗与患者预后密切相关,其中有无肝外转移、是否积极治疗、手术及多学科综合治疗差异有统计学意义,见图 2。
|
| 图 2 64例患者的临床特征及不同治疗模式生存曲线 Figure 2 Survival curves of 64 pancreatic cancer patients with liver metastasis in clinical features and different treatments |
临床研究显示[3],对伴有肝转移的患者,治疗方式有限,总的疗效不理想,但若病情允许,予以手术、介入化疗等积极治疗仍能改善患者生存质量及延长生存期。另外,本研究还发现伴肝外转移患者预后明显较仅有肝转移者差,这在既往文献中少见报道。
3.1 一般临床特征对预后的影响有研究显示[4, 5]:疼痛、体重减轻、肝转移及CA19-9等对胰腺癌的预后影响有统计学意义。但对胰腺癌伴肝转移的研究较少,本研究提示:肝外转移、疼痛、治疗前CA19-9≥1 000 u/ml与预后相关,其中合并肝外转移对预后有显著影响,相关文献[6]也有类似报道。
胰腺癌肝外转移部位中,肺、骨及腹腔淋巴结较常见,往往提示预后不良[7, 8]。本研究20例伴肝外转移。其中,腹腔内淋巴结转移最为常见(14例),其次为肺(8例)及腹膜(7例),骨、脾及肾上腺等部位也可见转移。肝外转移患者预后明显较仅伴肝转移者差,其MST较仅肝转移者短4月(2.0月 vs. 6.0月,P=0.001),1、2年生存率分别为3.8% vs.31.6%和0 vs.13.2%。
CA19-9诊断胰腺癌敏感,被认为是最重要的肿瘤标志物,其动态变化常反映胰腺癌的进展,可作为预测胰腺癌肝转移患者病情变化重要指标之一[9, 10]。本研究观察到共28例CA19-9≥1 000 u/ml,其中16例为合并肝外转移患者,提示CA19-9异常升高可预测病情进展。另外,治疗前CA19-9升高者,多数经有效治疗后可明显下降。治疗前CA19-9<1 000u/ml者的MST较CA19-9≥1 000 u/ml者长4月(6.0月vs. 2.0月,P=0.037),差异有统计学意义。
疼痛是胰腺癌最常见的临床症状,但出现明显疼痛时往往伴随转移,提示病情恶化[11]。本研究显示:89%的患者因上腹或腰背部疼痛就诊,常伴随食欲减退、消瘦、黄疸等,生活质量明显下降。疼痛组与非疼痛组1、2年生存率分别为11.2%vs.20% 和7.3% vs.11.1%,前者MST缩短2月(4.0月vs.6.0月,P<0.05)。不过,有研究[10]进一步分析得出:腹痛与预后无关,而腰背部疼痛与预后关系密切,本研究未进一步行疼痛部位分层分析。
3.2 治疗方式对预后的影响3.2.1 手术治疗手术治疗能让患者获益已被大多数临床研究所证实,Shailesh等[12]研究显示,与非手术治疗组比较,手术组MST明显延长(11.4月 vs. 5.9月,P<0.05),无手术相关严重并发症及死亡病例。对胰腺癌原发灶切除后肝转移患者,只要患者能耐受手术,仍应该争取再次手术切除肝转移病灶,这样能明显延长生存期及改善生活质量,尤其是肿瘤单发、体积小且能完全切除者明显有益[13]。但也有研究显示[14]:手术切除组与对照组的MST差异无统计学意义。本研究共19例行手术治疗,大多数术后腹胀、厌食、消瘦等不适可明显缓解。手术组的MST较非手术组长10月(12.0月 vs.2.0月,P=0.000),1、2年生存率分别为47.4% vs.8.9%和21.1% vs.2.2%。提示手术能明显提高患者生活质量及延长生存期,使患者更多获益。但是,因多数患者一般情况较差,或是伴肝内及肝外广泛转移而失去手术机会。
3.2.2 仅对症支持治疗以外的积极治疗目前,对胰腺癌伴肝转移或合并肝外转移患者,是否积极治疗及采取何种具体方案尚存在争议。不过已有临床研究证实[12, 15, 16, 17, 18],积极予以手术、全身化疗、TACE/TAE等治疗可明显缓解病情,提高患者生活质量及延长生存期。有研究报道[19]积极治疗组的MST及5年生存率分别为20.1月和20.6%。本研究对比积极治疗与仅对症支持治疗预后情况,二者差异有统计学意义。积极治疗组MST较对照组长5月(1.0月vs.6.0月,P=0.007),1、2年生存率分别为0% vs. 27.1%和0% vs.10.4%。因此,对中晚期胰腺癌患者,只要病情允许,应该予以积极的治疗,以改善生活质量及延长生存时间。
3.2.3 介入化疗栓塞或介入化疗(TACE/TAE)通过股动脉插管至胰腺肿瘤及肝转移病灶区域供血血管,注入高浓度化疗药,从而增加肿瘤内抗癌药物浓度和作用时间,提高对肿瘤的毒性作用且全身毒性反应小,同时可行肿瘤血管栓塞,使肿瘤缺血坏死[15]。临床研究显示[6]:反复行TACE/TAE者的MST明显延长(P=0.000),1、2年生存率分别为67.2%和42.7%,患者获益较多。本研究15例行TACE/TAE,其中大多数治疗次数≥2次,其MST较对照组延长3月(6.0月 vs. 3.0月,P=0.041),但其统计学差异不明显,可能与样本量较小有关。
3.2.4 多学科综合治疗转移性胰腺癌的多学科综合治疗能使患者获益,治疗方法增多,患者的MST明显提高[8, 19]。本研究中,6例予以2种以上的联合治疗,其MST较对照组延长21月(24.0月 vs. 3.0月,P=0.000),1、2年生存率分别为66.7% vs.15.3%和50.0% vs.2.4%,差异显著。其中,生存时间超过6年者先后行4次手术切除肿瘤,2次肿瘤无水酒精注射及11次介入化疗,多学科联合治疗应该是该类患者获得长期生存最重要的因素。因此,胰腺癌肝转移的临床多学科综合治疗应该是当前及今后的主要治疗手段,但具体联合方案有待进一步临床研究。
3.2.5 其他中晚期胰腺癌的治疗还有全身化疗、高强度聚焦超声(HIFU)、射频消融及放射性治疗等。对于失去手术机会或无法耐受手术及介入等治疗的患者,全身化疗已经成为主要的治疗方式之一,以吉西他滨为基础的各种化疗方案已在临床广泛应用,研究显示[16, 17],可一定程度上稳定病情,提高患者生活质量,但总的生存率尚不理想。本研究全身化疗组总的生存率与对照组相比差异无统计学意义,但患者化疗后食欲好转、疼痛及腹胀减轻。HIFU治疗中晚期胰腺癌存在争议,其疗效不确切。相关研究[18]示,HIFU不能明显延长生存时间,但可缓解疼痛、腹胀等临床症状。本研究9例行HIFU治疗,未观察到对生存率有明显影响(P=0.480)。近年来,三维适形放射治疗(3-DCRT)在中晚期胰腺癌的治疗中应用逐渐增多,有报道显示[20, 21],经反复放疗后大多数患者疼痛明显缓解,生活质量得到明显改善,同时可适当延长生存期。因此可作为中晚期胰腺癌重要治疗手段之一,但本研究病例无放射治疗、冷冻及射频消融,肿瘤无水酒精注射病例太少,故未进行统计分析。
总之,本研究表明,对胰腺癌肝转移患者,不能过早的消极对待,在患者条件允许的情况下应尽量予以手术、介入化疗栓塞/介入化疗及多学科联合治疗等有效的治疗,这样可明显提高患者生活质量,延长生存时间。
| [1] | Liu FY, Wang MQ, Duan F, et al. Hepatic artery chemoembolizationin patients with liver metastasis from pancreatic carcinoma[J].Zhongguo Zhong Liu Lin Chuang, 2012, 39(6): 331-5. [刘凤永,王茂强,段峰,等. 胰腺癌肝转移的介入治疗[J].中国肿瘤临床,2012,39(6):331-5.] |
| [2] | Katopodis O, Souglakos J, Stathopoulos E, et al. Frontline treatmentwith gemcitabine, oxaliplatin and erlotinib for the treatment ofadvanced or metastatic pancreatic cancer: a multicenter phaseII study of the Hellenic Oncology Research Group (HORG) [J].Cancer Chemother Pharmacol, 2014, 74(2):333-40. |
| [3] | Stathis A, Moore MJ. Advanced pancreatic carcinoma: currenttreatment and future challenges [J]. Nat Rev Clin Oncol, 2010,7(3):163-72. |
| [4] | Tas F, Sen F, Keskin S, et al. Prognostic factors in metastaticpancreatic cancer: Older patients are associated with reducedoverall survival [J]. Mol Clin Oncol, 2013(1):788-92. |
| [5] | Park JK, Yoon YB, Kim YT, et al. Survival and prognostic factorsof unresectable pancreatic cancer[J]. J Clin Gastroenterol, 2008,42(1):86-91. |
| [6] | Liu LX, Ji W, Wang JH, et al. A retrospective analysis onsurvival factors of transarterial chemoembolization for patientsof pancreatic carcinoma with liver metastasis [J]. Fu Dan XueBao(Yi Xue Ban), 2011, 38(2): 101-6.[刘凌晓, 姬巍, 王建华, 等.胰腺癌肝转移患者综合性介入栓塞治疗生存情况的回顾性分析[J]. 复旦学报(医学报), 2011, 38(2):101-6.] |
| [7] | Von Hoff DD, Ramanathan RK, Borad MJ, et al. Gemcitabineplus nab-paclitaxel is an active regimen in patients with advancedpancreatic cancer: a phase i/ii trial [J]. J Clin Oncol, 2011, 29(34):4549-50. |
| [8] | Ouyang HQ, Huang JQ, Liu LM, et al. Clinical analysis ofmultimodality treatment for 164 cases of pancreatic cancerwith liver metastases[C].The First TCM and Western MedicineOncology Forum in 2009 by Doctors and Young and Middle-agedClinicians, 2011: 211-3.[欧阳华强,黄建琴,刘鲁明,等.多学科综合治疗胰腺癌肝转164例临床分析[C].2009年首届全国中西医肿瘤博士及中青年医师论坛, 2011: 211-3.] |
| [9] | Zhao J, Hu Y, Liao Q, et al. Prognostic significance of SUVmaxand serum carbohydrate antigen 19-9 in pancreatic cancer[J].World J Gastroenterol, 2014, 20(19): 5875-80. |
| [10] | Yang GY, Malik NK, Chandrasekhar R, et al. Change in CA 19-9levels after chemoradiotherapy predicts survival in patients withlocally advanced unresectable pancreatic cancer [J]. J GastrointestOncol, 2013, 4(4): 361-9. |
| [11] | Ni QX, Yu XR, Liu L. Discussion for the clinical definition ofpancreatic cancer in China [J]. Zhongguo Ai Zheng Za Zhi, 2012,22(2):81-7.[倪泉兴, 虞先溶, 刘亮. 中国胰腺癌临床诊断标准的探讨[J]. 中国癌症杂志, 2012, 22(2): 81-7.] |
| [12] | Shrikhande SV, Kleeff J, Reiser C, et al. Pancreatic resection forM1 pancreatic ductal adenocarcinoma [J]. Ann Surg Oncol, 2007,14(1): 118-27. |
| [13] | Lorente-Herce JM, Parra-Membrives P, Díaz-Gómez D. Increasedsurvival after resection of pancreatic cancer liver metastases[J].Cir Esp, 2013, 91(6): 390-2. |
| [14] | SK S, Burkert B, AM C, et al. Pancreatic resections foradvanced M1-pancreatic carcinoma: the value of synchronousmetastasectomy [J]. HPB Surg, 2010, 2010: 579672. |
| [15] | Azizi A, Naguib NN, Mbalisike E, et al. Liver metastasesof pancreatic cancer : role of repeti tive transar ter ialchemoembolization (TACE) on tumor response and survival [J].Pancreas, 2011, 40(8): 1271-5. |
| [16] | Klimant E, Markman M, Albu DM. Clinically meaningfulresponse to sequential gemcitabine-based chemotherapy regimensin a patient with metastatic pancreatic cancer [J]. Case Rep Oncol,2013, 6(1): 72-7. |
| [17] | Conroy T, Desseigne F, Ychou M, et al. FOLFIRINOX versusgemcitabine for metastatic pancreatic cancer [J]. N Engl J Med,2011, 364(19): 1817-25. |
| [18] | Sung HY, Jung SE, Cho SH, et al. Long-term outcome of highintensityfocused ultrasound in advanced pancreatic cancer [J].Pancreas, 2011, 40(7): 1080-6. |
| [19] | De Jong MC, Farmell MB, Sclabs G, et al. Liver-directedtherapy for hepatic metastases in patients undergoingpancreaticoduodenectomy: a dual-center analysis [J]. Ann Surg,2010, 252(1):142-8. |
| [20] | Xia SA, Wang J, Che LP, et al. Clinical significance of threedimensionalconformal technique treatment for locally advancedpancreatic cancer[J].Zhongguo Yi Yao Dao Bao, 2012,9(35):75-6,80.[夏士安, 王佳, 车莉萍, 等. 探讨三维适行放射治疗在晚期胰腺癌中的临床意义[J]. 中国医药导报, 2012, 9(35):75-6,80.] |
| [21] | Corsini MM, Miller RC, Haddock MG, et al. Adjuvantradiotherapy and chemotherapy for pancreatic carcinoma. TheMayo Clinic experience(1975-2005)[J]. J Clin Oncol, 2008, 26(21): 3511-6.(21): 3511-6. |
 2014, Vol. 42
2014, Vol. 42


