文章信息
- 邵彬,张洁,吕敏,祝毓琳,余靖,姜晗昉,任军,宋国红,朱步东,车利,贾军,梁旭,王超颖,严颖,林晓琳,黄晓蕾,尤渺宁,王小利,周心娜, 邸立军. 2015.
- SHAO Bin, ZHANG Jie, LV Min, ZHU Yulin, YU Jing, JIANG Hanfang, REN Jun,SONG Guohong, ZHU Budong, CHE Li, JIA Jun, LIANG Xu, WANG Chaoying, YAN Ying, LIN Xiaolin, HUANG Xiaolei, YOU Miaoning, WANG Xiaoli, ZHOU Xinna, DI Lijun. 2015.
- 自体外周血造血干细胞支持下高剂量化疗对晚期乳腺癌患者的生活质量研究
- Effects of High-dose Chemotherapy Supported by Autologous Peripheral Blood Stem Cell on Quality of Life of Advanced Breast Cancer Patients
- 肿瘤防治研究, 2015, 42(02): 145-149
- Cancer Research on Prevention and Treatment, 2015, 42(02): 145-149
- http://www.zlfzyj.com/CN/10.3971/j.issn.1000-8578.2015.02.010
-
文章历史
- 收稿日期:2014-10-29
- 修回日期:2014-05-02
转移性乳腺癌一线化疗的有效率约为20%~60%,对于一线治疗失败和疾病进展的患者,二线和三线治疗的有效率约为20%,中位无进展时间4~6月[1,2]。因此,临床中迫切需要寻找更为有效的治疗方案。提高化疗的剂量强度是提高临床疗效的一种可行手段,20世纪80年代至90年代间,造血干细胞技术的进展,使移植技术在白血病、淋巴瘤、生殖细胞肿瘤和骨肉瘤等均取得了良好的疗效,明显提高了患者的治愈率、延长了生存时间。接受干细胞支持下大剂量化疗的乳腺癌患者逐年递增,特别是对于高危及转移性乳腺癌,国内外研究者进行了大量的临床实践,几项研究报道自体外周血造血干细胞支持下的大剂量化疗能够延长乳腺癌患者生存期[3,4,5,6]。然而延长乳腺癌患者生命的同时,改善他们的生活质量也很重要[7]。
本研究通过探讨晚期乳腺癌患者接受自体外周血造血干细胞支持下高剂量化疗前后的生活质量变化,为医护人员选择有效的干预措施、改善患者健康相关的生活质量提供参考。1 资料与方法1.1 一般资料
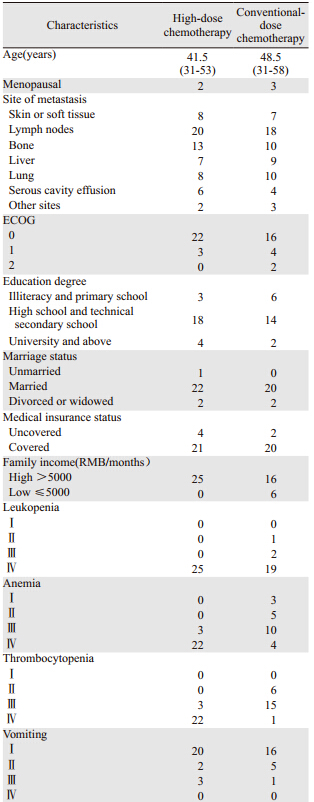
收集2009年10月—2012年5月北京肿瘤医院乳腺肿瘤内科收治的接受自体外周血造血干细胞支持下高剂量化疗的晚期乳腺癌患者25例作为病例组,均为女性,中位年龄41.5岁(31~53岁)。随机选取同期常规剂量化疗的晚期乳腺癌患者22例作为对照组,均为女性,中位年龄48.5岁(31~58岁)。患者具备以下条件:(1)乳腺癌术后,病理诊断为原发性乳腺癌,均为复发晚期;(2)患者有基本的理解能力和表达能力。1.2 治疗方法
外周血造血干细胞动员采用环磷酰胺 2g/d d1~3,进行1周期的动员化疗,联合粒细胞集落刺激因子5 μg/kg皮下注射,应用COBE Spectra血细胞分离机(美国 COBE BCT公司产品)采集外周血CD34+造血干细胞,流式细胞仪测定采集物中CD34+造血干细胞数,并将采集物置于-80℃保存。高剂量化疗方案采用环磷酰胺2 g/m2+塞替派150 mg/m2+卡铂AUC=6(分第1天和第2天),共治疗2周期。化疗结束后48 h回输自体外周血造血干细胞。对照组治疗方案为环磷酰胺600 mg/m2+塞替派50 mg/m2+卡铂AUC=3(分第1天和第2天),21天为一疗程,共治疗6周期。1.3 研究工具和数据收集
SF- 12量表包括8个维度,分别为健康总评(general health,GH)、生理功能(physical function,PF)、生理功能对角色影响(role-physical,RP)、情绪对角色的影响(role- emo tio n al,RE)、疼痛(bodily pain,BP)、活力(vitality,VT)、社会功能(social function,SF)、心理健康(mental health,MH),总计含12个条目,分别计算各维度原始得分,转化为百分制得分,再转化为可比较的各个维度的标准得分,范围为0~100分,分值越高,说明其主观感觉越好、越健康。
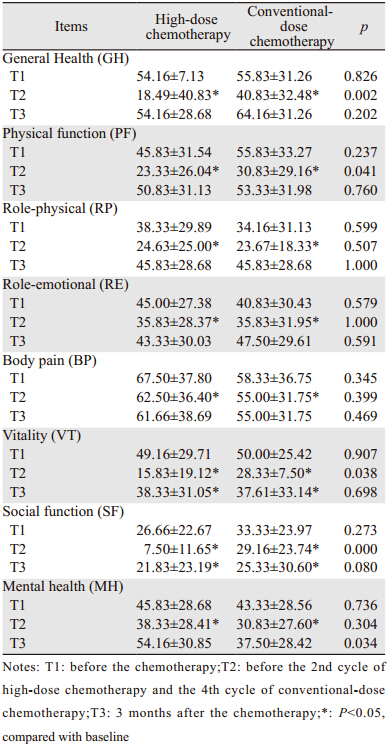
病例组和对照组选取3个时间点填写SF-12量表。第1个时间点(T1)为治疗前,第2个时间点(T2)为第2周期高剂量化疗前和第4周期常规剂量化疗前,第3个时间点(T3)为高剂量化疗结束3月随访时和常规剂量化疗结束后3月。一般情况下由患者本人填写,特殊情况下,如手活动障碍或体力差的患者,可由患者家属或医护人员协助完成,协助者不得对被测者有任何建议。1.4 统计学方法
采用SPSS15.0统计软件进行统计分析。采用t检验对乳腺癌患者接受自体外周血造血干细胞支持下高剂量化疗与对照组得分进行比较。本研究数据采用双侧检验,以P<0.05为差异有统计学意义。2 结果2.1 本组乳腺癌患者特征
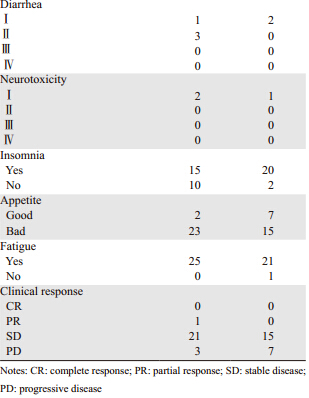
两组中绝经前患者40例,绝经后5例,2例月经状态不能确定。浸润性导管癌43例,浸润性小叶癌2例,髓样癌和黏液癌各1例。内脏转移45例、皮肤软组织转移15例、淋巴结转移38例、骨转移23例、肺转移18例、肝转移16例、恶性体腔积液10例、其他部位转移5例。病例组所有患者均完成动员化疗及2周期高剂量化疗,对照组均完成6周期化疗。
共完成135份量表。6例治疗结束后3月未完成量表,其中2例为干细胞支持下高剂量化疗组,4例为对照组,见表 1。
  |
高剂量化疗和常规剂量化疗组患者生活质量8个维度评分,T2较T1时间点活力和社会功能维度仍显著下降(P<0.05),其他维度差异无统计学意义。高剂量化疗组较常规剂量化疗组T2时间点的总体健康、生理功能活力和社会功能维度显著下降(P<0.05),T1、T3时间点两组各个维度差异无统计学意义。患者不同调查点SF-12量表评分比较见表 2。
肿瘤患者生活质量的评估具有重要意义。生活质量已成为重要的肿瘤治疗临床试验评价体系,生活质量包括生理、心理和社会方面,生活质量影响到肿瘤治疗方案的依从性及治疗的客观效果,因此生活质量的监测成为重要的治疗结果[8]。
乳腺癌高剂量化疗患者恶心、呕吐、乏力、食欲减低显著,化疗期间需在层流病房进行并且住院时间长,患者心理和社会功能均有显著下降。本研究中化疗间期的结果和基线结果的对比显示,患者各项功能(GH、PF、RP、RE、BP、VT、SF、MH)均有显著下降(P<0.05)。既往的大剂量化疗用于高危乳腺癌辅助治疗的研究中(Scandinavian Breast Group Study 9401),应用EORTC QLQ-C30(European Organization for Re search and Treatment of Cancer QLQ-C30)量表评估大剂量化疗组对比常规CEF方案辅助化疗组患者的生命质量表明,化疗期间患者生活治疗各项指标均显著下降,但大剂量化疗患者较常规剂量患者下降更快、更严重[9]。Carlson等[10]对转移性乳腺癌患者大剂量化疗的生活质量研究表明,患者确诊疾病及治疗期间生活质量最差,主要是因为生理及心理功能下降带来的患者对于自己及家庭的焦虑。而且转移性乳腺癌患者因担心不能治愈,治疗结束1年内,患者的焦虑和抑郁仍然非常显著。
本研究中,高剂量化疗组患者与常规剂量化疗组比较,高剂量化疗组,PF、VT和SF较常规剂量组显著下降(P<0.05),而GH、RP、RE、BP及MH差异均无统计学意义(P>0.05)。化疗结束3月,大剂量化疗组与常规剂量组比较,大剂量化疗组MH较常规剂量组有显著改善,其他指标差异均无统计学意义。与化疗前基线水平比较,两组患者均表现为活力及社会功能显著下降。
既往研究表明大部分患者在自体干细胞移植(autologous stem cell transplantation,ASCT)后1年左右对躯体功能的恢复感到满意[11],随着时间的推移躯体功能逐渐改善并能重返工作岗位。尽管部分患者1年后生活质量评分不高,2~5年后仍逐渐好转。尽管大剂量化疗后患者处于逐渐恢复的过程,但研究表明患者治疗后5年仍较健康对照组有显著生活质量下降[12]。特别是大剂量患者治疗带来的生理和心理功能的下降,及伴随的对于疾病复发的焦虑严重影响了患者的生活质量。
本研究中,化疗后3月各项指标与基线指标差异无统计学意义。首先患者化疗剂量较既往大剂量化疗剂量小。本研究中高剂量化疗方案采用环磷酰胺2 g/m2+塞替派150 mg/m2+卡铂AUC=6(分第1天和第2天),而既往研究中的剂量为环磷酰胺6 g/m2+塞替派500 mg/m2+卡铂800 mg/m2(CTCb)。既往研究表明化疗的剂量与患者化疗期间生活质量相关。Therasse等评价了常规FEC化疗和剂量密度FEC化疗生活质量的差异,发现患者化疗的期间,剂量密度化疗组生活质量较常规化疗组显著下降,而两组患者在6月时均恢复到化疗前基线水平[13]。同样剂量增强的化疗对于患者心理也造成了更大的压力[14]。其次干细胞支持对于患者生活质量有显著的提高作用。Brandberg等[9]研究发现92例行干细胞支持治疗的大剂量化疗患者的生活质量各项评分均高于未行干细胞支持的患者,该研究中,高剂量化疗组均行干细胞支持治疗,患者回输干细胞后均有不同程度的生理功能和心理功能好转。再次,本研究中所有行高剂量化疗的患者均在我院造血干细胞移植病区进行,该病房采用国际先进技术、充分体现人性化设计,使患者在干细胞移植治疗的过程中更加舒适温馨。
本研究随访时间短,对于长期困扰转移性乳腺癌患者的乏力、失眠等问题未进行进一步的调查随访。既往研究表明,患者未化疗时即有25%的患者出现乏力症状,而且化疗及随访期间患者疲劳症状更加明显,部分患者在ASCT后5年后仍持续存在,称其为“癌因性疲劳”[15]。患者失眠问题可以持续到患者治疗结束2年,这些都严重影响患者的生活质量[16]。本研究中,高剂量化疗组和常规剂量化疗组患者化疗后3月较基线水平均有活力和社会功能方面的下降。转移性乳腺癌患者由于对疾病的恐惧以及治疗的经济压力,容易产生家庭关系的紧张、职责推诿、角色功能的削弱及社会功能缺陷等问题。一些人需要至少5年才能恢复到正常社会功能。因此本研究应进一步对于患者长期生活质量及相关的症状进行研究。为转移性乳腺癌患者的长期生活和治疗提供更进一步的资料依据,有助于医护人员、癌症患者及家属全面系统地了解患者对生活的主观感觉及其生活质量的整体状况,可用于临床治疗方案的评价与选择,而且对疗效评价、评估预后、卫生资源成本效益分析以及指导预防、保健、健康教育、康复治疗等方面都具有重要意义。
| [1] | Wilcken N, Dear R. Chemotherapy in metastatic breast cancer: a summary of all randomised trials reported 2000–2007[J]. Eur J Cancer, 2008, 44(15): 2218-25. |
| [2] | Colomer R. Gemcitabine and paclitaxel in metastatic breast cancer: a review[J]. Oncology (Williston Park), 2004, 18(14 Suppl 12): 8-12. |
| [3] | Nitz UA, Mohrmann S, Fischer J, et al. Comparison of rapidly cycled tandem high-dose chemotherapy plus peripheral-blood stem-cell support versus dose-dense conventional chemotherapy for adjuvant treatment of high-risk breast cancer: results of a multicentre phase Ⅲ trial[J]. Lancet, 2005, 366(9501): 1935-44. |
| [4] | Biron P, Durand M, Roché H, et al. Pegase 03: a prospective randomized phase Ⅲ trial of FEC with or without high-dose thiotepa, cyclophosphamide and autologous stem cell transplantation in first-line treatment of metastatic breast cancer[J]. Bone Marrow Transplant, 2008, 41(6): 555-62. |
| [5] | Lotz JP, Curé H, Janvier M, et al. High-dose chemotherapy with haematopoietic stem cell transplantation for metastatic breast cancer patients: final results of the French multicentric randomised CMA/PEGASE 04 protocol[J]. Eur J Cancer, 2005, 41(1): 71-80. |
| [6] | Crump M, Gluck S, Tu D, et al. Randomized trial of high-dose chemotherapy with autologous peripheral-blood stem-cell support compared with standard-dose chemotherapy in women with metastatic breast cancer: NCIC MA.16[J]. J Clin Oncol, 2008, 26(1): 37-43. |
| [7] | Partridge AH, Bunnell CA, Winer EP. Quality of life issues among women undergoing high-dose chemotherapy for breast cancer[J]. Breast Dis, 2001, 14: 41-50. |
| [8] | Buccheri G. Depressive reactions to lung cancer are common and often followed by a poor outcome[J].Eur Respir J, 1998, 11(1): 173-8. |
| [9] | Brandberg Y, Michelson H, Nilsson B, et al. Quality of life in women with breast cancer during the first year after random assignment to adjuvant treatment with marrow-supported high-dose chemotherapy with cyclophosphamide, thiotepa, and carboplatin or tailored therapy with Fluorouracil, epirubicin, and cyclophosphamide: Scandinavian Breast Group Study 9401[J]. J Clin Oncol, 2003, 21(19): 3659-64. |
| [10] | Carlson LE, Koski T, Glück S. Longitudinal effects of high-dose chemotherapy and autologous stem cell transplantation on quality of life in the treatment of metastatic breast cancer[J]. Bone Marrow Transplant, 2001, 27(9): 989-98. |
| [11] | Prieto JM, Atala J, Blanch J, et al. Patient-rated emotional and physical functioning among hematologic cancer patients during hospitalization for stem-cell transplantation[J].Bone Marrow Transplant, 2005, 35(3): 307-14. |
| [12] | Andrykowski MA, Bishop MM, Hahn EA, et al. Long-term health-related quality of life, growth, and spiritual well-being after hematopoietic stem cell transplantation[J]. J Clin Oncol, 2005, 23(3): 599-608. |
| [13] | Therasse P, Mauriac L, Welnicka-Jaskiewicz M, et al. Final results of a randomized Phase Ⅲ trial comparing cyclophosphamide, epirubicin, and fluorouracil with a dose-intensified epirubicin and cyclophosphamide + filgrastim as neoadjuvant treatment in locally advanced breast cancer: an EORTC-NCIC-SAKK multicenter study[J]. J Clin Oncol, 2003, 21(5): 843-50. |
| [14] | Morasso G, Costantini M, Baracco G, et al. Assessing psychological distress in cancer patients: validation of a self-administered questionnaire[J]. Oncology, 1996, 53(4): 295-302. |
| [15] | Danaher EH, Ferrans C, Verlen E, et al. Fatigue and physical activity in patients undergoing hematopoietic stem cell transplant[J]. Oncol Nurs Forum, 2006, 33(3): 614-24. |
| [16] | Yoo H, Lee K, Lee J, et al. Korean translation and validity of FACT-BMT version 4 and the quality of life in allogeneic bone marrow transplantation patients[J]. Qual Life Res, 2006, 15(3): 559-64. |
 2014, Vol. 42
2014, Vol. 42