文章信息
- 蔡文涛,夏虹,陈安民. 2015.
- CAI Wentao, XIA Hong, CHEN Anming. 2015.
- 缺氧条件下骨肉瘤MG-63细胞中TG2通过线粒体途径调节细胞凋亡的机制
- Mechanism of TG2 Regulating Hypoxia-induced Apoptosis in Osteosarcoma Cell Line MG-63 by Mitochondrial Pathway
- 肿瘤防治研究, 2015, 42(02): 130-135
- Cancer Research on Prevention and Treatment, 2015, 42(02): 130-135
- http://www.zlfzyj.com/CN/10.3971/j.issn.1000-8578.2015.02.007
-
文章历史
- 收稿日期:2014-03-06
- 修回日期:2014-05-16
2. 510000 广州,南方医科大学研究生院;
3. 510000广州,广州军区广州总医院骨科医院;
4. 430000 武汉,华中科技大学同济医学院附属同济医院骨科
2. Medical Research Center, Zhongnan Hospital of Wuhan University, Wuhan 430071, China
恶性肿瘤的形成是肿瘤细胞无限增殖的结果,增殖过快必然导致肿瘤局部组织缺氧。实验证实 ,在缺氧条件下可以诱导Ⅱ型谷氨酰胺转氨酶(transgiutaminase2,TG2)的表达,而且TG2参与许多肿瘤细胞凋亡过程。目前认为与骨肉瘤相关的细胞凋亡途径主要有两条:死亡受体配体途径和线粒体途径。其中线粒体途径是通过部分凋亡刺激因子刺激线粒体释放细胞色素C,释放到胞质中的细胞色素C与凋亡蛋白酶活化因子-1(Apaf-1)结合形成多聚体;并募集Caspase-9前体与其形成凋亡小体,Caspase-9被激活并活化下游的Caspase,诱导细胞凋亡[1]。研究证实,在HEK293细胞,TG2通过消耗Bax、降低Caspase-3和Caspase-9、抑制细胞核内的细胞色素C释放进入细胞质以及在Ca2+增高时线粒体膜的去极化,从而发挥抗凋亡的作用[2]。在缺氧的肿瘤细胞发现同样的机制是通过与Caspase-3交叉结合消耗Caspase-3,从而发挥抗细胞凋亡的作用[3]。这提示在缺氧环境中,TG2可能通过线粒体途径参与调节骨肉瘤细胞凋亡,但是关于TG2在骨肉瘤细胞凋亡过程中的作用及参与调节的机制还未见报道。本研究在缺氧环境中培养骨肉瘤细胞,通过抑制TG2表达后检测细胞胞核、胞质内细胞色素C蛋白的表达以及Caspase-3活性改变,探讨骨肉瘤MG-63细胞中TG2的抗凋亡作用机制。1 材料与方法 1.1 细胞株、试剂和主要仪器
骨肉瘤细胞株MG-63由华中科技大学同济医学院附属同济医院骨科实验室赠予。培养血清及RPMI 1640培养液由美国Gibco公司购得;鼠抗人TG2、Caspase-3单克隆抗体由美国Santa Cruze公司购得; BCIP/NBT和丽春红显色液以及AP碱磷酶标记抗小鼠IgG和过氧化物酶标记羊抗鼠IgG的二抗由北京中杉生物技术公司购得;FAC Sort流式细胞仪由美国BD公司购得。1.2 实验分组及方法1.2.1 细胞培养
在5%CO2、37℃培养箱中用含10%小牛血清的RPMI1640培养液进行细胞培养。采用0.25%的胰酶消化、传代。取二、三代的对数期的细胞进行实验。1.2.2 缺氧模型
细胞置于CO2缺氧培养箱(5%CO2、95%N2)中、37℃下进行培养,建立缺氧模型。1.2.3 分组及干预
取对数期的细胞以每孔5×105接种至2 ml培养液的6孔板中,待细胞长至90%以上时按要求分为四组:(1)常氧组:细胞在常氧下培养;(2)单纯缺氧组:细胞在缺氧培养箱里培养;(3)对照siRNA缺氧组:转染对照siRNA后在缺氧培养箱里培养;(4)TG2 siRNA缺氧组:转染TG2siRNA后在缺氧培养箱里培养。于培养不同时段(6、12、24、48和72 h)进行相应处理,各组每个时间段设6个复孔。1.2.4 siRNA转染
所有纯化的siRNA分子均由美国赛默飞世尔科技公司设计合成。TG2转染组的siRNA序列是:正链5’-GGGCGAACCACCUGAACAATT-3’,反链3’-TTCCCGCUUGGUGGACUUGUU-5’。对照组siRNA序列是:正链5’-UAGCGACUAAACACAUCAAUU-3’,反链5’-UUGAUGUGUUUAGUCGCUAUU-3’。按照Dharmafect 3试剂盒步骤进行转染,再进行下一步实验。1.2.5 半定量RT-PCR
Trizol法提取总RNA,用分光光度计进行定量和纯度检测。T G 2产物序列(5' - 3')上游:GGGGTGAGAGAGGAAAGACC,下游:TGCAGTCTAGGGAGCTGGAT,产物大小为167 bp,退火温度为58℃。反转录合成cDNA后进行PCR反应,琼脂糖电泳鉴定产物,照相后灰度值分析,以目的基因与内参照基因的比值作为mRNA的相对含量。1.2.6 检测TG的活性
采用微量滴定板法来测定细胞内TG活性[4]。收集在常氧或低氧条件下培养0~72 h的细胞,5-生物素酰氨基戊胺(BP)进行标记。4℃、20 000 g超速离心10 min。以细胞提取物包被96孔的微量滴定板16 h(4℃),5%牛血清蛋白PBS液室温下封闭1 h。辣根过氧化物酶标记链霉亲和素37℃下孵育45 min后,用PBS洗涤,微量滴定板加入邻苯二胺盐酸盐在室温下5~15 min显色,然后以1 mol/L硫酸终止反应。显色后通过微孔板分光光度计490 nm处测量吸光度(A)来进行定量。1.2.7 检测细胞色素C(Cytochrome C)的蛋白质表达水平
细胞色素C从线粒体释放的检测参照Waterhouse等[5]描述的方法。分离出的细胞质及线粒体成分分别用Western blot方法进行检测和分析。1.2.8 测定Caspase的活性
细胞中加入细胞裂解液作用30 min(置于冰上),然后4℃下12 000 g离心10 min。将细胞蛋白提取物(每孔50 μg)加入到微量滴定板孔中,每孔中混以100 μl的反应缓冲液。2 mM浓度的Ac-DEVD-pNa用于Caspase-3的测定。采用微孔板分光光度计405 nm处测量吸光度来进行Caspase-3的定量。对硝基苯胺用于制作标准曲线来评估确定产物的浓度。1.2.9 Western blot定量检测细胞的蛋白质表达
用试剂盒分别提取细胞核、细胞质蛋白、考马斯亮兰蛋白定量。十二烷基硫酸钠-聚丙烯酰胺凝胶电泳分离蛋白后,电转移将蛋白转移至硝酸纤维素膜,封闭、漂洗,然后分别加入TG2、Bax及Cyt C一抗(1∶1 000稀释),37℃、2 h,再加入二抗(1∶5 000),37℃、1 h,丽春红显色。照相后行图像分析。1.2.10 免疫组织化学(SP法)定性检测细胞蛋白质
制1×1细胞爬片,待细胞长至70%~80%时,加入相应的干预。95%的冷丙酮固定10 min,然后按照SP试剂盒说明进行染色。以PBS代替一抗作为阴性对照。结果判定:根据切片染色程度分为强、中、弱、无4个等级;同时随机观察6个高倍镜(200倍)下肿瘤细胞染色阳性的细胞个数,并计算阳性细胞率。1.2.11 Sub-G1法检测细胞凋亡率
胰酶消化后,取2×105细胞,70%的乙醇固定,4℃保存过夜。PBS漂洗,溴化丙啶染色后,FAC Sort流式细胞仪检测。1.3 统计学方法
采用SPSS13.0统计软件进行数据分析。结果数据用x±s表示,多组间比较采用方差分析,组间两两比较采用q检验。2 结果2.1 缺氧条件下各组TG2的活性
在常氧组未检测到原位TG2活性。缺氧组TG2的活性较常氧组表达增强(P<0.01),且各个时间点之间比较差异有统计学意义;与单纯缺氧组及对照siRNA缺氧组比较,TG2 siRNA缺氧组的TG2活性减弱,差异有统计学意义(P<0.01),见表 1。
TG2 mRNA在常氧组仅见低水平表达;而在单纯缺氧组和对照siRNA缺氧组TG2 mRNA较常氧组增高,随缺氧时间延长,TG2 mRNA水平逐渐提高,并且各个时间段之间比较差异有统计学意义(P<0.01);与单纯缺氧组和对照siRNA缺氧组比较,各个时间段TG2 siRNA缺氧组TG2 mRNA水平均降低(P<0.01),见表 1、图 1。
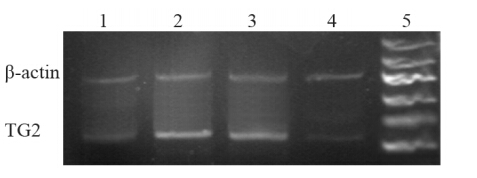 |
| 1: Normoxia group; 2: TG2 siRNA hypoxia group; 3: Control siRNA hypoxia grou; 4: Pure hypoxia group; 5: Marker 图 1 RT-PCR检测各组骨肉瘤细胞TG2 mRNA表达 Figure 1 TG2 mRNA expression observed by RT-PCR in each group |
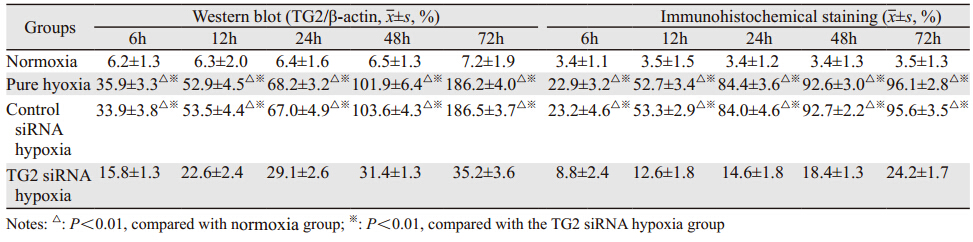
Western blot结果显示:常氧组未见TG2蛋白表达;单纯缺氧组和对照s iRNA缺氧组TG2蛋白表达显著高于常氧组、TG2 siRNA缺氧组(P<0.01),并且表达强度随缺氧时间延长面递增,见表 2、图 2。
 |
 |
| 1: Marker; 2: Normoxia group; 3: TG2 siRNA hypoxia group; 4: Control siRNA hypoxia group; 5: Pure hypoxia group 图 2 Western blot检测各组骨肉瘤细胞TG2蛋白表达 Figure 2 TG2 portein expression observed by Western blot in each group |
免疫组织化学结果显示:MG-63骨肉瘤细胞的TG2蛋白定位于胞质。常氧组中TG2蛋白表达阴性。单纯缺氧组和对照siRNA缺氧组TG2阳性细胞率较常氧组显著提高(P<0.01),并且染色强度随缺氧时间延长明显增强;而与单纯缺氧组和对照siRNA缺氧组比较,TG2 siRNA缺氧组的TG2阳性细胞率显著减少(P<0.01),见表 2、图 3。
 |
| A: Normoxia group; B: Pure hypoxia group; C: TG2 siRNA hypoxia group 图 3 免疫组织化学显示各组骨肉瘤细胞TG2蛋白表达(SP×200) Figure 3 TG2 protein expression observed by immunohistochemical staining(SP×200) |
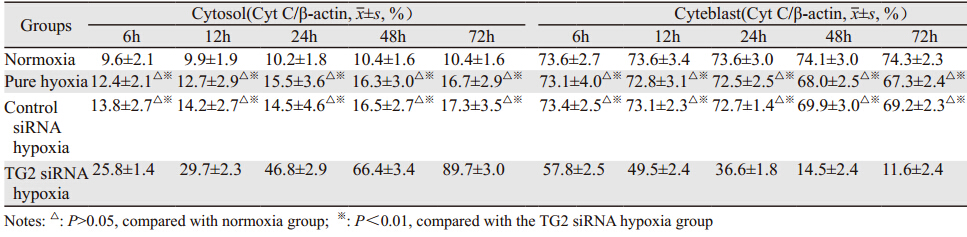
Western blot结果显示,在常氧组,细胞质内仅有少量的细胞色素C;在单纯缺氧组及对照siRNA缺氧组,细胞质及线粒体内的细胞色素C含量仅受轻微影响(P>0.05)。而在TG2 siRNA缺氧组,当抑制TG2的表达时,细胞质内的细胞色素C含量明显增加,而线粒体内的细胞色素C明显减少(P<0.01)。提示TG2抑制缺氧条件下骨肉瘤MG-63细胞色素C由线粒体向细胞质内释放,见表 3、图 4。
 |
 |
| 1: Marker; 2: Normoxia group; 3: Pure hypoxia group; 4: Control siRNA hypoxia group; 5: TG2 siRNA hypoxia group 图 4 Western blot检测各组胞质及胞核细胞色素C内蛋白表达 Figure 4 Protein expression of cytochrome C in cytosol and cyteblast detected by Western blot at different hypoxia culture phases |
流式细胞仪检测结果显示:与常氧组比较,单纯缺氧组及对照siRNA缺氧组,细胞凋亡率轻度增加;而在TG2 siRNA缺氧组,细胞凋亡率较前三组显著提高(P<0.01),见表 4。
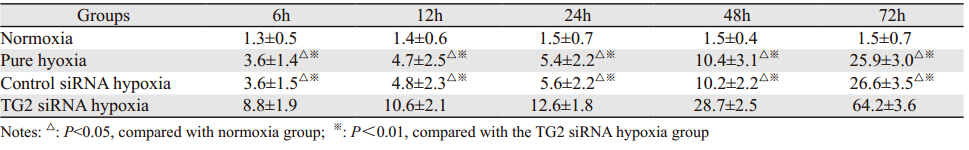 |
与常氧组比较,单纯缺氧组与对照siRNA缺氧组的Caspase-3活性未见明显增强(P>0.05);而在TG2 siRNA缺氧组,Caspase-3活性随着缺氧时间延长逐渐增强(P<0.01),见表 5。Western blot结果显示在单纯缺氧组,可见弱的Caspase-3蛋白条带;而在TG2 siRNA缺氧组,Caspase-3蛋白条带明显增强(P<0.01),并且表达强度随缺氧时间延长明显递增(P<0.01),见表 6、图 5。
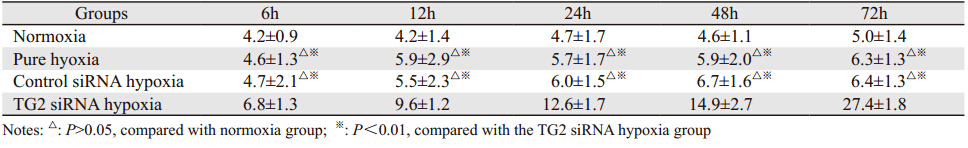 |
 |
| 1: Marker; 2: Normoxia group; 3: TG2 siRNA hypoxia group; 4: Control siRNA hypoxia group; 5: Pure hypoxia group 图 5 Western blot检测各组Caspase-3蛋白表达 Figure 5 Caspase-3 protein expression observed by Western blot |
恶性肿瘤的发生和发展是细胞无限增殖所致,增殖过快必然导致肿瘤局部组织缺氧和供能与耗能之间的不平衡。在缺氧条件下,细胞内的Ca2+浓度会突然升高,引起线粒体肿胀,并激活钙依赖相关酶的活性,导致细胞凋亡[6]。已有研究证实缺氧时肿瘤细胞一系列抑制细胞凋亡的机制在肿瘤的发生及发展中起重要的作用。
TG2也称作组织型谷氨酰胺转氨酶(tissue transgiutaminase,tTG),基因定位于20号染色体的q12条带上,全长约32.5 kb。它的蛋白质相对分子质量为80 kD,有687个氨基酸残基,每个单体含有4个独特的结构域。TG2是谷氨酰胺转氨酶家族中的一个独特成员,存在于细胞的多个部位,包括胞质、胞核、线粒体、细胞膜表面以及细胞外基质。它不仅具有Ca2+依赖的催化蛋白交联的活性及GTP依赖的G蛋白的功能,还具有蛋白二硫键异构酶活性和蛋白激酶的功能[7]。研究证实TG2参与许多细胞的凋亡调控过程。
但关于TG2在细胞凋亡中的作用存在争议[8]。许多研究结果都支持TG2的促凋亡作用,在缺氧氧化作用下,高水平的ROS触发Ca2+进入细胞内,导致TG2酶学活性增强,从而引起细胞凋亡[9]。然而最近的研究发现TG2表达和凋亡并不是完全一致的。有几种快速分裂的肿瘤细胞虽表达了高水平的TG2,却没进入凋亡。研究显示,当内皮细胞内的TG2消耗尽后导致细胞周期停止而发生细胞凋亡[10]。最新研究证实,诱导TG2的表达可以促进肾癌细胞的存活[11]。细胞核内突变的TG2(R580A)可以抵消其胞质内的TG2的促凋亡作用[12]。这些研究结果提示TG2不仅具有促凋亡作用,而且还有抗凋亡作用,这种似乎矛盾的作用取决于细胞类型、所受刺激类型及TG2在细胞内的定位和构型[13,14]。
为了探讨缺氧对MG-63骨肉瘤细胞TG2表达的影响,我们将MG-63骨肉瘤细胞放在缺氧环境下进行体外培养。免疫组织化学结果显示TG2蛋白表达主要定位于细胞质内。在缺氧条件下,TG2的活性增强,而且TG2 mRNA水平及蛋白水平表达都明显增强,并且随着缺氧时间的延长逐渐增高。免疫组织化学提示蛋白表达主要定位于细胞质内。说明缺氧能够诱导MG-63骨肉瘤细胞TG2的表达,而且主要是增强细胞质内TG2的活性。通常情况下,细胞质内TG2通过其转氨基作用来促进凋亡,但本研究结果却相反。单纯缺氧组,其细胞凋亡率轻度增加;通过转染TG2 siRNA抑制TG2的表达时,其细胞凋亡率较单纯缺氧组显著增加。这表明缺氧诱导MG-63骨肉瘤细胞表达的TG2具有抗凋亡的作用。在单纯缺氧组的细胞凋亡率的增加可能与骨肉瘤细胞凋亡存在多种凋亡途径有关。
骨肉瘤细胞凋亡途径主要包括死亡受体配体途径和线粒体途径。其中线粒体途径是通过部分凋亡刺激因子刺激线粒体释放细胞色素C,释放到胞质中的细胞色素C与凋亡蛋白酶活化因子-1(Apaf-1)结合形成多聚体;并募集Caspase-9前体与其形成凋亡小体,Caspase-9被激活并活化下游的Caspase-3,诱导细胞凋亡[15,16]。
为了进一步探讨在缺氧条件下骨肉瘤MG-63细胞的TG2发挥抗凋亡的作用途径,笔者同时探讨了TG2与细胞色素C以及其调节因子之间的关系。结果提示单纯缺氧条件下,胞质内细胞色素C升高不明显,但是当用siRNA抑制TG2的表达时,细胞核内的细胞色素C减少,而胞质内细胞色素C显著升高。说明TG2抑制缺氧条件下骨肉瘤MG-63细胞色素C由线粒体向细胞质内释放,从而发挥抗凋亡的作用。
Caspases-3是Caspases家族中重要的效应因子,正常情况下以酶原(32kD)的形式存在于胞质中,没有活性。在凋亡的早期阶段,它被激活;活化的Caspase-3由两个大亚基(17 kD)和两个小亚基(12 kD)组成,裂解相应的胞质、胞核底物,最终导致细胞凋亡。最新研究证实,TG2可以与细胞核、细胞质及线粒体内的一些蛋白形成非共价复合物。在缺氧条件下,TG2被激活后在胞质内形成的交联聚合体可以与Caspase-3形成不溶性复合物,从而抑制了Caspase-3的活性,抵抗缺氧诱导的凋亡[4]。这种阻止细胞凋亡的作用是不依赖于TG2转化酶作用,与TG2定位于细胞质及其构象有关。本研究结果显示,单纯缺氧组未见Caspase-3活性表达增强,但在TG2 siRNA缺氧组通过转染TG2 siRNA抑制TG2的表达时,Caspase-3活性及蛋白表达明显增强,细胞凋亡率明显增加。说明在缺氧情况下高表达的TG2可以通过抑制Caspase-3的活性从而发挥抗凋亡的作用。
综上所述,缺氧环境下,MG-63骨肉瘤细胞质的TG2活性明显增强,并且随缺氧时间延长TG2 mRNA及蛋白表达水平逐渐增强;TG2可以阻止细胞核内细胞色素C向胞质释放,并且在胞质内形成的交联聚合体可以与Caspase-3形成不溶性复合物,降低Caspase-3的表达及活性,从而发挥抗凋亡的作用,这可能是肿瘤的一个保护性的逃逸机制。而通过转染TG2的siRNA抑制TG2表达,可提高Caspase-3的活性及蛋白表达水平,导致细胞凋亡的增加,这为研究骨肉瘤的治疗策略寻找到一个新的切入点。
研究证实Bcl-2、凋亡蛋白抑制因子(inhibitors of apoptosis proteins,IAPs)、p53等细胞凋亡因子在调控骨肉瘤细胞凋亡过程中发挥重要的作用。但关于骨肉瘤细胞凋亡过程中TG2与细胞凋亡因子之间的关系还不清楚,下一步可通过研究TG2与这些细胞凋亡因子的关系更加深入的探讨TG2抑制肿瘤细胞凋亡的机制。
| [1] | Zhang YQ, Xiao CX, Lin BY, et al. Silencing of Pokemon enhances caspase-dependent apoptosis via fas- and mitochondriamediated pathways in hepatocellular carcinoma cells[J]. PLoS One, 2013, 8(7): e68981. |
| [2] | Cho SY, Lee JH, Bae HD, et al. Transglutaminase 2 inhibits apoptosis induced by calcium- overload through down-regulation of Bax[J]. Exp Mol Med, 2010, 42(9): 639-50. |
| [3] | Jang GY, Jeon JH, Cho SY, et al. Transglutaminase 2 suppresses apoptosis by modulating caspase 3 and NF-kappaB activity in hypoxic tumor cells[J]. Oncogene, 2010, 29(3): 356-67. |
| [4] | Shin DM, Jeon JH, Kim CW, et al. Cell type-specific activation of intracellular transglutaminase 2 by oxidative stress or ultraviolet irradiation:implications of transglutaminase 2 in age-related cataractogenesis[J]. J Biol Chem, 2004, 279(15): 15032-9. |
| [5] | Waterhouse NJ, Goldstein JC, Kluck RM, et al. The (Holey) study of mitochondria in apoptosis[J]. Methods Cell Biol, 2001, 66: 365-91. |
| [6] | Jeong SY, Seol DW. The role of mitochondria in apoptosis[J]. BMB Rep, 2008, 41(1): 11-22. |
| [7] | Facchiano A, Facchiano F. Transglutaminases and their substrates in biology and human diseases: 50 years of growing[J]. Amino Acids, 2009, 36(4): 599-614. |
| [8] | Fésüs L, Szondy Z. Transglutaminase 2 in the balance of cell death and survival[J]. FEBS Lett, 2005, 579(15): 3297-302. |
| [9] | Caccamo D, Curro M, Ferlazzo N, et al. Monitoring of transglutaminase 2 under different oxidative stress conditions[J]. Amino Acids, 2011, 42(2-3): 1037-43. |
| [10] | Nadalutti C, Viiri KM, Kaukinen K, et al. Extracellular transglutaminase 2 has a role in cell adhesion, whereas intracellular transglutaminase 2 is involved in regulation of endothelial cell proliferation and apoptosis[J]. Cell Prolif, 2011, 44(1): 49-58. |
| [11] | Ku BM, Kim DS, Kim KH, et al. Transglutaminase 2 inhibition found to induce p53 mediated apoptosis in renal cell carcinoma[J]. FASEB J, 2013, 27(9): 3487-95. |
| [12] | Colak G, Keillor JW, Johnson GV. Cytosolic guanine nucleotide binding deficient form of transglutaminase 2 (R580A) potentiates cell death in oxygen glucose deprivation[J]. PLoS One, 2011, 6(1): e16665. |
| [13] | Nurminskaya MV, Belkin AM. Cellular functions of tissue transglutaminase[J]. Int Rev Cell Mol Biol, 2012, 294:1-97. |
| [14] | Gundemir S, Johnson GV. Intracellular localization and conformational state of transglutaminase 2: implications for cell death[J]. PLoS One, 2009, 4(7): e6123. |
| [15] | Li M, Zhang Y. Apoptosis and osteosarcoma[J]. Zhongguo Gu Ke Lin Chuang Yu Ji Chu Yan Jiu Za Zhi, 2011, 3(4): 299-303.[李梅,张余. 细胞凋亡与骨肉瘤[J]. 中国骨科临床与基础研究杂志, 2011, 3(4): 299-303.] |
| [16] | Fesik SW. Promoting apoptosis as a strategy for cancer drug discovery[J]. Nat Rev Cancer, 2005, 5(11): 876-85. |
 2014, Vol. 42
2014, Vol. 42