文章信息
- 王帅,Javed Akhtar,王洲. 2015.
- WANG Shuai, Javed Akhtar, WANG Zhou. 2015.
- 沉默stathmin基因增强食管鳞癌细胞对紫杉醇敏感度的实验
- stathmin Silencing Increases Sensitivity of Esophageal Squamous Cell Carcinoma Cells to Paclitaxel
- 肿瘤防治研究, 2015, 42(02): 126-129
- Cancer Research on Prevention and Treatment, 2015, 42(02): 126-129
- http://www.zlfzyj.com/CN/10.3971/j.issn.1000-8578.2015.02.006
-
文章历史
- 收稿日期:2014-03-10
- 修回日期:2014-03-28
食管癌是世界最常见的肿瘤之一,在东亚,主要以食管鳞癌为主[1]。多种癌基因及抑癌基因的异常改变是食管鳞癌发生、发展的重要机制[2]。化疗是肿瘤治疗的重要组成部分,近年来广泛应用于食管鳞癌。紫杉醇通过干扰细胞微管聚合抑制肿瘤细胞的生长和增殖,是常用的化疗药物之一。但是食管鳞癌患者对紫杉醇化疗的临床反应率仅19%~40%[3]。在食管鳞癌组织中,stathmin蛋白呈高表达状态[4],且与食管鳞癌的恶性程度、淋巴结转移、肿瘤浸润深度及分期有关[5]。研究表明沉默stathmin基因的表达可以逆转卵巢癌对紫杉醇的化疗耐药性[6]。但是stathmin表达水平与食管鳞癌对紫杉醇化疗敏感度的关系研究较少。本实验探讨stathmin基因沉默后,食管鳞癌细胞对以紫杉醇为代表的化疗药物化疗敏感度的变化,并进一步研究相关机制。1 材料与方法1.1 细胞培养
食管鳞癌KYSE150细胞购自中国科学院上海生命科学研究院,常规培养于含100 ml/L胎牛血清、100 u/ml青霉素、100 ng/ml链霉素的RPMI 1640培养液中,置于37℃、50 ml/L CO2的培养箱(相对湿度为95%)培养,取对数生长期细胞用于实验。紫杉醇购自美国Sigma公司,并溶解于乙醇(终浓度<1%)。1.2 质粒转染
按照Zhang等[7]报道设计特异性小片段干扰RNA (small interfering RNA,siRNA) 和未特异性干扰的对照siRNA。经BLAST分析,设计的siRNA序列不与人类mRNA同源。根据siRNA序列化学合成cDNA(北京鼎国昌盛生物技术有限责任公司)。特异性抑制stathmin基因的cDNA序列为:5’-GATCCGAAACGAGAGCACGAGAAATTCAAGAGATTTCTCGTGCTCTCGTTTCAGA-3’;对照cDNA序列5’-GATCCGCAAAAGAGCGAAAAGTTCAA GAGATTTTCGCTCTTTTGCAGA-3’。cDNA寡核苷酸形成双链DNA片段后,插入pSilencer4.1-CMVneo (pSC)载体的BamHⅠ和Hind Ⅲ限制性位点之间 (Ambion公司),分别形成特异性stathmin干扰(pSC-siR stathmin)和未特异性对照(pSC-siR control)的重组质粒。重组质粒经限制性内切酶消化和DNA测序分析证实为有效重组(Takara公司)。KYSE150细胞接种于6孔培养板,待细胞生长达80%满,根据说明书利用Lipofectamine 2000TM试剂盒将pSC-siR stathmin和pSC-siR control分别转染至KYSE150细胞。转染 48 h后,利用含有G418(800 µg/ml)的培养液筛选稳定转染细胞。1.3 实时定量PCR
TRIzol法提取总RNA,按照试剂盒说明书反转录,GAPDH基因为内参。引物序列如下,stathmin:上游引物:5’-atggcttcttctgatatccag-3’,下游引物:5’-ttagtcagcttcagtctcgtc-3’;GAPDH:上游引物:5’-GGTATCGTGGAA GG ACTCATGAC-3’,下游引物:5'-ATGCCA GTGAGCTTC CCGTTCAGC-3。使用LightCycler480荧光定量PCR仪进行PCR反应。设定程序为两步法:预变性95℃,3 min;之后每一步94℃变性45 s,56℃复性45 s,72℃延伸45 s,共28个循环。最后72℃延伸7 min,至 4℃完成反应。采用LightCycler480 Software 1.5软件进行图像分析。实验重复3次。1.4 蛋白质印迹
分别抽提细胞总蛋白。按照操作说明书灌胶、电泳,印迹法转膜,封闭。加入1:1 000稀释的一抗(兔抗人stathmin多克隆抗体、 兔抗人GAPDH多克隆抗体),4℃反应过夜。加入1:5 000稀释的二抗(偶联辣根过氧化物酶标记的山羊抗兔抗体),作用1 h后漂洗。以GAPDH为内参,应用AlphaImagerTM 2200凝胶成像系统照相并分析,实验重复3次。1.5 CCK-8检测
KYSE150细胞以每孔1×104个细胞种植于96孔板,无血清培养液预培养24 h。不同浓度的紫杉醇(0.01~5 nmol/L)预处理细胞72 h后,加入10 μl CCK-8,37℃继续培养2 h。450 nm波长测量吸光度(optical density,OD)。每个细胞系均设两组对照:不加药物处理组和无细胞组。细胞生长抑制率(inhibition rate,IR):IR=(OD对照组-OD实验组)/ OD对照组。1.6 流式细胞仪检测
根据CCK-8检测结果,选用0.01 nmol/L紫杉醇干预KYSE150细胞72 h。收集转染及未转染KYSE150细胞,用70%乙醇固定,冷PBS洗涤2次,碘化丙啶(20 µg/ml)染色后用流式细胞仪(BD公司)进行细胞周期检测。1.7 细胞分裂指数检测
分别收集转染及未转染KYSE150细胞,应用含有10 g/ml二脒基苯基吲哚和5 μg/ml RNA酶的PBS染色。荧光显微镜下随机计数300个细胞,并计算有丝分裂细胞数。分裂指数=有丝分裂细胞数/300×100%。1.8 统计学方法
组间比较采用单因素方差(one-way ANOVO)分析,若各组数据符合正态分布且方差齐性检验无统计学意义,选用最小显著差数法(least-significant difference,LSD)进行各组比较。若不符合正态分布,选用非参数检验。所有计量资料以均数±标准差(x±s)表示。P<0.05为差异有统计学意义。2 结果 2.1 质粒转染可有效沉默stathmin基因
实时定量PCR结果显示pSC-siR control转染和未转染KYSE150细胞均高表达stathmin基因,且差异无统计学意义;pSC-siR stathmin稳定转染KYSE150细胞中,stathmin mRNA表达被完全抑制,见图 1A。蛋白免疫印迹结果表明:pSC-siR stathmin转染后,KYSE150细胞中stathmin蛋白表达也被完全抑制,见图 1B。
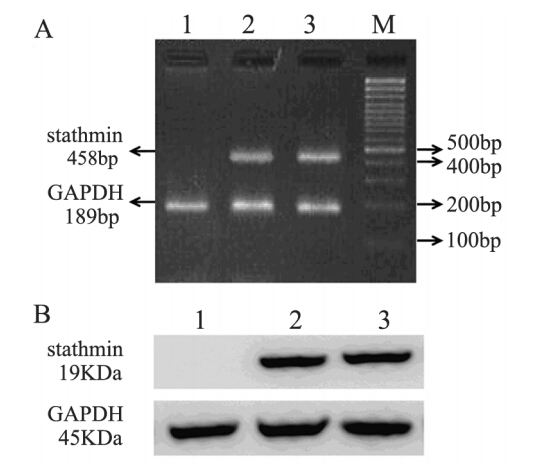 |
| M: marker; 1: pSC-siR stathmin transfected KYSE150 cells; 2: pSCsiR control transfected KYSE150 cells; 3: untransfected KYSE150 cells A: the gel was representative of three independent RT-PCR assays; B: the gel was representative of three independent Western blot assays 图 1 siRNA沉默stathmin基因mRNA(A)和蛋白(B)表达 Figure 1 mRNA(A) and protein(B) expression of stathmin silenced by siRNA technology |
紫杉醇对pSC-siR stathmin转染、pSC-siR control转染和未转染KYSE150细胞的半数抑制浓度分别为:0.018、4.885和3.454 nmol/L,见图 2。相比未转染KYSE150细胞,pSC-siR stathmin转染KYSE150细胞对紫杉醇敏感度增强191.4倍。
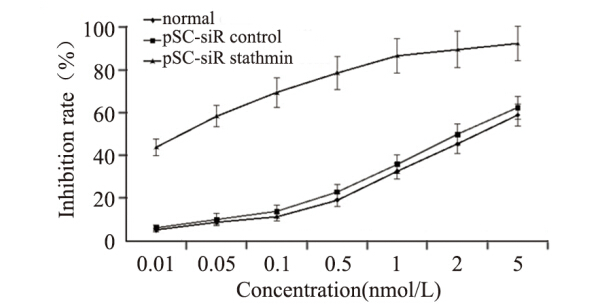 |
| Normal: untransfected KYSE150; pSC-siR control: pSC-siR control transfected KYSE150; pSC-siR stathmin: pSC-siR stathmin transfected KYSE150 图 2 stathmin基因沉默增加KYSE150细胞对紫杉醇敏感性 Figure 2 stathmin silencing increased the sensitivity of KYSE150 cells to paclitaxel |
pSC-siR stathmin转染、pSC-siR control转染和未转染KYSE150 G2/M期细胞分别为(34.6±2.9)%、(11.2±2.0)%和(10.7±1.5)%,见图 3A。经紫杉醇干预后,pSC-siR control转染和未转染KYSE150 G2/M期细胞轻微增加,且两细胞系间差异无统计学意义;pSC-siR stathmin转染KYSE150细胞出现显著的G2/M期阻滞[(55.4±6.2)%,P=0.000],见图 3B。
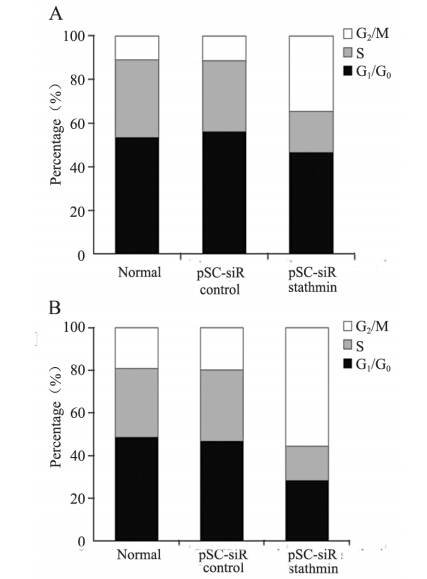 |
| A: cell cycle analysis of transfected and untransfected KYSE150 cells without drug intervention; B: cell cycle analysis of transfected and untransfected KYSE150 cells with paclitaxel intervention 图 3 stathmin基因沉默对KYSE150细胞周期影响 Figure 3 Effect of stathmin silencing on KYSE150 cells cycle |
pSC-siR stathmin转染、pSC-siR control转染和未转染KYSE150细胞有丝分裂指数分别为(8.5±1.4)%、(14.2±3.8)%和(16.3±4.2)%,见图 4。经紫杉醇处理后,pSC-siR control转染和未转染KYSE150细胞有丝分裂指数轻微降低;pSC-siR stathmin转染KYSE150细胞有丝分裂指数显著降低[(5.6±0.8)%,P=0.000]。
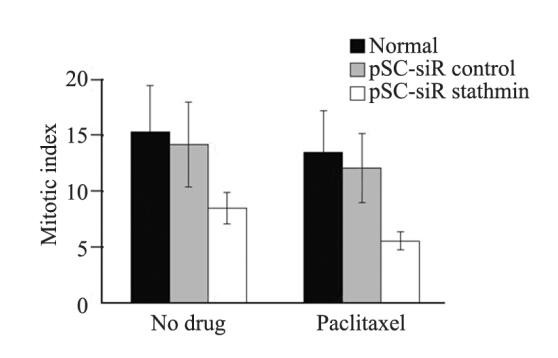 |
| 图 4 stathmin基因沉默对KYSE150细胞有丝分裂影响 Figure 4 Effect of stathmin silencing on mitotic index of KYSE150 cells |
食管鳞癌对化疗药物临床反应率的差异主要由于肿瘤细胞的基因异质性[7]。众多学者已经研究了食管鳞癌对化疗药物敏感度的基因标志物,例如,hOGG1基因调控顺铂的敏感度,胸苷酸合成酶基因调控氟尿嘧啶的敏感度[8,9]。但是影响食管鳞癌对紫杉醇化疗敏感度的特异性基因鲜有报道。Stathmin基因编码微管解离蛋白,也称原癌基因蛋白18 (oncogene protein 18,Op18 ),通过结合微管蛋白参与细胞微管和纺锤体的形成,与细胞的增殖、分化和迁移均密切相关。众多研究表明,stathmin基因对于食管鳞癌的早期诊断和预后判断有重要意义,是食管鳞癌的潜在治疗靶点[4,5]。并且stathmin的表达调节人类卵巢癌对紫杉醇的化疗敏感度[6]。
本实验利用siRNA技术沉默食管鳞癌KYSE150细胞stathmin基因表达。pSC-siR stathmin转染后,KYSE150细胞内源性stathmin基因表达被完全抑制。药物敏感度实验证实,stathmin基因沉默提高KYSE150细胞对紫杉醇敏感度。本实验结果与Wang等[10]在骨肉瘤的研究相似。Nishio等[11]也在肺癌中证实:抑制stathmin表达可以增强肿瘤细胞对紫杉醇的敏感度。
为了探讨食管鳞癌化疗敏感度增强的相关机制,本实验进一步应用流式细胞仪检测KYSE150细胞周期变化。pSC-siR stathmin转染导致KYSE150细胞G2/M期阻滞。细胞有丝分裂指数检验表明stathmin基因沉默抑制KYSE150细胞进入分裂期。本实验与国外学者研究结果一致[10,11]。G2/M期是细胞增殖的重要阶段,是细胞周期主要的调控点。紫杉醇是常用的抗细胞微管类化疗药物,通过可逆地与微管结合,增加细胞微管的稳定性,影响细胞微管的动态平衡。stathmin是种微管调节蛋白,参与细胞微管解离。因此可以推测stathmin基因沉默与紫杉醇共同作用于KYSE150细胞微管,抑制微管的组装和纺锤体的形成,进而导致细胞阻滞于G2/M期,有丝分裂减少。但是具体分子通路有待进一步研究。
本实验证实stathmin沉默通过G2/M期阻滞增强食管鳞癌细胞对紫杉醇的敏感度,为食管鳞癌的个体化化疗和基因治疗提供理论基础。stathmin基因沉默和紫杉醇化疗的联合应用将有助于改善食管鳞癌患者的长期生存,具有巨大的临床应用价值。
| [1] | Jemal A, Bray F, Center MM, et al. Global cancer statistics[J]. CA Cancer J Clin, 2011, 61(2): 69-90. |
| [2] | Wang S, Wang Z. Review on RUNX3 gene and esophageal cancer[J]. Zhonghua Zhong Liu Fang Zhi Za Zhi, 2012, 19(23):1831-5. [王帅, 王洲. RUNX3基因与食管癌相关性的研究进展[J]. 中华肿瘤防治杂志, 2012, 19(23):1831-5.] |
| [3] | Overman MJ, Kazmi SM, Jhamb J, et al. Weekly docetaxel, cisplatin, and 5-fluorouracil as initial therapy for patients with advanced gastric and esophageal cancer[J]. Cancer, 2010, 116(6):1446-53. |
| [4] | Pang X, Li SL, Zhao ZH, et al. Clinical significance of expression of TGF-β1,TIEG1 and stathmin proteins in esophageal squamous cell carcinoma[J]. Shi Jie Hua Ren Xiao Hua Za Zhi, 2013, 21(4): 327-31. [庞霞, 李晟磊, 赵志华, 等. TGF-β1、TIEG1和Stathmin蛋白在食管鳞状细胞癌组织中的表达及临床意义[J]. 世界华人消化杂志, 2013, 21(4): 327-31.] |
| [5] | Wang F, Wang LX, He W, et al. Expression of stathmin in esophageal squamous cell carcinoma and its biological significance[J]. Nanfang Yi Ke Da Xue Xue Bao, 2010,30(7): 1552-7.[王峰, 王留兴, 何伟, 等. Stathmin基因在食管鳞癌中的表达及生物学意义[J]. 南方医科大学学报, 2010, 30(7): 1552-7.] |
| [6] | Xiao YJ, Wang HM, Han ZX, et al. Reverse paclitaxel resistance by silencing stathmin and mdr1 in ovarian cancer cells[J]. Zhong Liu Fang Zhi Yan Jiu,2011, 38(3):243-6. [肖玉洁, 王红梅, 韩正祥, 等. 靶向stathmin和mdr1基因逆转卵巢癌细胞紫杉醇耐药的研究[J]. 肿瘤防治研究, 2011, 38(3): 243-6.] |
| [7] | Zhang HZ, Wang Y, Gao P, et al. Silencing stathmin gene expression by survivin promoter-driven siRNA vector to reverse malignant phenotype of tumor cells[J]. Cancer Biol Ther, 2006, 5(11): 1457-61. |
| [8] | Gao D, Hu J, Zhang X, et al. Effect of hOGG1 over-expression on cisplatin resistance in esophageal squamous carcinoma cells[J]. Cancer Biother Radiopharm, 2013, 28(6): 433-40. |
| [9] | Balachandran R, Welsh MJ, Day BW. Altered levels and regulation of stathmin in paclitaxel-resistant ovarian cancer cells[J]. Oncogene, 2003, 22(55): 8924-30. |
| [10] | Wang R, Dong K, Lin F, et al. Inhibiting proliferation and enhancing chemosensitivity to taxanes in osteosarcoma cells by RNA interference-mediated downregulation of stathmin expression[J]. Mol Med, 2007, 13(11-12): 567-75. |
| [11] | Nishio K, Nakamura T, Koh Y, et al. Oncoprotein 18 overexpression increases the sensitivity to vindesine in the human lung carcinoma cells[J]. Cancer, 2001, 91(8): 1494-9. |
 2014, Vol. 42
2014, Vol. 42


