文章信息
- 刘彩云,史建红,周金飒,赵明智,王冰,崔乃鹏,陈保平. 2015.
- LIU Caiyun, SHI Jianhong, ZHOU Jinsa, ZHAO Mingzhi, WANG Bing, CUI Naipeng,CHEN Baoping. 2015.
- 肿瘤坏死因子α调节乳腺癌SK-BR-3细胞中KLF4表达及其机制研究
- Mechanism of TNFα Regulating KLF4 Expression in Breast Cancer Cells SK-BR-3
- 肿瘤防治研究, 2015, 42(02): 117-120
- Cancer Research on Prevention and Treatment, 2015, 42(02): 117-120
- http://www.zlfzyj.com/CN/10.3971/j.issn.1000-8578.2015.02.004
-
文章历史
- 收稿日期:2014-01-30
- 修回日期:2014-04-02
2. 071000 保定,河北大学附属医院中心实验室;
3.071000 保定,河北大学临床医学院
2. Central Laboratory, Affiliated Hospital of Hebei University, Baoding 071000, China;
3.Clinical Medical College of Hebei University, Baoding 071000, China
乳腺癌是严重威胁妇女健康的一种恶性肿瘤。由于乳腺组织富含淋巴管网且血运丰富,故乳腺癌早期即可发生血行及淋巴转移,为乳腺癌的诊治带来极大的不利[1,2]。如何控制乳腺癌细胞增殖并诱导凋亡仍是目前防治乳腺癌过程中亟待解决的重要问题。近年发现,KLF(Krüpple-like factors)家族中的Krüppel样因子 4(KLF4)是一种多能转录因子[3,4]。KLF4不仅调节细胞增殖、分化和炎症基因表达,而且也是将体细胞重编程为类多能干细胞(iPS)必不可少的4种转录因子之一[5]。KLF4与多种肿瘤的发生、发展有关,膀胱癌、结直肠癌、食管癌、前列腺癌中均发现KLF4表达降低[6,7,8,9]。我们前期研究发现,KLF4在乳腺浸润性导管癌组织中的表达下调,并与乳腺癌的恶性程度及预后相关,但其分子机制并不清楚[10]。为了进一步明确KLF4在乳腺癌中的作用机制,本研究应用肿瘤坏死因子α(tumor necrosis factor,TNFα)作用于乳腺癌SK-BR-3细胞,观察KLF4的表达变化及其与乳腺癌细胞增殖和凋亡的关系,并应用腺病毒载体介导KLF4过表达,观察KLF4对TNFα诱导的乳腺癌细胞凋亡的影响。1 材料与方法1.1 细胞株和细胞培养
乳腺癌SK-BR-3细胞购自中国科学院上海生命科学研究院细胞资源中心。用含10%胎牛血清、100 u/ml青霉素、100 ng/ml链霉素的RPMI 1640培养液置于37℃、5%CO2、相对湿度90%的培养箱中培养,定期换液传代,取对数生长期细胞用于实验。1.2 分组方法
用含10%胎牛血清及100 u/ml青霉素、100 ng/ml链霉素的RPMI 1640培养液培养新传代的乳腺癌SK-BR-3细胞48 h,加入不同浓度的TNFα(0、1、5、10、20 ng/ml)刺激24 h,用Western blot、流式细胞术、DAPI染色方法分析不同剂量刺激的KLF4的表达量以及凋亡程度。用pAd-GFP-KLF4或pAdGFP感染乳腺癌SK-BR-3细胞,48 h后加入10 ng/ml的TNFα继续培养48 h后收集细胞,用流式细胞术分析细胞周期及凋亡情况。 1.3 主要试剂
RPMI 1640培养液购自Gibico公司,胎牛血清购自Biological公司,胰蛋白酶消化液购自Sigma公司,TNFα购自Pepro Tech公司,人KLF4抗体购自ABGENT公司,β-actin抗体购自Santa Cruz公司,羊抗兔二抗和羊抗小鼠二抗购自Epitomics公司,ECL化学发光试剂购自Millipore公司,DAPI和PI染料购自Sigma公司,M-MLV购自Promega公司,SYBR qRCR试剂盒购自Invitrogen公司。1.4 腺病毒表达载体的构建
以含人KLF4基因全长cDNA序列的质粒pGFPKLF4质粒为模板扩增GFP-KLF4和GFP cDNA序列,将其重组至腺病毒载体pAD/CMV/V5-DEST vector(Invitrogen公司)构建GFP-KLF4和GFP腺病毒质粒pAd-GFP-KLF4和pAd-GFP。按照试剂盒说明书,用脂质体Lipofectamine 2000(Invitrogen公司)将以上质粒转染至A293细胞中进行病毒包装。A293细胞上清液用于感染SK-BR-3细胞。1.5 Western blot分析
收集各组细胞,重悬于细胞裂解液(1 % NP40,150 mmol/L NaCl,50 mmol/L Tris-HCl,pH7.5,10%甘油,1 mmol/L Na3VO4,1 mmol/L PMSF,1 mmol/L DTT)中,冰浴30 min,使细胞充分裂解。4℃,8 000 r/min离心10 min,收集上清液,用改良的Lowry法进行蛋白定量。100 μg蛋白样品经SDS-聚丙烯酰胺凝胶电泳分离、转膜、脱脂奶粉封闭后,分别与KLF4抗体和β-actin抗体及相应二抗进行反应,ECL化学发光试剂检测结果。信号强度用Bio 1D图像分析软件进行相对定量分析。1.6 细胞周期及凋亡检测
取对数生长期SK-BR-3细胞接种于6孔板,培养24 h后,加入TNFα作用于细胞24 h,收集各孔细胞及上清液,离心弃上清液,用冷PBS洗2次,调整各孔细胞数量为1×106个,加入预冷的70%乙醇固定细胞,4℃过夜。离心收集细胞,PBS洗过后,加入含50 μg/ml PI、100 μg/ml RnaseA、0.2% Triton X-100工作液500 μl,孵育15 min后流式细胞仪检测。实验重复3次。1.7 DAPI荧光染色
爬片培养的SK-BR-3细胞,经TNFα刺激24 h后,于4%多聚甲醛固定,1% Triton X-100-PBS透化20 min,10 μg/ml DAPI染色5 min,洗去多余染液,荧光封片剂封片后,于Olympus BX53荧光显微镜下观察。1.8 统计学方法
应用SPSS16.0统计软件进行处理,所有数据以均数±标准差(x±s)表示。均数比较采用t检验或多因素方差分析(One-way ANOVA),以P<0.05为差异有统计学意义。2 结果2.1 TNFα诱导乳腺癌SK-BR-3细胞中KLF4表达
乳腺癌SK-BR-3细胞经不同浓度的TNFα(0、1、5、10、20 ng/ml)刺激24 h后,进行Western blot分析。结果显示,随着TNFα浓度的增加,乳腺癌SKBR-3细胞中KLF4表达水平呈逐渐增高趋势,见图 1。
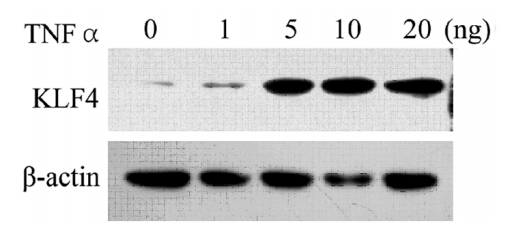 |
| 图 1 Western blot观察不同浓度的TNFα诱导乳腺癌SKBR-3细胞中KLF4表达 Figure 1 KLF4 expression in breast cancer cells SKBR-3 induced by different concentrations of TNFα for 24 h examined by Western blot |
乳腺癌SK-BR-3细胞经TNFα(0、10 ng/ml)刺激24 h后,进行流式细胞术和DAPI染色分析乳腺癌SK-BR-3细胞凋亡和周期进程。结果显示,TNFα刺激后,应用流式细胞术检测到的乳腺癌SKBR-3细胞凋亡细胞比例显著增多(Veh:4.27%;TNFα:30.19%),见图 2A。DAPI染色后,在荧光显微镜下观察结果显示,TNFα刺激后,可见乳腺癌SK-BR-3细胞呈现核固缩,见图 2B。
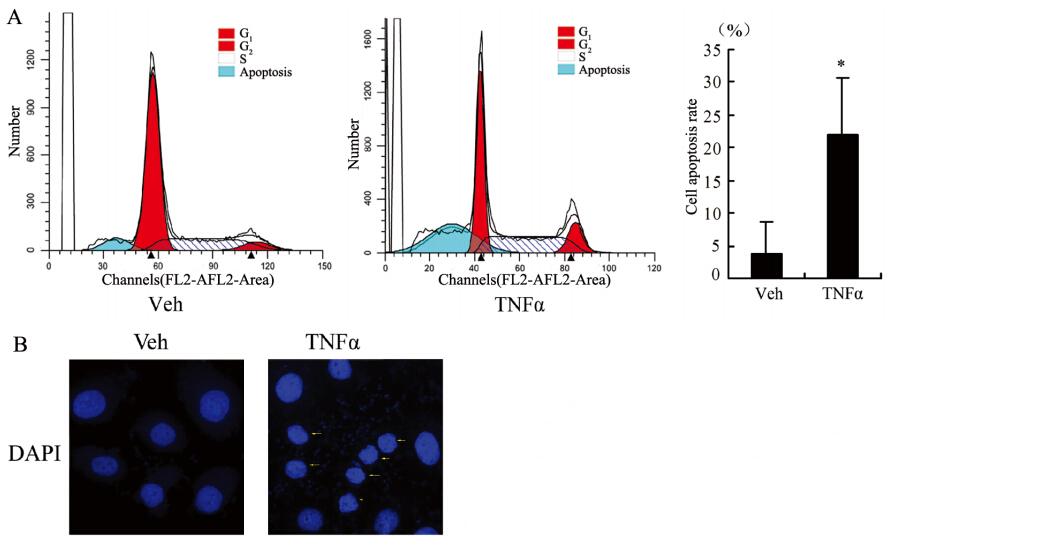 |
| A: effect of TNFα on cell apoptosis of breast cancer cells SK-BR-3 detected by flow cytometry; B: morphological change of TNFα-induced breast cancer cells SK-BR-3 detected by DAPI staining. Veh: control group; TNFα: 10 ng/ml TNFα group; *: P<0.05,compare with control group 图 2 TNFα诱导乳腺癌SK-BR-3细胞凋亡 Figure 2 TNFα-induced apoptosis of breast cancer cells SK-BR-3 detected by flow cytometry and DAPI staining |
用腺病毒载体pAd-GFP和pAd-GFP-KLF4感染乳腺癌SK-BR-3细胞48 h后,荧光显微镜下观察。通过腺病毒载体介导使GFP及GFP-KLF4在乳腺癌SK-BR-3细胞中高表达。GFP在胞质和胞核中均有分布,GFP-KLF4则主要定位在细胞核中,见图 3。
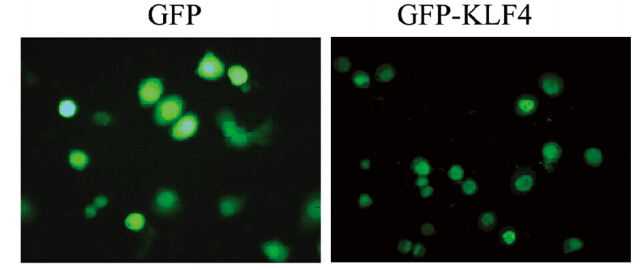 |
| 图 3 GFP和GFP-KLF4在乳腺癌SK-BR-3细胞表达 Figure 3 Expression of GFP and GFP-KLF4 in breast cancer cells SK-BR-3 |
应用腺病毒载体感染乳腺癌SK-BR-3细胞48 h使之表达KLF4后,再用10 ng/ml TNFα作用于细胞48 h,应用流式细胞术分析细胞凋亡和周期进程。如图 4所示,KLF4过表达可显著增加乳腺癌SK-BR-3细胞中凋亡细胞的比例(GFP:2.35%;GFP+TNFα:22.27%;GFP-KLF4:22.97;GFPKLF4+TNFα:36.75%)。
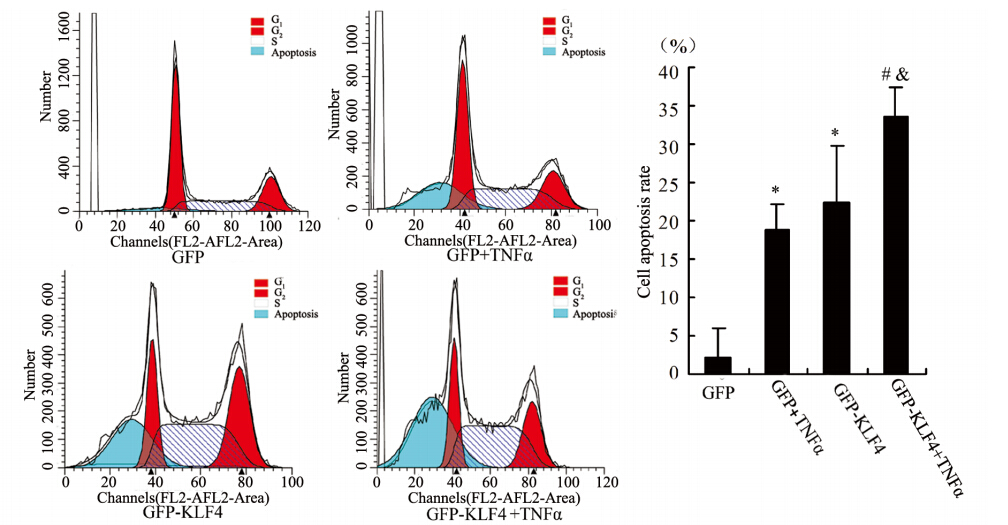 |
| *: P<0.05,compared with GFP group; #: P<0.05,compared with GFP+TNFα group; &: P<0.05,compared with GFP-KLF4 group 图 4 KLF4促进TNFα介导的SK-BR-3乳腺癌细胞凋亡 Figure 4 KLF4 promoted TNFα-induced apoptosis of breast cancer cells SK-BR-3 |
乳腺癌是女性最常见恶性肿瘤。2011年美国CA杂志公布的最新统计数据显示[11],美国2011年预计将有230 480例女性罹患乳腺癌,占女性新发恶性肿瘤的30%,排名女性恶性肿瘤发病率第一位。在我国北京、上海、天津等大城市的统计显示乳腺癌同样是我国女性最常见的恶性肿瘤,且发病率呈逐年上升趋势[12]。有统计显示乳腺癌在我国的发病率占恶性肿瘤发生率的10%左右[12]。KLF家族是一类重要的基础转录因子,在细胞生长、增殖、分化以及凋亡等多种病理生理过程中发挥调节作用[4]。KLF4是KLF家族成员之一,该基因通过作用于靶基因的转录调节区,以多种不同机制对靶基因转录过程起到抑制或活化的双重作用[13]。KLF4在肺、皮肤、睾丸、胸腺、角膜、心肌细胞以及淋巴细胞中均有表达,对人体的发育、细胞的分化以及正常组织的内稳态均有重要影响[4]。许多研究表明KLF4与多种肿瘤的发生、发展有关;在不同的肿瘤组织中,KLF4既可以作为一个癌基因也可以成为一个抑癌基因[14,15,16]。乳腺癌组织标本中KLF4的表达水平随着侵袭性程度的增加而逐渐降低,这表明KLF4在乳腺癌组织中发挥抑癌作用,但其作用机制还不是很明确。Akaogi等[15]证实,KLF4可通过转录激活雌激素受体α抑制雌激素依赖性乳腺癌生长。但也有研究显示,KLF4的核定位与乳腺癌的不良预后有关[16]。我们前期研究发现[11],KLF4在乳腺浸润性导管癌组织中表达下降,然而KLF4在乳腺癌细胞中发挥的作用及其分子机制目前尚不清楚。
TNFα能够广泛地作用于肿瘤细胞,促进细胞的凋亡。TNFα作用于乳腺癌SK-BR-3细胞后,应用Western blot法,可检测到TNFα以剂量依赖性方式诱导乳腺癌SK-BR-3细胞中KLF4表达。应用流式细胞术和DAPI染色法进行检测,发现TNFα在诱导KLF4表达的同时诱导乳腺癌细胞凋亡。那么,KLF4表达是否与乳腺癌细胞凋亡有关呢?为了进一步证实KLF4是否参与了乳腺癌细胞凋亡进程,我们构建pAd-GFP-KLF4腺病毒表达载体,并用之感染乳腺癌SK-BR-3细胞,使外源性KLF4在乳腺癌细胞中过表达。结果显示,外源性KLF4过表达的乳腺癌SK-BR-3细胞中,凋亡细胞比例明显增多;TNFα刺激后,与GFP组相比,GFP-KLF4表达组凋亡细胞比例进一步增多。以上结果表明,KLF4参与了TNFα诱导的乳腺癌SK-BR-3细胞凋亡过程。乳腺癌SK-BR-3细胞是一类HER-2过表达的乳腺癌细胞,然而HER-2与KLF4表达之间关系的尚不清楚。TNFα诱导KLF4表达调节乳腺癌SKBR-3细胞凋亡的过程中HER-2发挥着何种作用,尚有待于进一步研究。
KLF4是一个复杂的转录因子,根据内环境的不同既可以是转录激活因子也可以对转录起抑制作用,可以是癌基因也可以作为一个抑癌基因。我们的研究结果提示,在乳腺癌SK-BR-3细胞中,KLF4可通过参与TNFα诱导的细胞凋亡而抑制肿瘤细胞增殖和发展进程。KLF4是如何诱导乳腺癌细胞凋亡,其转录调控机制是什么,这些问题均值得进一步探讨。
| [1] | Scully OJ, Bay BH, Yip G, et al. Breast cancer metastasis[J]. Cancer Genomics Proteomics, 2012, 9(5): 311-20. |
| [2] | Soria G, Ofri-Shahak M, Haas I, et al. Inflammatory mediators in breast cancer: coordinated expression of TNFα & IL-1β with CCL2 & CCL5 and effects on epithelial-to-mesenchymal transition[J]. BMC Cancer, 2011, 11: 130. |
| [3] | Shi JH, Zheng B, Chen S, et al. Retinoic acid receptor α mediates all-trans-retinoic acid-induced Klf4 gene expression by regulating Klf4 promoter activity in vascular smooth muscle cells[J]. J Biol Chem, 2012, 287(14):10799-811. |
| [4] | Bieker JJ. Krüppel-like factors: three finger in many pies[J]. J Biol Chem,2001,276(37): 34355-8. |
| [5] | Nagata T. The influence of iPS-inducing factors NANOG and KLF4 in the prognosis of patients with breast cancer[J]. J Clin Oncol, 2011, 29 (suppl 27): abstr 230. |
| [6] | Ohnishi S, Ohnami S, Laub F, et al. Downregulation and growth inhibitory effect of epithelial-type Krüppel-like transcription factor KLF4, but not KLF5, in bladder cancer[J]. Biochem Biophys Res Commun, 2003, 308(2): 251-6. |
| [7] | Zhao W, Hisamuddin IM, Nandan MO, et al. Identification of Kruppel-like factor 4 as a potential tumor suppressor gene in colorectal cancer[J]. Oncogene, 2004, 23(2):395-402. |
| [8] | Tetreault MP, Wang ML, Yang Y, et al. Klf4 overexpression activates epithelial cytokines and inflammation -mediated esophageal squamous cell cancer in mice[ J] . Gastroenterology,2010, 139(6): 2124-34. |
| [9] | Wang J, Place RF, Huang V, et al. Prognostic value and function of KLF4 in prostate cancer: RNAa and vector-mediated overexpression identify KLF4 as an inhibitor of tumor cell growth and migration[J]. Cancer Res, 2010,70(24):10182-91. |
| [10] | Cui NP, Yan WT, Liu CY, et al. Expressions of KLF4 and KLF5 in breast invasive ductal carcinoma and their clinical significance[J]. Lin Chuang Zhong Liu Xue Zai Zhi,2013,18(12):1087-90.[崔乃鹏, 闫伟涛, 刘彩云, 等. KLF4和KLF5在乳腺浸润性导管癌中的表达及意义[J]. 临床肿瘤学杂志, 2013, 18(12): 1087-90.] |
| [11] | Jemal A, Bray F, Center MM, et al. Global cancer statistics[J]. CA Cancer J Clin, 2011, 61(2):69-90. |
| [12] | He J, Chen WQ. Chinese cancer registry annual report[M]. Beijing: Military Medical Science Press, 2012,14-27.[赫捷, 陈万青.2012中国肿瘤登记年报[M]. 北京: 军事医学科学出版社, 2012: 14-27.] |
| [13] | Zheng B, Han M, Wen JK. Role of Krüppel-like factor 4 in phenotypic switching and proliferation of vascular smooth muscle cells[J]. IUBMB Life, 2010, 62(2): 132-9. |
| [14] | Yu F, Li J, Chen H, et al. Krüppel-like factor 4 (KLF4) is required for maintenance of breast cancer stem cells and for cell migration and invasion [J]. Oncogene, 2011, 30(18): 2161-72. |
| [15] | Akaogi K, Nakajima Y, Ito I, et al. KLF4 suppresses estrogendependent breast cancer growth by inhibiting the transcriptional activity of ERalpha[J]. Oncogene, 2009, 28(32): 2894-902. |
| [16] | Pandya AY, Talley LI, Frost AR, et al. Nuclear localization of KLF4 is associated with an aggressive phenotype in early-stage breast cancer[J]. Clin Cancer Res, 2004, 10(8): 2709-19. |
 2014, Vol. 42
2014, Vol. 42


