文章信息
- 张万福,靳文帝,罗开元,李波,王明春,杨嵘,毛文源. 2015.
- HANG Wanfu, JIN Wendi, LUO Kaiyuan, LI Bo, WANG Mingchun, YANG Rong, MAO Wenyuan. 2015.
- 碘125粒子对乳腺癌细胞VEGF表达的抑制作用
- Iodine-125 Particles Suppress VEGF Expression in Breast Cancer Cells
- 肿瘤防治研究, 2015, 42(02): 113-116
- Cancer Research on Prevention and Treatment, 2015, 42(02): 113-116
- http://www.zlfzyj.com/CN/10.3971/j.issn.1000-8578.2015.02.003
-
文章历史
- 收稿日期:2014-05-10
- 修回日期:2014-10-16
乳腺癌严重威胁女性健康,近年来发病率逐年上升,发病年龄有年轻化的趋势。乳腺癌是全身性疾病,手术根治损伤大,降低了患者的生活质量。手术局部切除结合125I粒子组织间植入放疗增加了保乳机会[1]。但目前125I粒子抑制乳腺癌细胞生长增殖的分子生物学机制尚不十分清楚。本实验旨在通过构建裸小鼠乳腺癌细胞模型,测量植入125I粒子后肿瘤组织内血管内皮细胞生长因子(vascular endothelial growth factor,VEGF)的变化,探讨125I治疗乳腺癌的生物学机制。1 材料和方法1.1 实验材料
乳腺癌细胞株MCF-7和BALB/c-nu/nu雌性裸小鼠(48只)均由中国医学科学院肿瘤研究所提供。上海欣科医药公司提供空载粒子(0Bq)和 125I粒子(14.8MBq),美国食品药品管理局注册号为9614503,半衰期为60.1 d,厚0.8 mm,长(4.5±0.5)mm,短棒的中间活性部位约3.25 mm。125I辐射27.4~31.4 keV的X射线和35.5 keV的γ射线。粒子植入及防护设备由云南省第二人民医院125I粒子植入中心实验室提供。兔抗人单克隆VEGF抗体、SABC试剂盒购自武汉博士德生物工程有限公司。DAB显色试剂盒购自福建迈新生物技术开发公司。总RNA提取试剂盒购自北京鼎国生物试剂有限公司。反转录酶和dNTP均购自东洋纺(上海)生物科技有限公司。Taq酶购自美国Invitrogen公司。六碱基随机引物购自美国Promega公司。引物设计、合成由武汉博士德生物工程有限公司完成。VEGF上游引物:5'-AGGCAGAGAAAAGAGAAAGTGT-3',长度:22 Mer Tm值:59℃ 分子量,6 889 D。VEGF下游引物:5'-GAGAGCAAGAGAGAGCAAAAGA-3',长度:22 Mer,Tm值:61℃,分子量:6 883 D;扩增片断长度为170 bp。参照基因GAPDH(甘油醛3-磷酸脱氢酶),上游引物:5'-TTGGTATCGTGGAAGGACTCATG-3',长度:22Mer,Tm值:67℃,分子量:6 593D。下游引物: 5'-GTTGCTGTAGCCAAATTCGTTGT-3',长度:22 Mer,Tm值:67℃,分子量:6 593 D。扩增片断长度为475 bp。1.2 实验方法
人类乳腺癌细胞(MCF-7)荷瘤裸小鼠由中国医学科学院肿瘤研究所提供。荷瘤裸小鼠随机分为8组,即对照组4组:C7、C14、C21、C28;实验组4组:T7、T14、T21、T28。每组6只,共48只。对照组植入空白粒子,实验组植入125I粒子。粒子植入前做好防护工作,125I粒子放入戊二醛浸泡30 min消毒,植入部位用75%酒精消毒,18号植入针在距肿瘤边缘5 mm米处刺破皮肤,皮下潜行至肿瘤中心部位植入粒子。1.3 染色判断标准
参照Takahashi判断标准[2]:(1)染色强度计分为:0分:完全阴性;1分:弱阳性,仅少量细胞着色,染色呈淡黄色;2分:阳性,染色呈黄色;3分:强阳性,多量细胞着色,染色呈褐色或棕褐色。(2)阳性细胞计分,观察时每张切片随机选取3个高倍视野(×400)记200个细胞,计算阳性细胞占细胞总数的百分率,计分标准如下:0分:阳性细胞<10%;1分:阳性细胞10%~25%;2分:阳性细胞>25%~50%;3分:阳性细胞>50%。染色强度和阳性细胞计数积分之和为0~2分为阴性,≥ 3分为阳性。1.4 监测指标及方法
每3 d测量肿瘤最长径a、最短径b值,根据公式V=ab2/2换算出肿瘤体积[3],绘制荷瘤裸小鼠肿瘤生长曲线。植入粒子后于7、14、21、28 d处死两组荷瘤裸小鼠,称重。肿瘤抑制率(IR)=(对照组平均瘤重-实验组平均瘤重)/对照组平均瘤重×100%[3]。半定量RT-PCR、免疫组织化学染色方法检测VEGF mRNA及其蛋白的表达。1.5 统计学方法
用SPSS13.0统计软件分析,瘤体体积和瘤体重量比较用方差分析检验;免疫组织化学染色后根据标准换算出阳性和阴性片子个数,χ2检验,RT-PCR结果用随机区组方差分析。2 结果2.1 粒子植入后肿瘤生长情况
粒子植入后对照组肿瘤体积随时间增加而明显增大,而实验组肿瘤体积随时间增加体积开始变化不明显,约2周以后出现负增长。说明空白粒子对瘤体无抑制作用,而碘-125粒子能明显抑制肿瘤生长和增殖。28 d后处死裸鼠,取出肿瘤组织,分别计算对照组平均瘤重为(2.388±0.301)g,实验组平均瘤重为(1.116±0.055)g,平均抑瘤率为53.27%。2.2 免疫组织化学染色检测
VEGF在正常乳腺组织和癌组织中都有表达,但癌组织较正常组织表达明显增高。上皮和间质成分均有着色。阳性颗粒为棕色颗粒,分布于胞核、胞质及细胞基质。VEGF在对照组中表现出棕色颗粒增多,染色较深,表达较实验组明显增高,阳性细胞数明显增多。
两组植入粒子后,实验组与对照组比较,第1、2周比较差异无统计学意义(P>0.05),可以认为两组VEGF蛋白表达无差别,说明空白粒子对VEGF表达几乎没有影响。而从第3周开始出现差别,第4周差别更明显(P<0.05)。组内比较,实验组组内从第2、3周开始出现差别,第3、4周差别更明显,说明125I粒子对VEGF表达影响于粒子植入第3周比较明显。而对照组组内比较各周未见明显差别,见图 1。
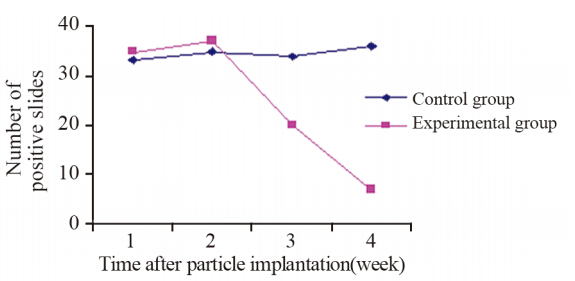 |
| 图 1 125I粒子植入对荷瘤小鼠VEGF蛋白表达的影响 Figure 1 The effect of 125I particles on VEGF protein expression in tumor-bearing mice |
(1) VEGF mRNA表达测定数据及检验:原始数据经正态性检验,差异无统计学意义(Z=0.912,P>0.05),说明数据符合正态分布。进行随机区组设计计量资料方差分析,差异有统计学意义(F=122.780,P<0.05),说明各组裸鼠瘤体内VEGF mRNA的表达总体上不同或不全相同;再进行两两比较q检验(S-N-K法)得知:对照组VEGF mRNA的相对积分灰度值位于同一栏中,两组之间差异无统计学意义(P>0.05),说明空白粒子对VEGF mRNA的表达没有影响。实验组中在125I粒子植入3周后,VEGF mRNA的表达开始降低,差异有统计学意义(P<0.05);粒子植入4周时VEGF mRNA的表达较植入3周时进一步降低,差异有统计学意义(P<0.05)。(2)实验组与对照组VEGF mRNA表达趋势:对照组各周mRNA表达灰度值差异无统计学意义。实验组mRNA表达灰度值粒子植入3周时,VEGF mRNA的表达开始降低,第4周下降更明显,见图 2,从VEGF mRNA电泳图也可看出同样的变化,见图 3。
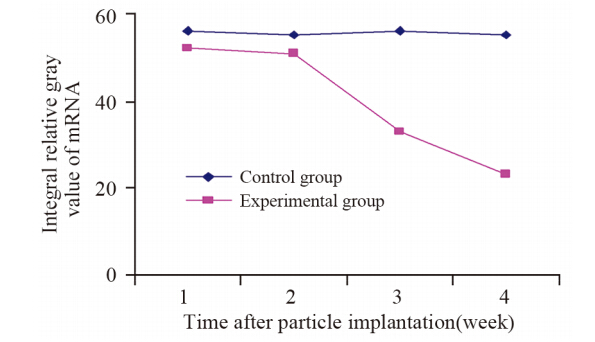 |
| 图 2 125I粒子植入对荷瘤小鼠VEGF mRNA表达的影响 Figure 2 The effect of 125I particles on VEGF mRNA expression in tumor-bearing mice |
 |
| 1:blank; 2-5: control groups; 6: marker; 7-10: experimental groups 图 3 125I粒子植入后实验组和对照组VEGF mRNA电泳图 Figure 3 Electrophoretogram of VEGF mRNA expression in experimental and control groups after 125I particles implantation |
血管新生(angiogenesis)通常指预先存在的血管通过“出芽”形成新血管,是恶性肿瘤进展和转移过程中的一个基本环节,也是新生肿瘤生长和转移的必备条件,包括血管内皮细胞的增殖、分化、细胞外基质的降解、出芽、微血管生成等多个步骤,在体内被一系列因子调节所调节,以VEGF较为重要。VEGF在癌细胞内的高表达是恶性肿瘤进展的一个重要原因[4],癌细胞分泌的VEGF在肿瘤扩增、转移、维持自身活力等方面扮演着重要角色[5,6]。已有研究[7]证实VEGF在乳腺癌细胞中高表达,多位于细胞质中。本实验免疫组织化学结果也证实上述观点。
VEGF促进血管新生的主要机制在于:(1)促进血管内皮细胞的有丝分裂[8];(2)增加血管通透性,为血管新生和癌细胞的增殖提供营养物质,也是肿瘤生长和转移的重要先决条件[9];(3)诱导内皮细胞产生胶原酶、纤溶酶原激活物和组织因子降解基底膜,内皮细胞迁入周围组织形成血管;(4)最近的研究[10]还提示:VEGF可以选择性地促进淋巴内皮细胞分裂繁殖、淋巴管增生,增强淋巴管通透性,为癌细胞扩散提供有利条件,并参与淋巴浸润和淋巴结转移。
在此次实验中,125I粒子植入3周后,实验组癌细胞中的VEGF蛋白及mRNA的表达低于对照组,差异有统计学意义;实验组内,粒子植入4周时,癌细胞VEGF蛋白及mRNA表达较植入3周时继续下降,差异有统计学意义,同时实验组瘤体体积及瘤重与前2周相比也减少,差异有统计学意义(P<0.05);粒子植入4周后,体积、重量进一步变减少。说明125I粒子组织间植入放疗能抑制VEGF mRNA及蛋白在乳腺癌中的表达,发生效应需3周,随时间的延长,抑制效应可以继续发挥作用,可能的机制如下:(1)持续性、近距离的射线照射使VEGF蛋白变性,失去生物活性;(2)干扰VEGF mRNA翻译蛋白在细胞内合成过程;(3)破坏VEGF的DNA;(4)阻碍VEGF信号分子的合成,导致细胞内的信号转导受阻。实验结果证实,125I粒子能在蛋白和基因层面抑制VEGF在乳腺癌细胞中的表达;植入3周后实验组开始起作用,4周时作用更明显。笔者认为,125I粒子抑制VEGF的表达是抑制乳腺癌细胞生长众多生物机制之一,但放射治疗恶性实体肿瘤的机制包括射线直接杀死肿瘤细胞和调节肿瘤的众多因子和通路的表达,具体哪种效应占主导地位还有待进一步探讨。
| [1] | Luo KY. Practical interstitial implant radiotherapy of malignant oncology[M]. Beijing: People’s Medical Publishing House, 2008:213-37.[罗开元.实用组织间植入放射治疗恶性肿瘤学[M]. 北京:人民卫生出版社, 2008: 213-37.] |
| [2] | Takahashi Y, Kitadai Y, Bucana CD, et al. Expression of vascular endothelial growth factor and its recepter, KDR, correlates with vascularity, metastasis,and proliferation of human colon cancer[J]. Cancer Res, 1995, 55(18): 3964-8. |
| [3] | Zhang WF, Shuai JH, Li B, et al. Inhibitory mechanism of Iodine-125 particles against the expression of nerve growth factor in breast cancer cells[J]. Zhonghua Shi Yan Wai Ke Za Zhi, 2011, 28(5): 656-8. [张万福, 帅晋豪, 李波, 等. 碘-125粒子对乳腺癌细胞神经生长因子表达的抑制作用及其机制[J]. 中华实验外科杂志, 2011, 28(5): 656-8.] |
| [4] | Campos X,Mu?oz Y,Selman A, et al. Nerve growth factor and its high-affinity receptor TrkA participate in the control of vascular endothelial growth factor expression in epithelial ovarian cancer[J]. Gynecol Oncol, 2007, 104(1): 168-75. |
| [5] | Jia YT, Li ZX, He YT, et al. Expression of vascular endothelial growth factor-C and the relationship between lymphangiogenesis and lymphatic metastasis in colorectal cancer[J]. World J Gastroenterol, 2004, 10(22): 3261-3. |
| [6] | Bellon G, Martiny L, Robinet A. Matrix metalloproteinases and matrikines in angiogenesis[J]. Crit Rev Oncol Hematol, 2004, 49(3): 203-20. |
| [7] | Zhang HJ, Zhang B, Zhang CH, et al. The expression of VEGF in breast cancer and its clinical significance[J]. Shi Yong Zhong Liu Xue Za Zhi, 2007, 21(5): 416-8. [张慧娟, 张波, 张春红, 等.乳腺癌组织中VEGF的表达及临床意义[J].实用肿瘤学杂志, 2007, 21(5): 416-8.] |
| [8] | Sasaki R. Microvessel count and vascular endothelial growth factor in renal cell carcinoma[J]. Nihon Hinyokika Gakkai Zasshi, 1996, 87(8): 1032-40. |
| [9] | Huang CY, Shen ZY. Vascular endothelial growth factor-fundamental research and experimental study in plastic surgery[J]. Zhongguo Xiu Fu Chong Jian Wai Ke Za Zhi, 2002, 16(1): 64-9.[黄晨昱, 沈祖尧. 血管内皮细胞生长因子的研究及在组织修复中的应用[J]. 中国修复重建外科杂志, 2002, 16(1): 64-9.] |
| [10] | Ren YW, Gao F. VEGF-C, Podoplanin and the generation of tumor lymphatic vessels and transfer relationship[J].Zhong Liu Jin Zhan, 2013, 11(02):155-8. [任彦武, 高峰. VEGF-C、Podoplanin与肿瘤淋巴管生成及转移关系的研究进展[J]. 肿瘤进展, 2013, 11(2): 155-8.] |
 2014, Vol. 42
2014, Vol. 42


