文章信息
- 耿霞飞,刘少平,方敏,李雁. 2015.
- GENG Xiafei, LIU Shaoping, FANG Min, LI Yan. 2015.
- 量子点分子探针双标记技术研究癌细胞克隆生长行为
- Quantum Dots-based Molecule Probe Double Immunofluorescence Techniques to Investigate Clonal Growth Behaviors of Cancer Cells
- 肿瘤防治研究, 2015, 42(02): 103-107
- Cancer Research on Prevention and Treatment, 2015, 42(02): 103-107
- http://www.zlfzyj.com/CN/10.3971/j.issn.1000-8578.2015.02.001
-
文章历史
- 收稿日期:2014-10-24
- 修回日期:2014-11-25
2.430071 武汉,武汉大学中南医院医学科学研究中心
2. Medical Research Center, Zhongnan Hospital of Wuhan University, Wuhan 430071, China
癌细胞生物学行为的一个重要特点是其增生不受控制[1],这种特点在体外细胞培养和体内肿瘤增生、侵袭、转移中都有明显的形态学表现。在癌细胞培养中,癌细胞增生首先表现为形成克隆。克隆的形成速度、形态特点等均可在一定程度上反映癌细胞的生物学行为[2,3,4]。
Ki67是一种与细胞周期相关的非组织蛋白,表达于除G0期之外的其他细胞周期所有阶段[5] ,广泛表达于乳腺癌、胃癌、结肠癌、肺癌、肝癌、淋巴瘤等多种恶性肿瘤,是检测肿瘤增殖活性的一个常用指标。量子点(quantum dots,QDs)作为一种新型的纳米荧光探针,具有以下优点[6,7,8]:激发波谱宽而连续,发射光谱窄而对称;发射光稳定、亮度强,持续时间长。量子点标记分子探针技术在研究肿瘤生长、侵袭特点方面有明显优势[9,10]。细胞克隆形成实验是用来检测癌细胞增殖能力、侵袭性、对杀伤因素敏感度等的重要技术方法[11]。本研究选用三种常见癌细胞株:乳腺癌MCF-7、胃癌SGC7901、结肠癌SW480,通过细胞克隆形成实验,以量子点探针技术检测Ki67在上述细胞克隆中的表达分布情况,体外模拟肿瘤发生发展过程,以探讨癌细胞克隆形成的细胞生物学规律。1 材料与方法1.1 试剂与细胞培养
RPMI 1640培养液、DMEM /HIGH GLUCOSE培养液、培养瓶及6孔板购自美国Hyclone公司,含0.02% EDTA的胰酶(0.25%)购自上海吉诺公司。鼠抗人pan-CK单克隆抗体(JY-0047)、兔抗人Ki67单克隆抗体(JY-0077)和量子点标记的羊抗兔IgG-605(QR605)均购自武汉珈源量子点技术开发有限公司,量子点标记的羊抗鼠IgG-525(Q11041MP)和量子点标记的羊抗兔IgG-585(Q11411MP)购自美国Invitrogen公司。不同癌细胞株MCF-7、SW480、SGC7901由武汉大学中南医院医学科学研究中心保存,以含10%胎牛血清及1%青霉素/链霉素的RPMI 1640培养液、DMEM/HIGH GLUCOSE培养液于37℃、5% CO2培养箱中培养。1.2 细胞克隆形成实验
待癌细胞长至70%~80%融合,处于对数生长期,用0.25%胰蛋白酶消化细胞,以培养液吹打制成单细胞悬液;细胞计数后,取适量细胞悬液加入6孔板(内含无菌盖破片),使每孔细胞数在500~1 000个之间,置于37℃、5% CO2培养箱中培养;每3天换液一次,直至肉眼观察到底壁上形成针尖大小白点。1.3 量子点探针标记
细胞克隆形成后,PBS洗3次,4%多聚甲醛固定10 min,2%BSA封闭,于37℃温箱孵育30 min,加鼠抗人单克隆抗体(在乳腺癌MCF-7和胃癌SGC7901细胞,稀释比为1:25;在结肠癌SW480细胞,稀释比为1:50)、兔抗人单克隆抗体(在乳腺癌MCF-7和胃癌SGC7901细胞,稀释比为1:100;在结肠癌SW480细胞,稀释比为1:250)于4℃冰箱孵育过夜,BSA封闭30 min,然后加量子点标记的羊抗鼠IgG-525(稀释比为1:100)和量子点标记的羊抗兔IgG-585(稀释比为1:200,用于乳腺癌MCF-7和结肠癌SW480)或量子点标记的羊抗兔IgG-605(稀释比为1:100,用于胃癌SGC7901)于37℃培养箱孵育2 h,PBS清洗3次,每次10 min[8,9,10]。以50%甘油缓冲液封片镜检。1.4 图片采集与分析
Olympus BX51荧光显微镜配备Olympus DP72照相机(Olympus Optical Co.,Ltd.,东京,日本)和CRi多光谱成像系统(Cambridge Research & Instrumentation,Inc.,Woburn,MA,美国),由紫外光(UV,330-385 nm)激发。采用CRi多光谱成像系统采集量子点探针标记的细胞克隆图片,并用CRi多光谱分析软件获取量子点荧光信号信息。光谱分解量化Ki67和pan-CK荧光信号,以pan-CK荧光信号计数每个克隆中的细胞数,将克隆分为小、中、大三种类型,小克隆内细胞数14~49个,中克隆内细胞数50~100个,大克隆内细胞数大于100个。以Ki67总荧光信号值与pan-CK总荧光信号值相比作为Ki67表达强度。1.5 统计学方法
使用SPSS13.0软件进行统计学分析,以中位数表示每种癌细胞与其不同大小克隆的Ki67平均表达强度,采用非参数检验比较不同大小克隆的平均表达强度,P<0.05认为差异有统计学意义。2 结果2.1 克隆形成实验
乳 腺 癌M C F - 7、 结 肠 癌S W 4 8 0和 胃 癌SGC7901细胞分别培养6、8、12天形成肉眼可见的集落,显微镜下观察,将≥50 μm的细胞团视为一个克隆[12]。乳腺癌MCF-7细胞共形成119个克隆,结肠癌SW480细胞形成123个克隆,胃癌SGC7901细胞形成120个克隆。2.1.1 克隆中细胞形态
在克隆内的乳腺癌MCF-7细胞,呈梭形、三角形、不规则形;结肠癌SW480细胞呈梭形、圆形、不规则形;胃癌SGC7901细胞呈多边形、梭形。三种细胞均具有明显异型性形态,细胞大小不一,个别体积巨大,多位于克隆中央或一侧,克隆周边细胞较小且分裂旺盛;核质比大,易见多核、多核仁等病理性核分裂相;克隆周边细胞呈多突触状向外伸展,见图 1。
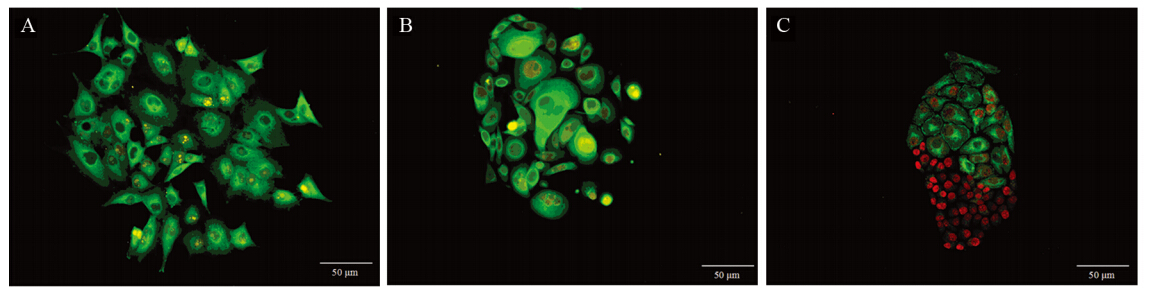 |
| A: breast cancer cell line MCF-7 (Ki67 marked by Goat anti-rabbit IgG-585 of yellow QDs);B: colorectal cancer cell line SW480 (Ki67 marked by Goat anti-rabbit IgG-585 of yellow QDs);C: gastric cancer cell line SGC7901 (Ki67 marked by Goat anti-rabbit IgG-605 of red QDs);obvious atypia among different cancer cell clones in terms of cell size,morphology and Ki67 expression in cell nucleus 图 1 癌细胞克隆的形态学特点(SP ×200) Figure 1 The morphological characteristics of cancer cell clones (SP ×200) |
部分克隆中,边缘癌细胞与克隆分离或呈分离趋势,向外形成单个或多个突触,见图 2。
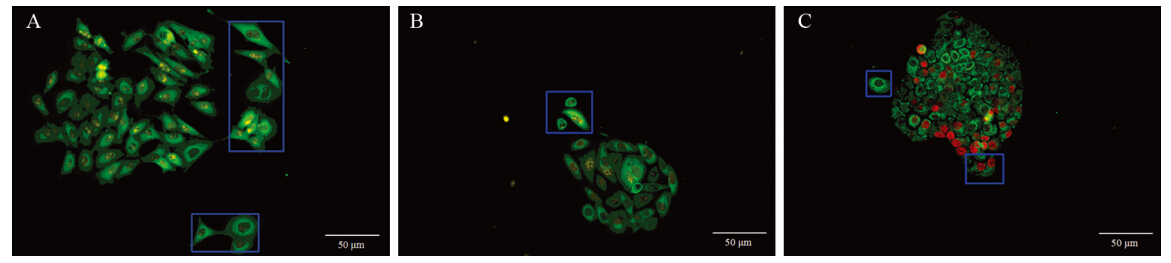 |
| A: breast cancer cell line MCF-7 (Ki67 marked by Goat anti-rabbit IgG-585 of yellow QDs);B: colorectal cancer cell line SW480(Ki67 marked by Goat anti-rabbit IgG-585 of yellow QDs);C: gastric cancer cell line SGC7901(Ki67 marked by Goat anti-rabbit IgG-605 of red QDs); the border cells of the clones were separated from the central cell aggregates or showed dispersion (blue box) 图 2 克隆细胞离散趋势(SP ×200) Figure 2 Dispersion of clone cells (SP ×200) |
采用多光谱成像软件获取图片中量子点荧光信号,黄色和红色荧光信号代表核Ki67蛋白。2.2.1 克隆内细胞Ki67表达特点
Ki67在乳腺癌MCF-7细胞内的表达呈大小不一的团块,多集中于胞核一侧,或均一满布胞核,见图 3A;在结肠癌SW480细胞,呈颗粒状或块状均匀分布于胞核,或均一满布胞核,见图 3B;在胃癌SGC7901细胞,呈大小不一的团块均匀分布于胞核,或均一满布胞核,见图 3C。
 |
| A: breast cancer cell line MCF-7 (Ki67 marked by Goat anti-rabbit IgG-585 of yellow QDs);B: colorectal cancer cell line SW480(Ki67 marked by Goat anti-rabbit IgG-585 of yellow QDs);C: gastric cancer cell line SGC7901(Ki67 marked by Goat anti-rabbit IgG-605 of red QDs); different sizes of clumps (red arrows),or even suffused in cell nucleus (blue arrows) 图 3 克隆细胞内Ki67表达特点:克隆内细胞Ki67表达呈大小不一的团块(SP ×200) Figure 3 Ki67 expression features of cancer cell clones (SP ×200) |
Ki67广泛表达于三种细胞,大部分Ki67强阳性细胞分布于克隆周边或集中于一侧,见图 4,少数散在或成团分布于克隆中间,极少数克隆内所有或大部分细胞Ki67呈强阳性。提示癌细胞在克隆内的增生呈不对称性和不同步性,在一个克隆内存在优势增生细胞。
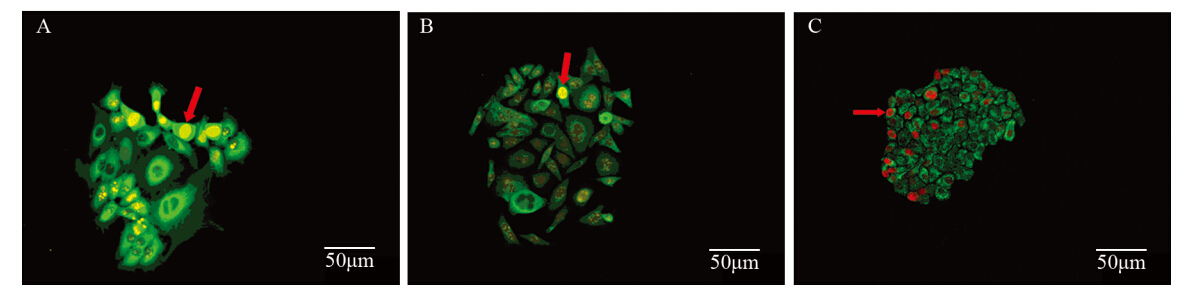 |
| A: breast cancer cell line MCF-7 (Ki67 marked by Goat anti-rabbit IgG-585 of yellow QDs);B: colorectal cancer cell line SW480(Ki67 marked by Goat anti-rabbit IgG-585 of yellow QDs);C: gastric cancer cell line SGC7901(Ki67 marked by Goat anti-rabbit IgG-605 of red QDs); the border cells of the clones showed Ki67 strong positive expression (red arrows) 图 4 克隆内Ki67强阳性细胞分布(SP ×200) Figure 4 Distribution of cells with Ki67 strong positive expression in clones (SP ×200) |
经统计学分析,乳腺癌MCF- 7细胞、结肠癌SW480细胞、胃癌SGC7901细胞的Ki67平均表达强度分别为0.433(0.036~1.833)、0.810(0.246~2.428)、0.532(0.227~0.974),见图 5 A。MCF - 7细胞小、中、大克隆Ki6 7平均表达强度分别为0.429(0.036~1.833)、0.459(0.072~1.052)、0.455(0.128~0.801),三组之间差异无统计学意义(P> 0 . 0 5),见图 5 B。S W4 8 0细胞小、中、大克隆Ki6 7平均表达强度分别为0 .8 3 6(0 .2 4 6 ~ 1 .9 3 9)、0 .7 6 4(0.301~2.428)、0.820(0.381~1.608),三组之间差异无统计学意义(P> 0 . 0 5),见图 5 C。S GC7 9 0 1细胞小、中、大克隆Ki6 7平均表达强度分别为0.440(0.268~0.974)、0.562(0.227~0.972)、0.512(0.312~0.840),小克隆组与中克隆组间差异有统计学意义(P<0.05),小克隆组与大克隆组、中克隆组与大克隆组间差异无统计学意义(P>0.05),见图 5D。
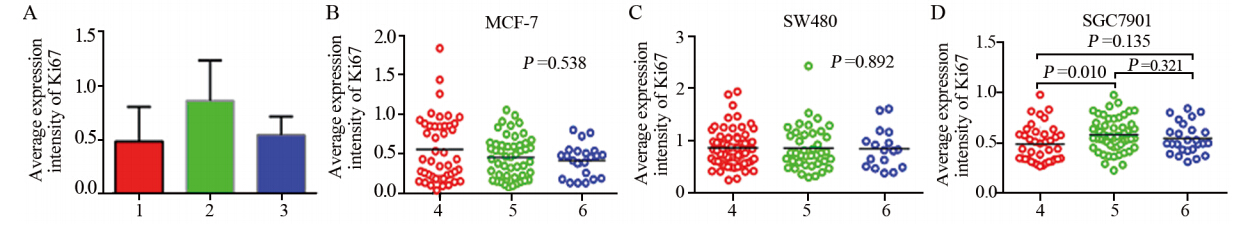 |
| 1: MCF-7; 2: SW480; 3: SGC7901; 4: Small clone; 5: Median clone;6: Large clone 图 5 Ki67在三种癌细胞中及其不同大小克隆中的平均表达强度 Figure 5 The expression intensity of Ki67 in MCF-7,SW480,SGC 7901 cells and different sizes of their clones |
克隆形成实验是研究癌细胞增殖能力、侵袭性的一种常用技术[13]。量子点是一种新型纳米荧光探针,已广泛用于肿瘤的发生发展及诊断、预后和监测研究[14,15,16]。
传统的双色荧光标记技术,往往是首先对细胞的不同成分分别标记,然后采用图像融合技术,组成一个细胞的完整图像。这种技术不能实现多个细胞成分的原位、同时、同步成像,故显示细胞图像信息的完整性和代表性均有一定误差[17,18]。与之相比,本研究采用量子点标记分子探针的原位、同步、双色成像技术,一次性原位获得癌细胞的完整形态信息和细胞核Ki67的表达分布信息;并用光谱定量技术对上述信息进行进一步定量分析,计算出克隆内癌细胞Ki67的表达量,充分展示了每个癌细胞的增生行为对整个克隆形成和发展的影响。
本研究中,Ki67在乳腺癌MCF-7细胞克隆内多数呈大小不一团块状,多集中于胞核一侧,少数均一满布胞核;在结肠癌SW480细胞克隆中,多数呈颗粒状或块状均匀分布于胞核,少数均一满布胞核;在胃癌SGC7901细胞克隆中,多数呈大小不一的团块均匀分布于胞核,少数均一满布胞核。Ki67阳性细胞与总细胞数之比作为肿瘤增殖指数[19],是一个传统的临床病理学指标。本研究中,克隆细胞Ki67总荧光信号值与pan-CK总荧光信号值之比为Ki67平均表达强度,代表癌细胞的增殖指数。克隆内MCF-7细胞、SW480细胞、SGC7901细胞的Ki67平均表达强度分别为0.433(0.036~1.833)、0.810(0.246~2.428)、0.532(0.227~0.974)。根据Scholzen等[5]的研究结论,在细胞分裂间期,Ki67表达呈团块状;在细胞分裂期,Ki67表达呈均一状分布于胞核;且越接近分裂期,Ki67团块表达越多。SW480细胞Ki67平均表达强度最高,从细胞形态学中可见,克隆内Ki67阳性细胞多处于分裂期或接近分裂期,SGC7901细胞次之,MCF-7克隆中Ki67阳性细胞则多处于分裂间期。由此表明Ki67平均表达强度可较好地反映癌细胞分裂增殖活性,可作为肿瘤细胞的增殖指数。
有研究表明,结直肠癌肿块浸润边缘表现为细胞去分化,上皮表型被间叶表型替代,利于肿瘤的侵袭和转移,其他许多肿瘤也表现出这些特点[20];乳腺癌浸润边缘细胞Ki67的过表达与骨和肝转移呈正相关[21]。本研究的三种癌细胞克隆中,大部分Ki67强阳性细胞分布于克隆周边或集中于一侧,且多数克隆周边细胞突触多、与克隆分离或呈离散趋势,由此表明克隆周边细胞增殖侵袭活性强。细胞克隆实验可较好地模拟肿瘤增殖侵袭特点,体外再现肿瘤边缘细胞增殖活性强、向外离散、侵袭转移的细胞生物学特点。
总之,本研究采用量子点分子探针双色标记技术,原位同步显示了癌细胞克隆形成过程中癌细胞的形态特征和细胞核的增殖特征,表明癌细胞增生呈不对称性和不同步性。克隆内癌细胞的异质性,再现了癌细胞的“不受控、不协调”特点,同时也提示发展“驯服”癌细胞、使之受控协调的诱导分化策略,具备理论可行性和技术可能性。
| [1] | Dowsett M, Nielsen TO, A’Hern R, et al. Assessment of Ki67 in breast cancer: recommendations from the International Ki67 in Breast Cancer working group[J]. J Natl Cancer Inst, 2011, 103(22): 1656-64. |
| [2] | Huang SD, Liu XH, Bai CG, et al. Relationship between cancer stem cells and clone formation in A549 lung cancer cell lines[J]. Zhonghua Wai Ke Za Zhi, 2006, 23(9):1053-5. [黄盛东, 刘晓红, 白辰光, 等. A549肺癌细胞株中肿瘤干细胞与克隆形成的关系[J]. 中华外科杂志, 2006, 23(9): 1053-5.] |
| [3] | Franken NA, Rodermond HM, Stap J, et al. Clonogenic assay of cells in vitro[J]. Nat Protoc, 2006, 1(5): 2315-9. |
| [4] | Munshi A, Hobbs M, Meyn RE. Clonogenic cell survival assay[J]. Methods Mol Med, 2005, 110: 21-8. |
| [5] | Scholzen T, Gerdes J. The Ki-67 protein: from the known and the unknown[J]. J Cell Physiol, 2000, 182(3): 311-22. |
| [6] | Weng KC, Nobel CO, Papahadjopolous-Sternberg B, et al. Targeted tumor cell internalization and imaging of multifunctional quantum dot-conjugated immunoposomes in vitro and in vivo[J]. Nano Lett, 2008, 8(9): 2851-7. |
| [7] | Gokarna A, Jin LH, Hwang JS, et al. Quantum dot-based protein micro- and nanarrays for detection of prostate cancer biomarkers[J]. Proteomics, 2008, 8(9): 1809-18. |
| [8] | Chen LD, Liu J, Yu XF, et al. The biocompatibility of quantum dot probes used for the targeted imaging of hepatocellular carcinoma metastasis[J]. Biomaterials, 2008, 29(31): 4170-6. |
| [9] | Chen C, Xia HS, Gong YP, et al. The quantitative detection of total HER2 load by quantum dots and the identification of a new subtype of breast cancer with different 5-year prognosis[J]. Biomaterials, 2010, 31(33): 8818-25. |
| [10] | Peng CW, Liu XL, Chen C, et al. Patterns of cancer invasion revealed by QDs-based quantitative multiplexed imaging of tumor microenvironment[J]. Biomaterials, 2011, 32(11): 2907-17. |
| [11] | Zhang Y, Yuan SL, Jiang PF, et al. Contrast research using two cultural methods for breast cancer SK-BR-3 cell cloning experiment[J]. Shandong Yi Yao, 2010, 50(51): 29-30. [张迎, 袁胜利, 姜鹏飞, 等.两种培养方法用于乳腺癌SK-BR-3细胞克隆形成实验的对比研究[J]. 山东医药, 2010, 50(51): 29-30.] |
| [12] | Li X, Pan Y, Fan R, et al. Adenovirus-delivered CIAPIN1 small interfering RNA inhibits HCC growth in vitro and in vivo[J]. Carcinogenesis, 2008, 29(8): 1587-93. |
| [13] | Plumb JA. Cell sensitivity assays: clonogenic assay[J]. Methods Mol Med, 2004, 88(5): 159-64. |
| [14] | Frangioni JV. New technologies for human cancer imaging[J]. J Clin Oncol, 2008, 26(24): 4012-21. |
| [15] | Kim J, Piao Y, Hyeon T. Multifunctional nanostructured materials for multimodal imaging, and simultaneous imaging and therapy[J]. Chem Soc Rev, 2009, 38(2): 372-90. |
| [16] | Hong H, Zhang Y, Sun J, et al. Molecular imaging and therapy of cancer with radiolabeled nanoparticles[J]. Nano Today, 2009, 4(5): 399-413. |
| [17] | Peng CW, Tian Q, Yang GF, et al. Quantum-dots based simultaneous detection of multiple biomarkers of tumor stromal features to predict clinical outcomes in gastric cancer[J]. Biomaterials, 2012, 33(23): 5742-52. |
| [18] | Resch-Genger U, Grabolle M, Cavaliere-Jaricot S, et al. Quantum dots versus organic dyes as fluorescent labels[J]. Nat Methods, 2008, 5(9): 763-75. |
| [19] | Beresford MJ, Wilson GD, Makris A. Measuring proliferation in breast cancer: practicalities and applications[J]. Breast Cancer Res, 2006, 8(6): 216. |
| [20] | Brabletz T, Jung A, Spaderna S, et al. Migrating cancer stem cellsan integrated concept of malignant tumour progression[J]. Nat Rev Cancer, 2005, 5(9): 744-749. |
| [21] | Gong P, Wang Y, Liu G, et al. New insight into Ki67 expression at the invasive front in breast cancer[J]. PLoS One, 2013, 8(1): e54912. |
 2014, Vol. 42
2014, Vol. 42


