文章信息
- 邵棋,葛乃建,杨家和.
- SHAO Qi, GE Naijian, YANG Jiahe.
- FOLFOX和FOLFOXIRI方案在结直肠癌肝转移术后患者中的应用
- FOLFOX and FOLFOXIRI Regimens on Patients with Hepatic Metastasis from Colorectal Cancer after Operation
- 肿瘤防治研究, 2015, 42(11): 1144-1147
- Cancer Research on Prevention and Treatment, 2015, 42(11): 1144-1147
- http://www.zlfzyj.com/CN/10.3971/j.issn.1000-8578.2015.11.019
-
文章历史
- 收稿日期: 2015-01-20
- 修回日期: 2015-04-29
2. 200438 上海, 第二军医大学附属东方肝胆外科医院外科
2. Department of Surgery, Eastern Hepatobiliary Surgery Hospital,The Second Military Medical University, Shanghai 200438, China
结直肠癌是消化道常见肿瘤,随着我国人民饮食结构的变化,其发病率正逐年上升。而肝脏则是结直肠癌血行转移最主要的靶器官,25%的患者在确诊时出现肝转移,另有25%患者在术后出现肝转移[1]。目前,手术仍是结直肠癌肝转移患者唯一能获得根治的治疗方式,术后辅助化疗、放疗、分子靶向治疗、介入治疗等多种综合治疗手段的联合应用也为该类患者延长生存期作出了巨大贡献,术后5年生存率可达25%~40%[2]。FOLFOXIRI作为用于晚期大肠癌的三药联合方案,虽然有效率高,但其不良反应较大,患者体力状况差,大多不能耐受该方案,远期生存并不一定具备优势,因而使该方案的应用备受争议[3]。但术后辅助化疗患者一般PS评分较高,可耐受较强的化疗。因此我们设想是否可将该方案应用于晚期肝转移灶已切除的体力状况较好的患者,进一步提高该类晚期肿瘤患者的疗效。本试验回顾性分析了60例行肠癌肝转移灶同期R0切除的患者,术后分别接受FOLFOX(folinic acid, 5-fluorouracil, oxaliplatin and irinotecan)或FOLFOXIRI(folinic acid, 5-fluorouracil and oxaliplatin)方案化疗,观察其不良反应,对患者的治疗效果及生存情况进行分析,初步探讨两种治疗方案的应用价值。
1 资料与方法 1.1 研究对象收集2008年1月至2011年7月上海东方肝胆外科医院收治的结直肠癌伴肝转移患者60例,所有患者经术前评价,肝脏转移灶为单发病灶或多发转移灶局限于肝一叶,可行原发灶和肝转移灶同期R0切除,并经术前影像学检查和术中探查,排除肝外转移灶,经术后病理证实为结直肠癌合并肝转移,且原发病灶及肝转移灶均为R0切除。所有患者均为首次确诊,术前未接受过放化疗、靶向治疗等任何抗肿瘤治疗。排除体力状况评分(ECOG performance status)>2分、年龄>75岁、严重肝肾功能不全、免疫状态低下者,排除心脑血管、糖尿病等其他严重基础疾病。根据治疗方案分为FOLFOX组和FOLFOXIRI组。所有患者签署化疗知情同意书。
1.2 治疗及随访方法60例患者均在术后3~5周开始辅助化疗,具体用药如下:FOLFOX组:奥沙利铂85 mg/m2静脉输注2 h,第1天;亚叶酸钙400 mg/m2静脉输注,第1天;5-Fu 400 mg/m2静脉推注,第1天,然后2400 mg/m2持续静脉滴注46~48 h。FOLFOXIRI组:伊立替康125 mg/m2,第1天,奥沙利铂85 mg/m2静脉输注2 h,第1天;亚叶酸钙400 mg/m2静脉输注,第1天;5-Fu 400 mg/m2静脉推注,第1天,然后2400 mg/m2持续静脉滴注46~48 h。两组方案均以14 d为一个周期,共计12周期。所有患者化疗前后检查血常规、肝、肾功能,化疗前给予止吐、抗过敏药物。化疗期间观察骨髓抑制、肝肾功能损害、消化道反应、神经毒性等3~4级不良反应。从手术获得病理后随访3年,每3~6月复查肿瘤标志物、CT等评价病情,统计3年内无病生存期及总生存期。FOLFOX组和FOLFOXIRI组分别有3例和1例患者因出现复发转移而未完成12周期化疗,其他患者均完成12周期化疗。病情进展后更换化疗方案或加用靶向药物。60例患者均完成随访,无失访病例。
1.3 统计学方法采用SPSS19.0统计软件进行数据分析,两组患者年龄等计量资料比较采用t检验,性别分布、原发灶部位、病理组织学分化程度、不良反应等计数资料比较采用χ2检验,应用Kaplan-Meier法绘制生存曲线,患者无病生存期(DFS)和总生存期(OS)运用时序检验Log rank进行统计学分析。以P <0.05为差异有统计学意义。
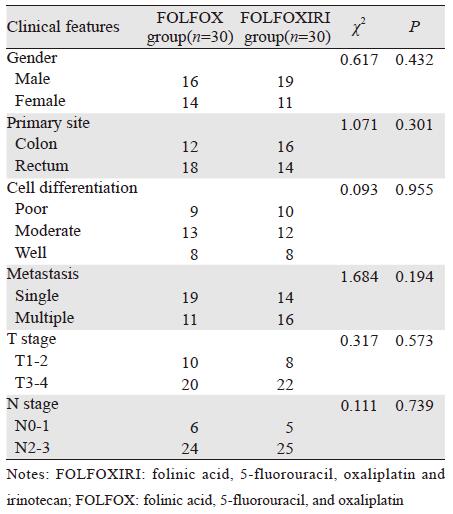
2 结果 2.1 两组患者临床特征比较共收集患者60例,FOLFOX、FOLFOXIRI组分别为30例,年龄39~75岁,中位年龄57岁。两组患者在年龄、性别分布、肿瘤原发部位、肝脏转移灶数目、病理组织学分化程度、病理分期等方面比较差异均无统计学意义(P>0.05),见表 1。
 |
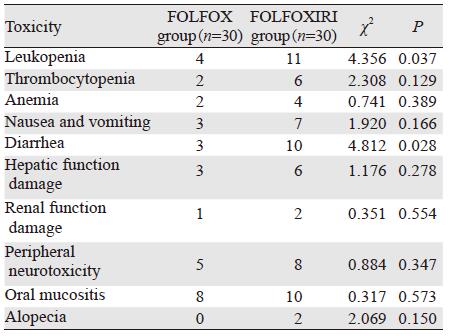
患者化疗期间出现的不良反应包括:白细胞下降、血小板减少、贫血、恶心呕吐、腹泻、神经毒性、肝肾功能损害、口腔黏膜炎、脱发等,还有个别患者出现过敏反应、心律失常,多为轻中度反应,经治疗后可以缓解。以下统计了部分3~4级不良反应,在两组患者中,仅白细胞减少及腹泻FOLFOXIRI组发生率明显高于FOLFOX组,差异有统计学意义(P=0.037, P=0.028),而其他方面差异均无统计学意义,见表 2。
 |
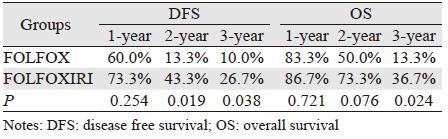
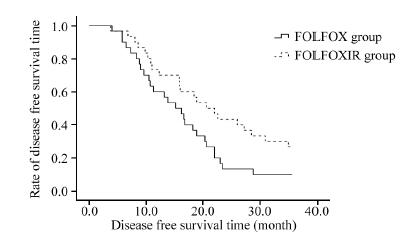
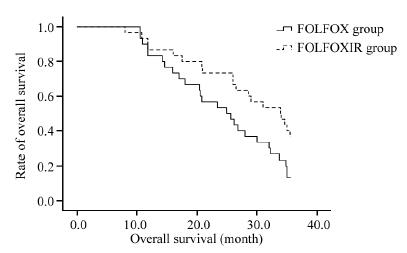
FOLFOX组和FOLFOXIRI组患者的中位无病生存时间分别15.2和20.6月,FOLFOX组患者的1、2、3年无病生存率分别为60%、13.3%、10%, FOLFOXIRI组患者的1、2、3年无病生存率分别为73.3%、43.3%、26.7%。两组患者2和3年DFS差异有统计学意义(P=0.019和P=0.038)。FOLFOX组和FOLFOXIRI组患者的中位生存时间分别24.9和33.9月,FOLFOX组患者的1、2、3年生存率分别为83.3%、50%、13.3%,FOLFOX组患者的1、2、3年生存率分别为86.7%、73.3%、36.7%。其中3年OS差异有统计学意义(P=0.024),见表 3、图 1~2。
 |
|
| 图 1 两组结直肠癌肝转移术后患者的无病生存曲线 Figure 1 DFS curves of patients with hepatic metastasis from colorectal cancer after operation in two groups |
|
| 图 2 两组结直肠癌肝转移术后患者的生存曲线 Figure 2 Survival curves of patients with hepatic metastasis from colorectal cancer after operation in two groups |
近20年来,晚期结直肠癌的治疗效果已取得显著提高,这不仅归功于肿瘤基础理论的进步、诊断和手术水平的提高,也归功于全身化疗、分子靶向治疗、介入治疗等多种综合治疗手段的联合应用[4]。肝脏作为肠癌最易转移的靶器官,以肠癌肝转移作为首诊的患者非常常见,手术切除仍是其唯一的根治性治疗机会[5]。目前包括美国国立综合癌症网络(National Comprehensive Cancer Network, NCCN)在内的国外研究均提倡只要患者能耐受麻醉,术后有足够的剩余肝脏体积,不论转移灶的大小或多少都应行原发灶和转移灶的完全(R0)切除[6]。但此类患者不能仅仅依赖手术,还要依靠术后辅助化疗来进一步的提高治愈率,减少术后复发,延长生存时间。
目前可供肠癌选择的化疗药物有奥沙利铂、伊立替康以及氟尿嘧啶类药物如5-Fu、卡培他滨、替吉奥等。通常术后辅助化疗一般采用奥沙利铂联合氟尿嘧啶类,伊立替康不被术后辅助化疗所推荐。但伊立替康作为治疗肠癌的一个重要的化疗药物,在临床已得到广泛应用,目前治疗晚期结直肠癌中不可或缺,其单药、联合氟尿嘧啶和(或)靶向药物的有效性均已得到充分证明[7]。对于三种细胞毒药物(伊立替康、奥沙利铂、氟尿嘧啶)联合应用的FOLFOXIRI方案是否能够取得更好的疗效,近年来报道不一。Souglakos等[8]研究此三联化疗无明显总体获益。Falcone等[9]报道的Ⅲ期临床结果证明,三药联合的FOLFOXIRI方案与两药联合的FOLFIRI方案相比,不仅所有患者均能耐受,而且有效率达66%,同时无进展生存期及总生存期均有延长。目前,该方案也被NCCN中国版指南推荐,但该方案尚未应用于术后辅助化疗。肠癌肝转移同期手术切除的这一特殊患者人群,原发病灶和肝脏转移病灶已行根治性切除,术后化疗是必须的治疗手段,由于该类患者术后无目标病灶,靶向药物的应用受到限制,治疗上已少了一个治疗手段,如何进一步降低此类人群的复发风险、选择合适的治疗手段、扩大获益人群,已成为当今研究的热点。该类患者虽已行根治性切除,但不能等同于行单纯肠癌根治术的患者,理论上仍应属于晚期患者,因此该类患者所行的术后辅助化疗亦不能等同于单纯行肠癌根治术后的辅助化疗。治疗方案的选择上应兼顾常规辅助化疗与晚期姑息化疗。伊立替康虽然不被单纯肠癌根治术后辅助化疗所推荐,但在晚期肿瘤的治疗中具有举足轻重的作用。鉴于本试验所选择的患者确诊时已属晚期的特殊性,基于以上临床试验得出的阳性结果以及我们的理论分析,我们试想是否可将FOLFOXIRI方案应用于肠癌肝转移同期切除术后的患者来提高疗效、延长生存。在本试验中60例患者经历了手术与术后的恢复,与其他晚期患者相比,PS评分较高,体力状态好,体内无肿瘤负荷,他们分别接受了FOLFOX和FOLFOXIRI方案,在不良反应方面,后者的骨髓抑制及腹泻发生率较高,但在多方面支持治疗下几乎所有患者都能耐受三药联合方案。在生存分析方面,后者的2年、3年DFS和3年OS均优于前者,提示FOLFOXIRI方案的远期疗效较好。但FOLFOXIRI作为一个三药联合化疗方案,虽然在部分患者中可提高疗效,但另一方面也给患者带来较大的经济成本,不但化疗本身费用较高,后续治疗不良反应的费用也随之增加。尤其是治疗化疗引起的白细胞减少及迟发性腹泻。迟发性腹泻和粒细胞减少作为该方案的主要剂量限制性毒性,与伊立替康的活性代谢产物SN-38所致的细胞毒性相关, SN-38对肠道黏膜产生损伤,引起迟发性腹泻[10, 11]。某些研究显示UGT1A1*28基因多态性与迟发性腹泻具有相关性,化疗前可对患者进行该基因的检测以避免严重腹泻的发生[12]。一旦发生腹泻应给予盐酸洛哌丁胺等止泻治疗。如发生化疗引起的粒细胞减少,可使用粒细胞集落刺激因子等对症治疗。总之,在临床应用中应充分评估,选择合适的患者,平衡其抗肿瘤疗效与可能发生的不良反应风险,做好监测和预防,尽可能避免及减少不良反应的发生。
本研究结果显示,FOLFOXIRI方案用于肠癌肝转移同期切除术后的患者是安全有效的,希望本研究能为该类患者的术后治疗提供一些依据,使患者得到最佳治疗,进一步提高治愈率。
| [1] | Siegel R, Desantis C, Jemal A. Colorectal cancer statistics, 2014[J]. CA Cancer J C1in, 2014, 64(2): 104-17. |
| [2] | Jones RP, Jackson R, Dunne DF, et al. Systematic review and meta-analysis of follow-up after hepatectomy for colorectal liver metastases[J]. Br J Surg, 2012, 99(4): 477-86. |
| [3] | Folprecht G, Hamann S, Schütte K, et al. Dose escalating study of cetuximab and 5-FU/folinic acid (FA)/oxaliplatin/irinotecan (FOLFOXIRI) in first line therapy of patients with metastatic colorectal cancer[J]. BMC Cancer, 2014, 14: 521. |
| [4] | Bibeau F, Gil H, Castan F, et al. Comment on ′Histopathologic evaluation of liver metastases from colorectal cancer in patients treated with FOLFOXIRI plus bevacizumab[J]. Br J Cancer, 2013, 109(12): 3127-29. |
| [5] | Loupakis F, Cremolini C, Masi G, et al. Initial therapy with FOLFOXIRI and bevacizumab for metastatic colorectal cancer[J]. N Engl J Med, 2014, 371(17): 1609-18. |
| [6] | Chua TC, Liauw W, Chu F, et al. Viewing metastatic colorectal cancer as a curable chronic disease[J]. Am J Clin Oncol, 2012, 35(1): 77-80. |
| [7] | Saridaki Z, Androulakis N, Vardakis N, et al. A triplet combination with irinotecan (CPT-11), oxaliplatin (LOHP), continuous infusion 5-fluorouracil and leucovorin (FOLFOXIRI) plus cetuximab as first-line treatment in KRAS wt, metastatic colorectal cancer: a pilot phase II tria[J]. Br J Cancer, 2012, 107(12): 1932-7. |
| [8] | Souglakos J, AndroulakisN, Syrigos K, et al. FOLFOXIRI (folinic acid, 5-fluorouracil, oxaliplatin and irinotecan) vs. FOLFIRI(folinic acid, 5-fluorouracil and irinotecan) as firstline treatment in metastatic colorectal cancer(MCC): a multicentre randomized phase Ⅲ trial from the Hellenic Oncology Research Group(HORG)[J]. Br J Cancer, 2006, 94(6): 798-805. |
| [9] | Falcone A, Ricci S, Brunetti I, et al. Phase Ⅲ trial of infusional fluorouracil, leucovorin, oxaliplatin, and irinotecan(FOLFOXIRI) compared with infusional fluorouracil, leucovorin, and irinotecan (FOLFIRI) as first line treatment for metastatic colorectal cancer:the Gruppo Oncologico Nord Ovest[J]. J Clin Oncol, 2007, 25(13): 1670-6. |
| [10] | Kawakami H, Satoh T, Nakagawa K. A review of FOLFOXIRI chemotherapy for the 1st line treatment of metastatic colorectal cancer[J]. Nihon Rinsho, 2011, 69(suppl 3): 439-45. |
| [11] | Montagnani F, Chiriatti A, Turrisi G, et al. A systematic review of FOLFOXIRI chemotherapy for the first-line treatment of metastatic colorectal cancer: improved efficacy at the cost of increased toxicity[J]. Colorectal Dis, 2011, 13(8): 846-52. |
| [12] | Schirripa M, Loupakis F, Pollina L, et al. Reply: Comment on 'Histopathologic evaluation of liver metastases from colorectal cancer patients treated with FOLFOXIRI plus bevacizumab[J]. Br J Cancer, 2013, 109(12): 3129-30. |
 2015, Vol. 42
2015, Vol. 42


