文章信息
- 赵明媛,高文婷,宋雅楠,王福金,王爱国,王靖宇
- ZHAO Mingyuan, GAO Wenting, SONG Ya'nan, WANG Fujin, WANG Aiguo, WANG Jingyu
- 低磁场核磁共振对小鼠原发性和移植性肿瘤的成像效果
- Imaging Effect of Low-field MRI on Primary Tumors and Transplanted Tumors in Mice
- 肿瘤防治研究, 2015, 42(11): 1100-1103
- Cancer Res Prev Treat, 2015, 42(11): 1100-1103
- http://www.zlfzyj.com/CN/10.3971/j.issn.1000-8578.2015.08.004
-
文章历史
- 收稿日期: 2014-11-14
- 修回日期: 2015-06-29
核磁共振(magnetic resonance imaging, MRI)现象于1946年被发现。随后,英国在1978年研制出第一台MRI成像仪。与CT、核素和可见光成像等其他方法相比,MRI具有无放射线损害、软组织分辨力高,低毒性以及无需使用对比剂即可显示血管结构等独特的优点,因而在临床和科研等领域中被广泛应用[1]。MRI分为高磁场MRI(>1.0T)和低磁场MRI(<0.5T)两种。高磁场MRI虽然具有成像清晰度高,时间短等优点,但存在仪器价格昂贵,对配电、通风、承重及电磁干扰等设施环境要求高[2],以及高磁场对机体的负面影响等问题[3]。为了规避高磁场MRI的缺点,低磁场MRI仪应运而生。有研究表明,低磁场MRI可以对人宫颈癌、乳腺肿块、脑出血等疾病进行良好的检测[4, 5, 6],但低磁场MRI在小型实验动物,特别是小鼠中的应用鲜有报道。本研究利用小鼠自发性和移植性肿瘤模型检测0.5 T低磁场小动物MRI的成像效果,为小鼠肿瘤的无创影像学检测提供有效的方法和借鉴。
1 材料与方法 1.1 细胞系小鼠S180肉瘤细胞系和人肝癌细胞株HepG2由大连医科大学实验动物中心提供。
1.2 实验动物H-ras12V转基因小鼠由南京大学模式动物研究所代理从韩国生命工学研究院引进(合字[2008]005号),饲养繁殖于大连医科大学SPF级实验动物中心。9月龄C57BL/6J小鼠,3月龄BALB/c小鼠,1月龄BALB/c-nu-nu裸鼠由大连医科大学SPF级实验动物中心提供。生产许可证SCXK(辽)2013-0003,实验动物使用许可证SYXK(辽)2013-0006,动物质量合格证号0003435,0003824。
1.3 主要仪器与试剂小动物核磁共振成像仪(MesoMR23-060H-I)和小动物气体麻醉仪购自纽迈科技,小动物成像仪(In-Vivo FX PRO)购自加拿大Carestream Health公司,麻醉剂异戊醇购自河北九派生物制药有限公司。
1.4 方法 1.4.1 HepG2移植肿瘤模型的建立复苏HepG2细胞系,体外培养扩增。在细胞生长旺盛状态下,胰酶消化收集细胞,血细胞计数板计数,用无菌1×PBS溶液稀释制备细胞悬液(每毫升1×106个),接种BALB/c-nu-nu裸鼠的右腋皮下(每只0.2 ml),建立HepG2移植瘤小鼠模型。
1.4.2 肉瘤S180移植瘤模型的建立从-80℃的冰箱中取出冻存的腹腔(腹水)荷S180肉瘤细胞的BALB/c小鼠,在4℃冰箱中解冻10 h。从小鼠腹腔中抽取含肉瘤S180细胞的腹水,把该腹水注入健康的3月龄BALB/c小鼠的腹腔(每只0.5 ml)中进行复苏和增殖。7 d后,选择细胞生长旺盛(腹部积水多)、健康状况良好的腹腔荷S180肉瘤细胞的小鼠,颈椎脱臼处死,洁净工作台无菌条件下抽取腹水,离心收集细胞,血细胞计数板计数后,用无菌1×PBS溶液稀释至每毫升1×107个,制备S180肉瘤细胞悬液并接种于BALB/c小鼠的背部皮下(每只0.2 ml),建立肉瘤S180移植瘤小鼠模型。
1.4.3 H-ras12V转基因小鼠肝肿瘤腋下移植瘤的建立提取小鼠尾尖组织的基因组DNA,用H-ras12V转基因特异引物(F:gtagtttaacacattatacact;R: ctagggctgcaggaattc;711 bp)进行PCR鉴定,取鉴定确认的H-ras12V转基因雄鼠,饲养至9月龄,断颈处死,采取肝肿瘤组织,放置于含10%青链霉素培养液的无菌培养皿中,去除脂肪、结缔组织,并用无血清培养液清洗2次,将肿瘤组织剪成1 mm3小块。采用无菌套管针将肿瘤块接种于BALB/c-nu-nu裸鼠的右腋皮下,建立H-ras12V转基因小鼠肝肿瘤腋下移植瘤小鼠模型。
1.4.4 核磁共振成像在核磁共振之前先对小鼠进行异戊醇气体麻醉,待小鼠麻醉后,将小鼠连通气体麻醉通气管一起放入25 mm线圈内固定。0.5T低磁场小动物核磁共振成像仪参数:25 mm 线圈;T1WI (TR 500 ms,TE 20 ms);T2WI (TR 2 000 ms,TE 60 ms);采集重复次数为4次;层厚1.7 mm;层距1 mm;层数8;视野(FOV)100 mm;采用自旋回波序列(SE)对小鼠横断面、矢状面和冠状面进行扫描。
1.4.5 肝组织样本采集及病理学诊断MRI检查后,断颈处死小鼠,对小鼠进行病理解剖观察,采取H-ras12V转基因小鼠的肝肿瘤组织和肝肿瘤周围组织,以及C57BL/6J非转基因对照小鼠的肝组织,于10%中性福尔马林缓冲液固定。依据标准方法[7]对10%福尔马林固定的小鼠肝组织进行石蜡包埋、切片和HE染色,并对HE染色的切片进行病理分析。
2 结果 2.1 皮下移植瘤小鼠的X光检测对HepG2、S180、H-ras12V转基因小鼠肝肿瘤组织的皮下移植瘤小鼠进行实体观察和X-ray成像,可见皮下移植瘤小鼠接种部位均有明显的肿瘤肿块生成,见图 1。
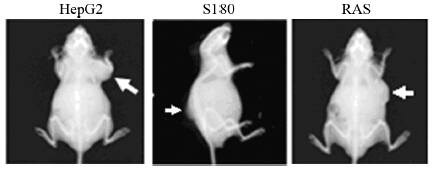
|
| HepG2: human hepatoma HepG2 cells was subaxillary inoculated into BALB/c-nu-nu mice; S180: sarcoma S180 tumor cells were dorsal subcutaneous transplanted into BALB/c mice; RAS: the liver tumor tissues from H-ras12V transgenic mice was subaxillary inoculated in BALB/c-nu-nu mice; white arrows indicated the subcutaneous tumor 图 1 皮下移植瘤小鼠的X光成像 Figure 1 X-ray imaging of subcutaneous transplanted tumor in mice |
采用0.5T小动物核磁共振仪检测HepG2、S180、H-ras12V转基因小鼠肝肿瘤组织三种皮下移植瘤小鼠。成像结果显示,皮下移植瘤部位在核磁成像的T1WI上呈低信号,T2WI上呈高信号见图 2,且三种皮下移植瘤小鼠的成像效果相似。
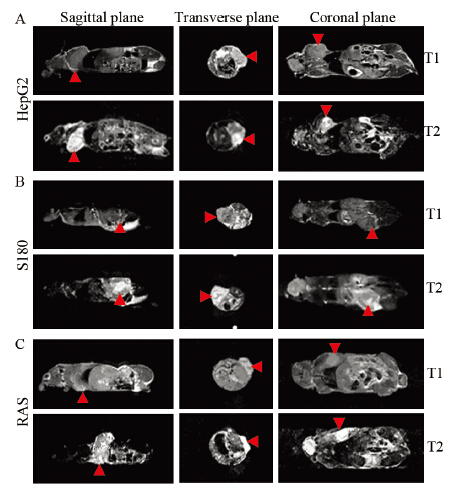
|
| A: low-field MRI in BALB/c-nu-nu mice of subaxillary inoculated human hepatoma HepG2; B: low-field MRI in BALB/c mice of dorsal subcutaneous transplanted sarcoma S180 tumor cells; C: low-field MRI in BALB/c-nu-nu mice of subaxillary inoculated the liver tumor tissues from H-ras12V transgenic mice. Red arrows indicated the subcutaneous tumor. T1: T1WI; T2: T2WI 图 2 0.5T小动物核磁共振成像仪检测皮下移植瘤小鼠 Figure 2 0.5T animal MRI of subcutaneous transplanted tumor in mice |
采用0.5T小动物核磁共振仪检测正常C57BL/6J小鼠肝组织和H-ras12V转基因小鼠肝组织。正常小鼠的肝部区域核磁成像信号均匀,见图 3A。在H-ras12V转基因小鼠的肝部区域,核磁成像的矢状面出现在T1WI上呈低信号、在T2WI上呈高信号的三个区域,直径分别为8、9、11 mm。在横断面和冠状面,肝部左半部出现在T1WI上呈低信号、在T2WI上呈高信号的一个区域,说明该转基因小鼠肝肿瘤为多发性肝肿瘤,并位于肝左叶,见图 3B。
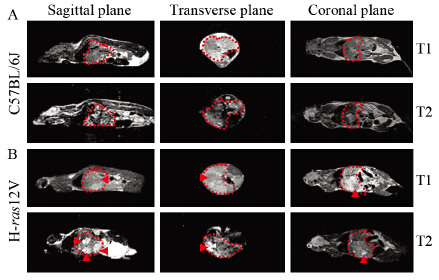
|
| A: C57BL/6J; B: H-ras12V transgenic mice; the red dashed line area indicated the mouse liver parts; the red arrow indicated liver tumor 图 3 0.5T小动物核磁共振成像仪检测正常小鼠和H-ras12V 转基因小鼠 Figure 3 0.5T animal MRI of C57BL/6J and H-ras12V transgenic mice |
对正常C57BL/6J小鼠和H-ras12V转基因小鼠进行解剖,观察肝组织的病理学变化。H-ras12V转基因小鼠的肝脏有明显的多发性肝肿瘤,肿瘤大小与核磁成像测量结果相一致,见图 4A、图 4B。病理切片显示肝肿瘤细胞呈小梁状松散生长排列,肝细胞癌变化明显。肝肿瘤细胞内有大量脂滴蓄积。肝脏肿瘤损伤相对控制较好,肿瘤周围的肝细胞被挤压成扁平状,见图 4C、4D。正常C57BL/6J小鼠的肝组织没有肉眼观和病理学病变。
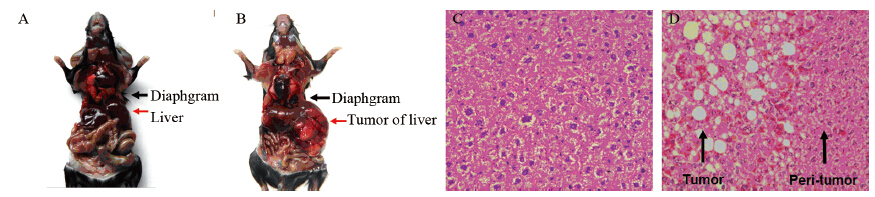
|
| A: C57BL/6J; B: H-ras12V transgenic mice; C: histopathology of C57BL/6J(HE×100); D: histopathology of the liver tumor in H-ras12V transgenic mice(HE×100) 图 4 正常C57BL/6J小鼠和H-ras12V转基因小鼠剖检和病理学诊断 Figure 4 Necropsy and histopathological analyses of C57BL/6J and H-ras12V transgenic mice |
低磁场MRI能够较为有效地检测小鼠体内原发性肿瘤的状况。虽然与高磁场MRI相比,低磁场MRI具有分辨力较弱,灵敏度较低的缺点[8],但临床研究表明,通过合理调整参数,低磁场与高磁场MRI在诊断方面差异无统计学意义[9, 10]。目前,在大型动物例如马、犬的某些病变中,利用低场核磁共振可以进行良好的检测[11, 12, 13],但在小型实验动物方面,虽有文献证明高磁场MRI可对小鼠的移植性胃癌、肾损伤等疾病进行有效的检测[14, 15],但低磁场MRI对小动物,特别是小鼠的检测效果却鲜有报道。本实验明确显示,低磁场MRI可以有效地检测小鼠原发性肝肿瘤和移植性肿瘤。加之其具有成本低、维护简单、容易安装、易于移动,对周围环境要求低等特点[9, 16],低磁场MRI将是实验室进行小动物MRI成像的良好选择。
异氟烷是实验动物低磁场MRI成像的首选麻醉剂。由于肿瘤模型小鼠的体型小、体质差,耐受麻醉的能力也差,实验中常因麻醉不当而导致小鼠死亡。本研究用水合氯醛或阿氟丁试剂麻醉小鼠的实验结果表明,小鼠的死亡率很高。虽然利用盐酸氯胺酮和速眠新Ⅱ混合液肌肉注射麻醉小鼠可取得较好的麻醉效果,但其麻醉持续时间短(20~30 min)[17],不适合用长时间[9]的低磁场MRI成像。异氟烷具有苏醒快、不良反应小等优点[18],是临床应用的主要麻醉剂[19]。本研究采用异氟烷麻醉的方法,大大降低了小鼠的死亡率。可见,在长时间的低磁场MRI成像实验中,异氟烷麻醉法是首选的麻醉方法。
综上所述,低磁场MRI对小鼠自发性肿瘤和移植性肿瘤可以进行较为有效的检测,是一种较好的小动物肿瘤无创检测方法。
| [1] | Li DM, Wang CL, Li JC. Development of small living animal imaging technology[J]. Zhongguo Sheng Wu Yi Xue Gong Cheng Xue Bao, 2009, 28(6): 916-21. [李冬梅, 万春丽, 李继承. 小动物活体成像技术研究进展[J]. 中国生物医学工程学报, 2009, 28(6): 916-21.] |
| [2] | Sun JJ, He XB, Bu YS. Research on the layout and construction preparation for 3.0T high-field nuclear magnetic resonance equipment room[J]. Zhongguo Yi Xue Zhuang Bei, 2013, 10(10): 53-5. [孙继江, 何晓彬, 步岩生. 3.0T高场强核磁共振设备机房布局及施工准备[J].中国医学装备, 2013, 10(10): 53-5.] |
| [3] | Wang HT, Zhao HZ, Fu YF, et al. The low field mri diagnosis of brain arteriovenous fistula, and the evaluation of the difference between high and low field nuclear magnetic resonance (NMR)[J]. Zhongguo Zhong Yi Yao Xian Dai Yuan Cheng Jiao Yu, 2012, 10(9): 105, 110. [王海涛, 赵汉卓, 付云峰, 等. 脑动静脉畸形的低场磁共振诊断及高低场核磁共振的区别评价[J].中国中医药现代远程教育, 2012, 10(9): 105, 110.] |
| [4] | Cao Y, Liu MY, Liu B, et al. The value of low-field MRI in the diagnosis and staging of cervial cancer[J]. Yi Xue Zong Shu, 2012, 18(15): 2507-8. [曹阳, 刘茂华, 柳彬. 低场MRI在宫颈癌诊断及分期中的应用价值[J].医学综述, 2012, 18(15): 2507-8.] |
| [5] | Song GJ, Zheng LY, Yang HY. The diagnostic analysis of 40 of low field MRI in breast tumors[J]. Zhongguo Wu Zhen Xue Za Zhi, 2011, 11(28): 6962-3. [宋国军, 郑来煜, 杨海燕. 低场MRI在乳腺肿块诊断中的应用40例分析[J].中国误诊学杂志, 2011, 11(28): 6962-3.] |
| [6] | Fu DY, Wang CD, Li SK, et al. Clinical study of low-field magnetic resonance imaging in diagnosis of early cerebral hemorrhage[J]. Zhongguo Yi Yao Ke Xue, 2013, 3(7): 127-9, 140. [符大勇, 王长德, 李士坤, 等. 低场核磁共振诊断早期脑出血的临床研究[J]. 中国医药科学, 2013, 3(7): 127-9, 140.] |
| [7] | Hosui A, Kimura A, Yamaji D, et al. Loss of STAT5 causes liver fibrosis and cancer development through increased TGF-{beta} and STAT3 activation[J]. J Exp Med, 2009, 206(4): 819-31. |
| [8] | Zhang G. High field MRI system of knee joint imaging technology and clinical application[J]. Heilongjiang Yi Yao Ke Xue, 2013, 36(1): 106. [张刚. 高场核磁共振系统膝关节成像技术及临床应用[J].黑龙江医药科学, 2013, 36(1): 106.] |
| [9] | Lee RK, Griffith JF, Lau YY, et al. Diagnostic capability of low- versus high-field magnetic resonance imaging for lumbar degenerative disease[J]. Spine (Phila Pa 1976), 2015, 40(6): 382-91. |
| [10] | Huang LG. Clinical analysis of lowfield magnetic resonance imaging in diagnosis of early cerebral hemorrhag[J]. Zhong Wai Jian Kang Wen Zhai, 2013, 10(36): 155-6. [黄龙国. 低场核磁共振诊断早期脑出血的临床分析[J]. 中外健康文摘, 2013, 10(36): 155-6.] |
| [11] | Santos MP, Gutierrez-Nibeyro SD, McKnight AL, et al. Gross and his topathologic correlation of low-field magnetic resonance imaging findings in the stifle of asymptomatic horses[J]. Vet Radiol Ultrasound, 2015, 56(4):407-16. |
| [12] | Ley CJ, Björnsdóttir S, Ekman S, et al. Detection of early osteoarthritis in the centrodistal joints of Icelandic horses: Evaluation of radiography and low-field magnetic resonance imaging[J]. Equine Vet J, 2014, [Epub ahead of print]. |
| [13] | Tamura S, Doi S, Tamura Y, et al. Thoracolumbar intradural disc herniation in eight dogs: clinical, low-field magnetic resonance imaging, and computed tomographic myelography findings[J]. Vet Radiol Ultrasound, 2015, 56(2): 160-7. |
| [14] | Sun J, Zhang XP, Li XT, et al. Applicable apparent diffusion coefficient of an orthotopic mouse model of gastric cancer by improved clinical MRI diffusion weighted imaging[J]. Sci Rep, 2014, 4: 6072. |
| [15] | Wang F, Jiang R, Takahashi K, et al. Longitudinal assessment of mouse renal injury using high-resolution anatomic and magnetization transfer MR imaging[J]. Magn Reson Imaging, 2014, 32(9): 1125-32. |
| [16] | Xue JT, Zhu P, Zhao XF. Basic hospital application of low field magnetic resonance significance[J]. Xin Li Yi Sheng, 2010, 2010(7): 29-30. [薛江涛, 朱萍, 赵序芳. 基层医院运用低场强磁共振的意义[J]. 心理医生, 2010, 2010(7): 29-30.] |
| [17] | Jiang HF, Ren J, Cui Y, et al. Establishment of an orlhotropic tumor model for hepatocellular carcinoma and non-invasive in vivo tumor imaging by MRI in mice[J]. Xian Dai Zhong Liu Yi Xue, 2007, 15(2): 174-6. [姜晗昉, 任军, 崔勇, 等. 小鼠原位移植性肝癌模型的建立及其磁共振表现[J].现代肿瘤医学, 2007, 15(2): 174-6.] |
| [18] | Wang YF. Hepatocellular carcinoma in elderly patients with propofol and isoflurane anesthesia comparison[J]. Zhongguo Lao Nian Xue Za Zhi, 2012, 32(10): 2151-2. [王允飞. 老年肝癌患者应用丙泊酚和异氟烷麻醉对比[J].中国老年学杂志, 2012, 32(10): 2151-2.] |
| [19] | Liu T, Zhang RM. Isoflurane inhalation anesthesia combining with propofol intravenous anesthesia for laparoscopic hysterectomy effect[J]. Zhongguo Lao Nian Xue Za Zhi, 2013, 33(19): 4737-9. [刘涛, 张荣明. 异氟烷吸入麻醉复合丙泊酚静脉麻醉用于腹腔镜子宫切除术的效果[J].中国老年学杂志, 2013, 33(19): 4737-9.] |
 2015, Vol. 42
2015, Vol. 42


