文章信息
- 张田,贾永森,孙月明,彭海兵,秦丽娟,王银环.
- ZHANG Tian, JIA Yongsen, SUN Yueming, PENG Haibing, QIN Lijuan, WANG Yinhuan.
- 热疗降低胶质瘤侵袭性及与HSP70和iNOS表达的关系
- Effect of HSP70 and iNOS in Process of Hyperthermia Reducing Glioma Invasion
- 肿瘤防治研究, 2015, 42(11): 1063-1066
- Cancer Research on Prevention and Treatment, 2015, 42(11): 1063-1066
- http://www.zlfzyj.com/CN/10.3971/j.issn.1000-8578.2015.11.001
-
文章历史
- 收稿日期: 2014-11-14
- 修回日期: 2015-03-13
2. 063000 唐山,华北理工大学中医学院;
3. 063000 唐山,华北理工大学冀唐学院
2. College of Traditional Chinese Medicine, North China University of Science and Technology, Tangshan 063000, China;
3. Jitang College of North China University of Science and Technology, Tangshan 063000, China
本基础医学院实验室前期研究发现,热疗可以降低胶质瘤的侵袭性,但其确切机制尚待进一步探讨[1, 2, 3, 4]。有研究表明,大多数组织经诱导后均可使一氧化氮合酶(induced nitric oxide synthase, iNOS)表达增加,进而生成一氧化氮(nitric oxide, NO)。NO作为一种生物活性分子,与多种肿瘤的发生、发展密切相关[5]。NO产生后能迅速与细胞内的超氧阴离子反应,生成具有强抗氧活性的过氧亚硝基,对细胞产生不良反应。有关NO与胶质瘤侵袭性的关系,目前国内外尚未见报道。本研究拟探讨热疗与HSP70及iNOS表达的关系,从而进一步明确热疗降低胶质瘤侵袭性的机制。
1 材料与方法 1.1 材料细胞株、胎牛血清和F-12培养液(北京协和细胞资源中心);12.0 μm孔径的Transwell(美国Millipore公司);HSP70 ELISA试剂盒(酶联上海生物科技有限公司); iNOS抗体(Santa Cruz公司);一氧化氮检测分析试剂盒(BioVision 公司)。
1.2 C6胶质瘤细胞培养用含有2.5%胎牛血清和15%马血清的F-12培养液培养C6细胞,37℃培养箱内孵育,并通以5%的CO2。
1.3 体外肿瘤侵袭模型的构建及结晶紫染色法检测胶质瘤侵袭性的改变将C6胶质瘤细胞接种于Transwell膜上室,培养24 h后,将实验组的Transwell膜置于42℃培养箱内,实验组分为热疗10 min组、30 min组、60 min组、120 min组、180 min组和240 min组(每组15例)。热疗后再继续培养120 min,用棉签擦去基质胶和上室细胞,用结晶紫染色法测定膜下室面贴壁细胞数来反映肿瘤侵袭性。对照组为37℃培养箱内培养(15例)。
1.4 酶联免疫吸附法检测HSP70的抗体滴度具体操作按试剂盒说明书进行,结果以ng/L表示。
1.5 Western blot法动态检测iNOS的表达水平于热疗后的不同时间点收集各组C6胶质瘤细胞,采用Western blot法检测胶质瘤细胞内iNOS的活性。采用增强化学发光Western blot检测试剂盒检测,膜用X光片曝光。对照组用PBS代替一抗。结果以蛋白表达强度表示,并通过分析各条带IDV值来分析各组蛋白表达的变化。
1.6 Griess 法测定NO含量NO含量的测定采用Griess法[6],细胞匀浆在Griess反应液中室温孵育10 min,于543 nm处测定OD值,以KHCO3作标准曲线计算NO含量。
1.7 统计学方法采用SPSS11.0软件进行统计学分析,HSP70抗体滴度、iNOS的蛋白表达水平、NO含量以及胶质瘤细胞数均以均数±标准差(x± s)表示。两样本均数间比较采用配对t检验。P<0.05为差异有统计学意义。
2 结果 2.1 热疗对胶质瘤侵袭性的影响热疗后,侵入Transwell下室的细胞数量减少,提示热疗可降低胶质瘤细胞侵袭性,并且于热疗后120 min时降到最低(P=0.0086),见图 1。
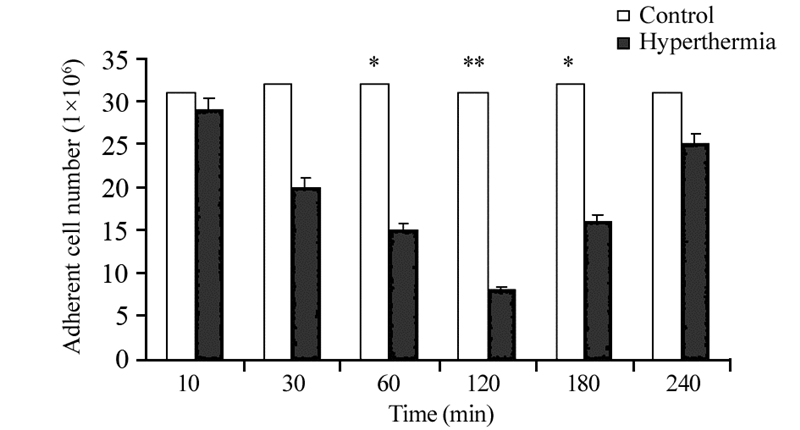
|
| *: P all=0.029, **: P=0.0086, compared with control group 图 1 热处理后的膜下室面贴壁细胞数(n=15, x± s) Figure 1 Adherent cell number on membrane downside after heat treatment (n=15, x± s) |
C6细胞内HSP70的含量于热疗30 min时达高峰(P=0.0079),其后随时间推移而减少,见图 2。
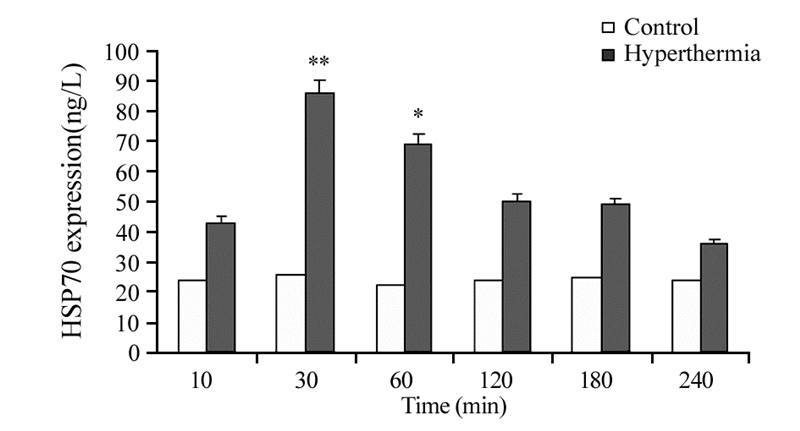
|
| *: P=0.045, **: P=0.0079, compared with control group 图 2 热疗对C6胶质瘤细胞内HSP70表达水平的影响 (n=15, x± s) Figure 2 Expression of HSP70 in C6 cells after hyperthermia (HT) (n=15, x± s) |
细胞经热疗后,iNOS的表达水平于60 min时达高峰(P=0.0064),其后随时间推移而减少,见图 3。
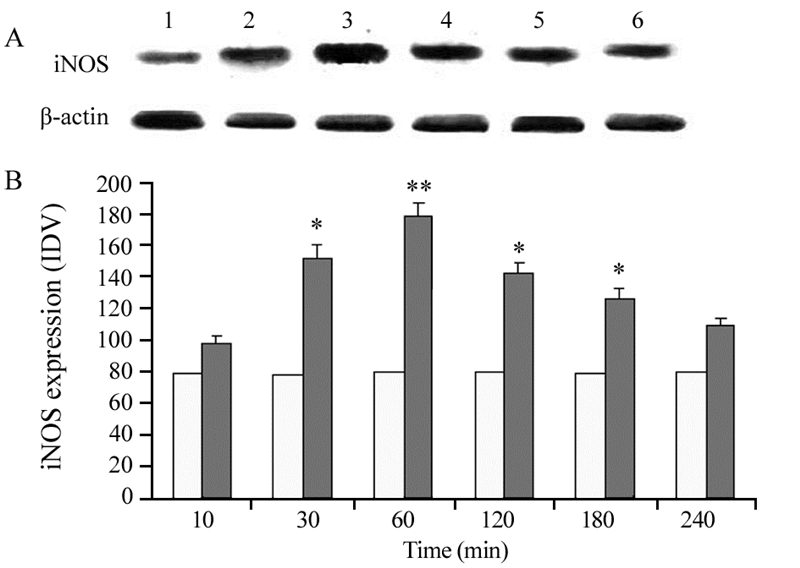
|
| 1: 10min; 2: 30min; 3: 60min; 4: 120min; 5: 180min; 6: 240min; A: the differences of iNOS expression detected by Western blot; B: proportional column diagram; *: P=0.037(30min), 0.041(120min), 0.045(180min); **: P=0.064, compared with control group; IDV: in tegrated density value 图 3 热疗对C6胶质瘤细胞内iNOS表达水平的影响 (n=15) Figure 3 Expression of iNOS in C6 cells after hyperthermia (n=15) |
热疗120 min时NO含量最多(P=0.0041),其后随时间推移而减少,见图 4。
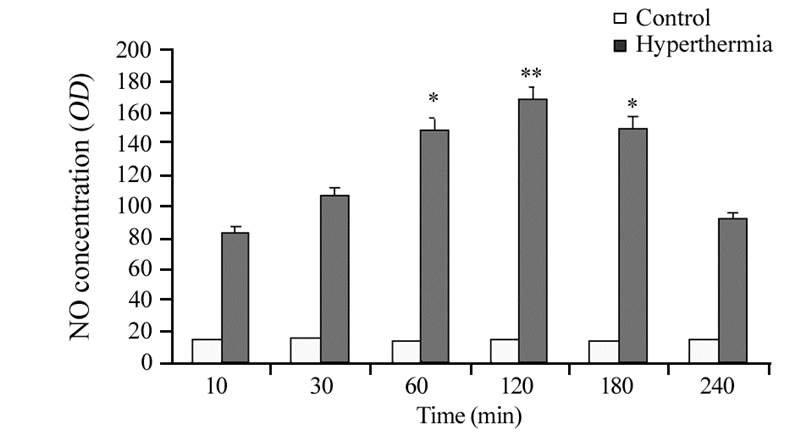
|
| *: P=0.021, **: P=0.0041, compared with control group 图 4 热疗对C6胶质瘤细胞内NO含量的影响(n=15, x± s) Figure 4 Concentration of NO in C6 cells after hyperthermia (n=15, x± s) |
神经胶质瘤是临床常见的中枢神经系统恶性肿瘤[7]。由于其生长迅速并且具有高侵袭性,因此进行胶质瘤手术治疗之前就已经有肉眼看不见的胶质瘤迁移到远离原发灶的部位。这些残留的胶质瘤细胞很快又会增殖并在新的部位形成新的胶质瘤团块。因此,如何抑制胶质瘤的增殖和侵袭性生长是胶质瘤术后更重要的治疗靶标。
放射治疗、化学治疗等是胶质瘤术后最常用的辅助治疗方法[8, 9, 10]。但这些治疗方法本身带来的不良反应大,加之已经经历过胶质瘤手术的患者本身体质已很虚弱,对这些辅助治疗的耐受性大大降低,同时由于脑组织本身又存在血脑屏障和血肿瘤屏障,化疗药物能够到达胶质瘤的数量有限,因此,这些治疗措施在临床实际中并不能很好的遏制和清除残留的胶质瘤细胞。
热疗是近年来新兴的一种肿瘤治疗方法,由于其不良反应小,已经被越来越多的临床工作者所重视[11, 12, 13, 14]。也有研究发现热疗可以降低胶质瘤的侵袭性,但其更确切的作用机制尚不甚明了。
自由基是近年来广受关注的一种与机体健康和疾病均关系密切的物质。体内比较重要的自由基有超氧阴离子自由基(·O2)、羟自由基(·OH)、羧自由基(ROO·)、脂氧自由基、一氧化氮自由基(NO·)、硝基自由基(·ONOO-)等[15]。通常情况下,凡能促进活性氧产生的因子,都能加剧损伤;凡能抑制活性氧产生的因子都能缓解损伤。
热处理本身可以促进一种分子伴侣蛋白HSP70的产生,HSP70可通过发挥其分子伴侣作用而促进很多蛋白质的合成和修复[16]。iNOS作为一种NO合成酶,其本质也是一种蛋白质,因此热处理也会引起iNOS的产生增加,进而促进NO的合成。由此我们设想,热疗是否可以通过HSP70促进iNOS的合成进而促进NO的合成呢?而这种活性氧NO的产生是否会导致胶质瘤的损伤而降低胶质瘤的侵袭性呢?
为此,我们制备了胶质瘤体外侵袭模型。经研究发现,热疗后胶质瘤的侵袭性下降,并于热疗120 min时达高峰。通过检测热疗后胶质瘤细胞的HSP70和iNOS蛋白质表达水平以及NO含量发现,热疗30 min时胶质瘤细胞内HSP70的表达达到高峰,热疗60 min时胶质瘤细胞内iNOS的表达达到高峰,而热疗120 min时胶质瘤细胞内NO的含量最多。即NO含量愈多,胶质瘤侵袭性越低,二者在时间上呈负相关。由此我们推测,胶质瘤细胞经热疗后,首先引起细胞内HSP70的表达增多,增多的HSP70可能通过发挥其分子伴侣作用修复损伤受损的iNOS或促进iNOS的合成,进而产生更多的自由基NO,最终造成胶质瘤细胞受损而降低了胶质瘤的侵袭性。
已有文献报道,内毒素脂多糖(lipopolysacc haride, LPS)可诱导星形胶质细胞HSP的表达[17],且LPS可在转录水平上诱导雪旺氏细胞iNOS mRNA的表达,促进NO的合成[18]。因此我们推测,在此过程中LPS可能参与了HSP调控iNOS表达的过程。
有关热疗降低胶质瘤侵袭性的机制可能还与其他自由基或自由基清除物有关,这些尚待进一步研究。另外,本研究结果仅限于体外实验,在体热疗时的效果及其机制与体外实验是否会有不同,这也是我们今后需要进一步研究的内容。
| [1] | Qin LJ, Wang DC, ZHANG T, et al. Relation between hyperthermia reduce glioma invasiveness and changes of TNF-α and Cx-43[J]. Shen Jing Jie Pou Xue Za Zhi, 2012, 28(3): 268-72. [秦丽娟, 王东春, 张田, 等. 热疗降低胶质瘤侵袭性的作用与TNF-α和Cx-43的关系[J]. 神经解剖学杂志, 2012, 28(3): 268-72. |
| [2] | Qin LJ, Wang DC, Zhang T, et al. Study of relation between hyperthermia reduce glioma invasiveness and TNFR affinity[J].Zhong Liu Fang Zhi Yan Jiu, 2012, 39(4): 367-70. [秦丽娟, 王东春, 张田, 等. 热疗降低胶质瘤侵袭性的作用与肿瘤坏死因子受体亲和力的关系[J]. 肿瘤防治研究, 2012, 39(4): 367-70. |
| [3] | Wang J, Jia YS, Zhao XQ, et al. Change of caspase 8 in the process of hyperthermia reducing glioma invasiveness[J]. Shen Jing Jie Pou Xue Za Zhi, 2014, 30(2): 197-200. [王健, 贾永森, 赵喜庆, 等. 热疗降低胶质瘤侵袭性作用过程中caspase 8改变的实验研究[J]. 神经解剖学杂志, 2014, 30(2): 197-200. |
| [4] | Wang J, Zhang T, Jia YS, et al. Effect of hyperthermia on invasion of glioma cells and its relationship with expression of 2’, 3’-cyclic nucleotide 3’-hosphodiesterase[J]. Ji Lin Da Xue Xue Bao(Yi Xue Ban), 2014, 40(2): 248-52. 王健, 张田, 贾永森, 等. 热疗对2’, 3’-环核苷酸3’磷酸二酯酶表达和C6胶质瘤细胞侵袭性的影响[J].吉林大学学报(医学版), 2014, 40(2): 248-52. |
| [5] | Guo X, Chen LW, Liu WL, et al. High glucose inhibits expression of inducible and constitutive nitric oxide synthase in bovine aoritie endothelial cells[J]. Acta Pharmacol Sin, 2000, 21(4): 325-8. |
| [6] | Rossi F, Bianchini E. Synergistic induction of nitric oxide by beta-amyloid and cytokines in astrocytes[J]. Biochem Biophys Res Commun, 1996, 225(2): 474-8. |
| [7] | Fiano V, Trevisan M, Trevisan E, et al. MGMT promoter methylation in plasma of glioma patients receiving temozolomide[J]. J Neurooncol, 2014, 17(2): 347-57. |
| [8] | Jiang H, Wang C, Guo Z, et al. Silver nanocrystals mediated combination therapy of radiation with magnetic hyperthermia on glioma cells[J]. J Nanosci Nanotechnol, 2012, 12(11): 8276-81. |
| [9] | Sahebjam S, Garoufalis E, Guiot MC, et al. Bevacizumab use for recurrent high-grade glioma at McGill University Hospital[J]. Can J Neurol Sci, 2013, 40(2): 241-6. |
| [10] | Dahlrot RH, Hermansen SK, Hansen S, et al. What is the clinical value of cancer stem cell markers in gliomas[J]. Int J Clin Exp Pathol, 2013, 6(3): 334-48. |
| [11] | Hoope K, Schleip R, Lehmann-Horn F, et al. Contractile elements in muscular fascial tissue-implications for in-vitro contracture testing for malignant hyperthermia[J]. Anaesthesia, 2014, 69(9): 1002-8. |
| [12] | Franke K, Kettering M, Lange K, et al. The exposure of cancer cells to hyperthermia, iron oxide nanoparticles, and mitomycin C influences membrane multidrug resistance protein expression levels[J]. Int J Nanomedicine, 2013, 8: 351-63. |
| [13] | Takeda T, Kobayashi S, Kobayashi. Immunotherapy with hyperthermia for advanced or recurrent breast cancer patients in whom standard therapy showed no effect or was refused[J]. Gan To Kagaku Ryoho, 2012, 39(12): 1766-9. |
| [14] | Tschoep-Lechner KE, Milani V, Berger F, et al. Gemcitabine and cisplatin combined with regional hyperthermia as second-line treatment in patients with gemcitabine-refractory advanced pancreatic cancer[J]. Int J Hyperthermia, 2013, 29(1): 8-16. |
| [15] | Cheeseman KH, Slater F. An introduction to free radical biochemistry[J]. Br Med Bull, 1993, 49(3): 481-93. |
| [16] | Gupta A, Cooper ZA, Tulapurkar ME, et al. Toll-like receptor agonists and febrile range hyperthermia synergize to induce heat shock protein 70 expression and extracellular release[J]. J Biol Chem, 2013, 288(4): 2756-66. |
| [17] | Wang P, Shen AG. Effect of LPS on HSPA12B expression in rat astrocyte[J]. Zhongguo Mian Yi Xue Za Zhi, 2013, 29(10): 1033-6, 1041. [王萍, 沈爱国. LPS对大鼠星形胶质细胞HSPA12B表达的影响[J]. 中国免疫学杂志, 2013, 29(10): 1033-6, 1041. |
| [18] | Wang HB, Qin YW, Cheng C, et al. Effect of LPS on inducible nitric oxide synthase in rat Schwann cells[J]. Zhongguo Mian Yi Xue Za Zhi, 2007, 23(9): 815-8. [王海波, 秦永伟, 程纯, 等. LPS对大鼠雪旺氏细胞iNOS表达的影响[J]. 中国免疫学杂志, 2007, 23(9): 815-8. |
 2015, Vol. 42
2015, Vol. 42


