文章信息
- 汪康宁, 邱明宁, 柳建军, 陈合格.
- WANG Kangning, QIU Mingning, LIU Jianjun, CHEN Hege.
- MicroRNA-135在肿瘤中的研究进展
- Progresses of MicroRNA-135 in Tumors
- 肿瘤防治研究, 2015, 42(10): 1031-1036
- Cancer Research on Prevention and Treatment, 2015, 42(10): 1031-1036
- http://www.zlfzyj.com/CN/10.3971/j.issn.1000-8578.2015.10.018
-
文章历史
- 收稿日期: 2014-11-17
- 修回日期: 2015-02-17
肿瘤的发生发展涉及多种机制,包括遗传学与表观遗传学的改变[1]。miRNA可参与肿瘤相关基因转录后的水平调控,从而影响肿瘤细胞的增殖、凋亡及分化等生理过程[2]。同时,miRNA的表达具有组织特异性,在不同的组织中,miRNA可发挥抑癌或促癌的双重作用,以原癌基因为靶标的miRNA具有抑癌作用,以抑癌基因为靶标的miRNA具有促癌作用。其中具有促癌作用的miRNA被称为癌基因miRNA,其可通过与抑癌基因mRNA的3′-非编码区的配对,干扰靶基因mRNA降解或翻译,从而促进肿瘤的生长。
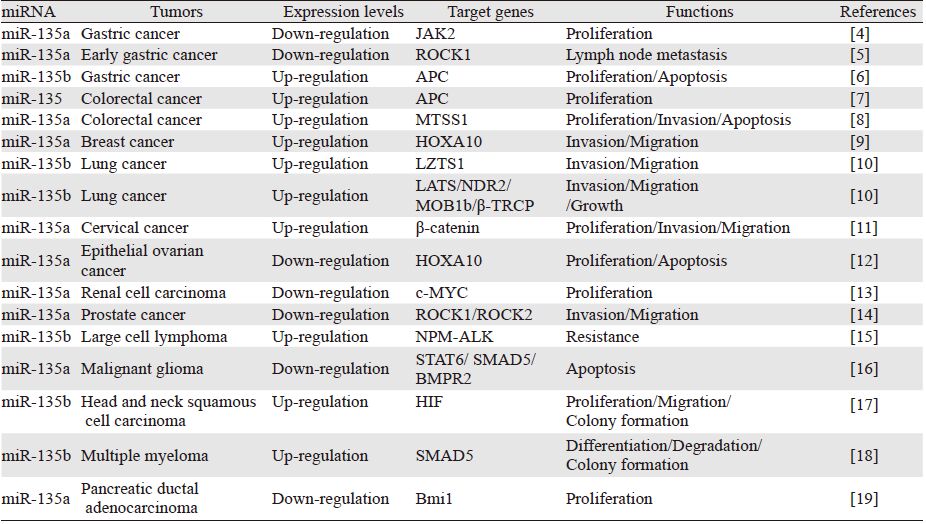
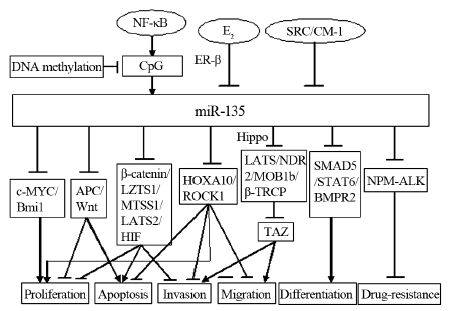
根据miRBase数据库资料显示,miR-135家族包括miR-135a和miR-135b:miR-135a由MIRN135A1和MIRN135A2两个基因编码,分别位于3p21.1、12q23.1;miR-135b编码基因MIRN135B位于1q32.1。近年来研究人员开始关注miR-135在肿瘤中的作用,关于其调控靶基因的研究报道日渐增多。Hidaka等[3]研究发现在20种对细胞增殖起抑制作用的小分子RNA中miR-135a是排在第四位的小分子RNA。相关研究表明miR-135在不同肿瘤中所发挥的作用也不同,见表 1,并通过不同靶基因调节肿瘤的发生发展,见图 1,现就miR-135与肿瘤的关系作一综述。
 |
|
| The expression of miR-135 was regulated by DNA methylation, NF-KB,E2 and SRC/CM-1, and miR-135 participated in cell proliferation,apoptosis, migration, invasion and drug-resistance by targeting c-MYC, HOXA10 and Hippo pathway 图 1 miR-135在肿瘤发生中的相关机制 Figure 1 Related mechanisms of miR-135 in tumor |
相关研究表明Janus激酶2(JAK2)是miR-135a的一个靶基因,在胃癌和淋巴瘤中得到证实并影响肿瘤的发生发展。Wu等[4]通过反转录聚合酶链式反应(反转录PCR)检测发现在大多数(8/11,72.7%)早期胃癌中miR-135a的表达水平与匹配的相邻非肿瘤组织相比呈低表达,过表达miR-135a可下调JAK2表达从而抑制胃癌细胞增殖、集落行成。同时在体外研究中也证实miR-135a有促进肿瘤细胞凋亡和抑制肿瘤细胞增殖的作用,如Dang等[19]研究发现在胰腺导管腺癌中miR-135a可通过靶向调控Bmi1抑制胰腺癌细胞的增殖。miR-135a不仅可通过调控相关的靶基因发挥抑癌作用,还可以通过影响相关通路、酶的活性和细胞周期等发挥抑癌作用。Tang等[12]研究发现miR-135a可通过下调HOXA10基因表达来抑制卵巢上皮性癌细胞的增殖并通过增强半胱氨酸天冬氨酸蛋白酶3(caspase-3)活性,降低B淋巴细胞瘤-2(bcl-2)与bax的比值来上调抑癌基因p53表达进而促进细胞凋亡,说明miR-135a具有抑制卵巢上皮性癌细胞生长的潜在抗肿瘤作用,为卵巢上皮性癌基因诊断及靶向基因治疗提供新的切入点。日本研究者Yamada等[13]近期发现miR-135a在肾癌中具有抑癌基因的功能,通过靶向调控癌基因c-MYC表达和细胞周期的进程从而抑制肾癌细胞的增殖,miR-135a在肾癌细胞(caki2和A498)和肾癌标本中都表现为低表达,过表达miR-135a可以明显抑制癌基因c-MYC的表达,从而抑制肾癌的发生发展。恶性胶质瘤是中枢神经系统最常见的恶性肿瘤,占颅脑肿瘤的40%~50%,2012年Wu等[16]发现miR-135a对恶性胶质瘤具有选择性杀伤作用,miR-135a通过调控信号转导子和转录激活子6(STAT6)、SMAD5、骨形成蛋白Ⅱ型受体(BMPR2)基因引起线粒体依赖的凋亡,并发现小分子miR-135a在恶性胶质瘤中呈低表达,与临床病理分级呈负相关,提示miR-135a的缺失可能参与了胶质瘤的发生发展;同时,还发现miR-135a能选择性诱导恶性胶质瘤发生线粒体通路依赖性的凋亡,而不杀伤正常的胶质细胞和神经元,这将有助于探索胶质瘤发生发展的分子机制和寻求更加具有特异性的治疗靶点。
1.2 miR-135抑制肿瘤侵袭和转移2014年Shin等[5]发现在早期胃癌中miR-135a能够通过下调靶基因Rho相关蛋白激酶1(ROCK1)抑制相关淋巴结的转移,从而抑制胃癌的恶化和转移,同时在胃癌细胞株中进行功能实验时发现miR-135a能够抑制胃癌细胞的侵袭和迁移能力,这将为早期胃癌的治疗和预后评估提供一种新思路。同时相关研究表明[13]在前列腺癌中受雄激素调节的miR-135a可通过下调靶基因ROCK1/ROCK2,进而降低前列腺癌细胞的迁移和侵袭能力。这些都为肿瘤的治疗提供一种潜在的研究方向。
2 miR-135的促癌作用 2.1 miR-135促进肿瘤增殖和抑制肿瘤凋亡已有研究表明,miR-135b可以抑制抑癌基因APC蛋白的合成,促进肿瘤的增殖和形成,Wang等[6]通过对72例胃癌组织及其癌旁正常组织标本检测发现miR-135b在胃癌中呈现高表达并随胃癌临床分期的进展逐渐增加,且发挥类似癌基因的作用,促进胃癌细胞增殖,抑制其凋亡,其分子机制可能是通过靶向调控APC导致蛋白表达和信号通路的异常,从而引起癌变。Nagel等[7]研究发现,在结直肠癌中,miR-135同样呈显著高表达并随着肿瘤分期的进展逐渐增加,它们通过抑制APC的表达来促进结肠癌的发生发展,发挥类似癌基因的作用,并可通过下调APC和β-转导重复相容蛋白(β-TRCP)抑制Wnt/β-链蛋白(β-catenin)信号通路促进结直肠癌细胞的增殖和抑制其细胞凋亡,但在APC双等位基因突变的结肠癌患者癌组织中,同样存在miR-135b高表达的现象,因此除APC基因外miR-135b可能还通过调节其他靶基因影响结直肠癌的发生发展。另外,Zhou等[8]报道转移抑制基因1(MTSS1)是miR-135a的靶基因同时也是一种抑癌基因,miR-135a可通过影响此蛋白的表达促进结肠癌细胞的增殖、凋亡。
2.2 miR-135促进肿瘤侵袭和转移Chen等[9]研究发现miR-135a通过靶向调控HOXA10促进乳腺癌细胞的侵袭和迁移,但对乳腺癌细胞的增殖无影响,值得注意的是,过表达miR-135a基因可以下调HOXA10的表达从而促进乳腺癌细胞的侵袭迁移;相反,过表达HOXA10也可以抑制miR-135a的表达起到抑制乳腺癌细胞侵袭迁移的作用。这样在miR-135a和HOXA10之间就形成一个互反馈回路来调节肿瘤的发生发展。另外,Lowery等[20]发现在乳腺癌中miR-135b的表达水平与雌激素受体的状态有关,但miR-135b在乳腺癌中的具体功能目前还未见相关文献报道。在肺癌中Lin等[10]证明一种由DNA甲基化和炎性核转录因子-kappaB(NF-κB)共同组成的新的双调控机制,该机制能够协同刺激miR-135b的表达,miR-135b不管在体外还是在裸鼠体内都能促进肺癌细胞的生长和转移,在肺癌中上调miR-135b可能会拮抗Hippo信号通路,miR-135b可通过下调Hippo信号通路中的靶基因LATS2、NDR2、MOB1b和β-TRCP介导下游的TAZ/YAP蛋白的高表达从而促进肿瘤的生长和上皮间质转化(EMT)、提高肿瘤细胞的侵袭和迁移能力,同时还证明了miR-135b可通过下调抑癌基因LZTS1提高肺癌细胞的侵袭和迁移能力。在宫颈癌中,2014年Leung等[11]发现miR-135a可通过SIAH1依赖泛素蛋白酶体途径调控β-catenin并激活其下游的靶基因从而增强宫颈癌细胞侵袭、迁移能力,同时证明miR-135a只有在含有人乳头瘤病毒(HPV)E6/E7蛋白的宫颈细胞中才能使其恶性转化。同时Liu等[21]研究发现miR-135a还可促进肝癌细胞的转移,miR-135a能促进门静脉癌栓的形成,从而促进肝癌的转移,在裸鼠成瘤模型中,抑制miR-135a的表达能降低门静脉癌栓的发生率。
2.3 miR-135促进肿瘤的分化和生成在头颈部鳞状细胞癌(SCCHN)中,Zhang等[17]通过基因芯片分析和qRT-PCR技术证明在SCCHN小鼠模型中miR-135b的表达是对照组(未含SCCHN)的两倍并呈现出癌基因的特点,促进肿瘤细胞集落形成,并通过激活缺氧诱导因子(HIF)和HIF-1α促进肿瘤血管的生成,还证明miR-135b的表达水平与肿瘤的微血管密度高度相关,这将有助于进一步探索miR-135b与HIF的分子机制并为SCCHN的治疗提供一种潜在的新方法。Lulla等[22]研究发现miR-135b在骨肉瘤(OS)中呈高表达,同时还发现miR-135b的低表达对于成骨细胞的正常生长和降解具有重要作用,高表达的miR-135b会使成骨细胞降解异常。Li等[23]发现SMAD5是miR-135b在多发性骨髓瘤中的一个靶基因,且Xu等[18]证明高表达miR-135b参与了受损的多发性骨髓瘤间质干细胞(MM-hMSCs)的成骨分化,并参与骨的生成,同时miR-135b在多发性骨髓瘤中的靶基因SMAD5在受损的MM-hMSCs中表达明显下降,这证明miR-135b是通过靶向调控SMAD5影响MM-hMSCs的成骨分化和骨的生成,这将为控制MM-hMSCs的成骨分化和治疗骨骼疾病提供新的思路和方法。
3 miR-135与肿瘤耐药性通过查询UCSC数据库(http://genome.ucsc.edu)发现,在多种肿瘤细胞中存在MIRN135A1、MIRN135A2、MIRN135B基因的启动子区域CpG岛甲基化现象,推测启动子甲基化程度的差异可能导致miR-135在耐药细胞中的下调,但具体机制还需进一步的实验阐明。
众所周知,在抗肿瘤的常规放化疗中,肿瘤的耐药性是抗肿瘤治疗的一大障碍,因此找到一种逆转肿瘤耐药的途径对于肿瘤非常重要[24]。2013年Zhou等[25]通过上调miR-135可明显抑制其靶基因MCL1在非小细胞肺癌细胞(肺癌耐顺铂细胞株A549)中的表达,进而增加NSCLC细胞对顺铂的敏感度,提高化疗药物对肺癌的化疗效果,这可能会成为提高肺癌诊疗效果的一个新途径。Holleman等[26]发现miR-135a在肺腺癌耐药株中呈高表达,通过在裸鼠体内注射NSCLC细胞并长期注射紫杉醇后,成功制造耐药的肺腺癌模型,从中取癌组织检测也发现miR-135a高表达。同时发现上调的miR-135a总伴随着APC基因表达的下降,并且在亲代药物敏感细胞株中利用小干扰RNA敲除APC基因后,敏感细胞对紫杉醇耐药。因此不管在体内还是体外,表达上调的miR-135a可通过靶向结合APC的mRNA,降低该基因的表达,从而使肺腺癌细胞对紫杉醇产生耐受,降低其敏感度。Matsuyama等[15]研究发现miR-135b影响核磷-间变性淋巴瘤激酶(NPM-ALK)介导的间变性大细胞淋巴瘤(ALCL)的致瘤性,上调miR-135b能降低Jurkat细胞的药物敏感度,从而增加Jurkat细胞的耐药性,同时还证明由miR-135b、NPM-ALK和STAT3组成一种新的致癌通路,该通路可以使白介素17(IL-17)在ALCL中产生免疫,因此抑制miR-135b的表达可能会干扰该致癌通路,这些发现可能会促使我们理解ALK-介导的肿瘤发生机制有益于开发一种新的治疗干预措施。因此,深入研究miR-135与肿瘤侵袭转移及耐药的关系,逆转癌细胞的化疗抗性和增强癌细胞对治疗的敏感度,将有助于进一步阐明肿瘤侵袭转移、耐药和抗凋亡的机制,为临床抗肿瘤治疗提供新思路和新方法。
4 miR-135在肿瘤治疗中的潜能近年来研究发现靶向治疗可以对抗肿瘤细胞的生长,表皮生长因子受体(EGFR)可以调控上游激活因子STAT3磷酸化,而STAT3能够调控miR-135b的表达且与肿瘤的发生发展有密切的联系,因此抗EGFR药物可有效阻遏STAT3的磷酸化,且联合应用抗EGFR药物可以治疗HNSCC、膀胱癌、NSCLC和结直肠癌,以上研究表明可以通过抑制STAT3磷酸化治疗肿瘤,因此未来研究如何通过miR-135b反向影响STAT3磷酸化来治疗肿瘤甚至可能会取代抗EGFR药物的治疗,成为一种新的肿瘤治疗方法[27, 28, 29, 30, 31]。
同时,miR-135对于肿瘤的预防和治疗潜能还表现为其他的形式,如Petracco等[32]发现miR-135a在正常子宫内膜细胞中的表达大约是在异常子宫内膜细胞中的三倍,miR-135a和miR-135b都可通过抑制HOXA10的表达从而减少子宫内膜异位症的发生,这将成为一种新的子宫内膜异位导致不孕的治疗方法。Munding等[33]研究发现miR-135b可作为胰腺导管腺癌一种新的生物标志物,miR-135b在胰腺导管腺癌中呈现较高的敏感度和特异性,因此miR-135b在胰腺导管腺癌的表达分析可评估其作为一种早期诊断生物标志物潜在的价值,这对胰腺癌的早期诊断和治疗具有非常重要的意义。同时,在人类大便中检测到的miR-135b可作为结直肠癌(敏感度78%)和高危结直肠腺瘤(敏感度73%)中一种潜在的非侵袭性的生物标记,这一发现可为早期诊断结直肠癌和结直肠腺瘤提供新的检测方法[7, 34]。Tong等[35]通过对40例前列腺切除术后的标本(来源于T2a/b期、早期复发和没有复发的前列腺癌患者)进行荧光定量PCR检测发现,miR-135b在前列腺癌复发(R)的标本中的表达比没有复发(NR)的高40%(R/NR:1.6),说明miR-135b表达与前列腺癌的复发率呈正相关,通过下调miR-135b表达抑制前列腺癌细胞的生长和预防前列腺癌的复发具有潜在治疗前列腺癌的价值。这些研究结果提示,miR-135可作为肿瘤检测和治疗的一种标志物,应进一步探讨其在肿瘤诊断和治疗中的潜能。
5 miR-135与肿瘤的关系以上研究表明miR-135在肿瘤中具有抑癌和促癌双重作用,同时,由于miR-135的组织特异性和复杂性,使其与肿瘤的关系也呈现多样化。2013年Golubovskaya等[36]证实miR-135可通过靶向调控黏着斑激酶(FAK)而抑制肿瘤细胞侵袭及增加肿瘤细胞药物敏感度,说明miR-135可通过肿瘤中的相关激酶对肿瘤的发生发展产生影响。而Shin等[37]发现丹参酮Ⅰ与肿瘤坏死因子诱导凋亡配体(TRAIL)联合协同诱导前列癌细胞凋亡是通过上调miR135a-3p与死亡受体5(DR5)实现的,过表达miR135a-3p可促使DR5表达上调,在整个调节过程中,miR135a-3p发挥启动和引导的作用。在肺癌中,CD133的miR135a/b结合位点多态性通过下调CD133的表达可降低中国肺癌患者的风险和改善其预后[38]。同时,在结直肠癌中,miR135b可通过靶向调控泛素特异性肽酶13(USP13)影响人第10号染色体缺失的磷酸酶(PTEN)的稳定性进而促进癌细胞的增殖和糖酵解,且PTEN的失活与miR135b之间存在反馈回路,表明miR135b不仅影响肿瘤发生发展而且还参与肿瘤细胞的生理过程[39]。另外,miR-135可通过对NR3C2的调控而影响特发性高血压疾病的进程[40],miR-135A2可通过调节LMX1B介导Wnt1/Wnt信号转导决定脑的大小和分配多巴胺前体细胞[41],miR-135a还可促进糖尿病肾病患者肾的纤维化[42]。
6 小结miR-135在胃癌、卵巢上皮性癌、肾癌、前列腺癌等肿瘤中表达下调,其抑癌作用可能涉及p53相关机制、细胞周期进程及信号转导。miR-135在结直肠癌、乳腺癌、肺癌等肿瘤中表达上调,其促癌作用可能涉及Wnt信号通路、PTEN/PI3K通路、Hippo信号通路、受DNA甲基化与NF-κB双调控机制调控。相关研究证明miR-135a和miR-135b在同种肿瘤中的作用也可能不同,miR-135a在胃癌组织中表达下调,与肿瘤细胞增殖相关[4],而miR-135b在胃癌组织中高表达,并且与肿瘤细胞增殖和凋亡相关[6]。另外,同一种编码基因和靶基因因其所在肿瘤不同而发挥不同的作用,miR-135a可使靶基因HOXA10下调从而促进乳腺癌细胞的侵袭、迁移[9],而在卵巢上皮性癌中,miR-135a通过下调靶基因HOXA10表达来抑制癌细胞的增殖和促进癌细胞凋亡[12]。这些研究结果证明miR-135具有抑癌和促癌双重作用,其具体作用随肿瘤的类型和细胞背景的改变而不同,因此,miR-135与肿瘤的复杂性及在不同肿瘤中的具体作用还需进一步的研究和探讨。同时,miR-135的差异性表达有可能成为肿瘤临床诊断和预后判断的分子标志物,深入探索其与抗肿瘤药物联合运用的效应及分子机制有助于阐明miR-135在肿瘤病理生理进程中的调控作用,针对miR-135进行药物研发,有望为肿瘤治疗提供一种新的手段,在肿瘤的临床诊疗上无疑具有广阔的应用前景。
| [1] | Nguyen DX, Bos PD, Massagué J. Metastasis: from dissemination to organ-specific colonization[J]. Nat Rev Cancer, 2009, 9(4): 274-84. |
| [2] | Ebert MS, Sharp PA. MicroRNA sponges: progress and possibilities[J]. RNA, 2010, 16(11): 2043-50. |
| [3] | Hidaka H, Seki N, Yoshino H, et al. Tumor suppressive microRNA-1285 regulates novel molecular targets: aberrant expression and functional significance in renal cell carcinoma[J]. Oncotarget, 2012, 3(1): 44-57. |
| [4] | Wu H, Huang M, Cao P, et al. MiR-135a targets JAK2 and inhibits gastric cancer cell proliferation[J]. Cancer Biol Ther, 2012, 13(5): 281-8. |
| [5] | Shin JY, Kim YI, Cho SJ, et al. MicroRNA 135a suppresses lymph node metastasis through down-regulation of ROCK1 in early gastric cancer[J]. PloS One, 2014, 9(1): e85205. |
| [6] | Wang LP, Ma XQ, Cai JC. Clinicopathological significance and function of miR-135b in the occurrence and development of gastric cancer[J]. Zhonghua Yi Xue Za Zhi, 2012, 92(46): 3269-73. [王霖沛, 马筱秋, 蔡建春. 微小RNA-135b在胃癌发 生发展中的临床病理意义及其作用[J]. 中华医学杂志, 2012, 92(46): 3269-73.] |
| [7] | Nagel R, le Sage C, Diosdado B, et al. Regulation of the adenomatous polyposis coli gene by the miR-135 family in colorectal cancer[J]. Cancer Res, 2008, 68(14): 5795-802. |
| [8] | Zhou W, Li X, Liu F, et al. MiR-135a promotes growth and invasion of colorectal cancer via metastasis suppressor 1 in vitro[J]. Acta Biochim Biophys Sin(Shanghai), 2012, 44(10): 838-46. |
| [9] | Chen Y, Zhang J, Wang H, et al. miRNA-135a promotes breast cancer cell migration and invasion by targeting HOXA10[J]. BMC Cancer, 2012, 12: 111. |
| [10] | Lin CW, Chang YL, Chang YC, et al. MicroRNA-135b promotes lung cancer metastasis by regulating multiple targets in the Hippo pathway and LZTS1[J]. Nat Commun, 2013, 4: 1877. |
| [11] | Leung CO, Deng W, Ye TM, et al. miR-135a leads to cervical cancer cell transformation through regulation of beta-catenin via a SIAH1-dependent ubiquitin proteosomal pathway[J]. Carcinogenesis, 2014, 35(9): 1931-40. |
| [12] | Tang W, Jiang Y, Mu X, et al. MiR-135a functions as a tumor suppressor in epithelial ovarian cancer and regulates HOXA10 expression[J]. Cell Signal, 2014, 26(7): 1420-6. |
| [13] | Yamada Y, Hidaka H, Seki N, et al. Tumor-suppressive microRNA-135a inhibits cancer cell proliferation by targeting the c-MYC oncogene in renal cell carcinoma[J]. Cancer Sci, 2013, 104(3): 304-12. |
| [14] | Kroiss A, Vincent S, Decaussin-Petrucci M, et al. Androgenregulated microRNA-135a decreases prostate cancer cell migration and invasion through downregulating ROCK1 and ROCK2[J]. Oncogene, 2015, 34(22): 2846-55. |
| [15] | Matsuyama H, Suzuki HI, Nishimori H, et al. miR-135b mediates NPM-ALK-driven oncogenicity and renders IL-17-producing immunophenotype to anaplastic large cell lymphoma[J]. Blood,2011, 118(26): 6881-92. |
| [16] | Wu S, Lin Y, Xu D, et al. MiR-135a functions as a selective killer of malignant glioma[J]. Oncogene, 2012, 31(34): 3866-74. |
| [17] | Zhang L, Sun ZJ, Bian Y, et al. MicroRNA-135b acts as a tumor promoter by targeting the hypoxia-inducible factor pathway in genetically defined mouse model of head and neck squamous cell carcinoma[J]. Cancer Lett, 2013, 331(2): 230-8. |
| [18] | Xu S, Cecilia Santini G, De Veirman K, et al. Upregulation of miR-135b is involved in the impaired osteogenic differentiation of mesenchymal stem cells derived from multiple myeloma patients[J]. PloS One, 2013, 8(11): e79752. |
| [19] | Dang Z, Xu WH, Lu P, et al. MicroRNA-135a inhibits cell proliferation by targeting bmi1 in pancreatic ductal adenocarcinoma[J]. Int J Biol Sci, 2014, 10(7): 733-45. |
| [20] | Lowery AJ, Miller N, Devaney A, et al. MicroRNA signatures predict oestrogen receptor, progesterone receptor and HER2/neu receptor status in breast cancer[J]. Breast Cancer Res, 2009, 11(3): R27. |
| [21] | Liu S, Guo W, Shi J, et al. MicroRNA-135a contributes to the development of portal vein tumor thrombus by promoting metastasis in hepatocellular carcinoma[J]. J Hepatol, 2012, 56(2): 389-96. |
| [22] | Lulla RR, Costa FF, Bischof JM, et al. Identification of differentially expressed microRNAs in osteosarcoma[J]. Sarcoma, 2011, 2011: 732690. |
| [23] | Li Z, Hassan MQ, Volinia S, et al. A microRNA signature for a BMP2-induced osteoblast lineage commitment program[J]. Proc Natl Acad Sci USA, 2008, 105(37): 13906-11. |
| [24] | Lindner K, Haier J, Hummel R. MicroRNAs and their clinical impact on resistance to anticancer treatment[M]//Sadegh Babashah. MicroRNAs: key regulators of oncogenesis. Springer Link, 2014: 369-86. |
| [25] | Zhou L, Qiu T, Xu J, et al. miR-135a/b modulate cisplatin resistance of human lung cancer cell line by targeting MCL1[J]. Pathol Oncol Res, 2013, 19(4): 677-83. |
| [26] | Holleman A, Chung I, Olsen RR, et al. miR-135a contributes to paclitaxel resistance in tumor cells both in vitro and in vivo[J]. Oncogene, 2011, 30(43): 4386-98. |
| [27] | Baba Y, Fujii M, Tokumaru Y, et al. Present and future of EGFR inhibitors for head and neck squamous cell cancer[J]. J Oncol, 2012, 2012: 986725. |
| [28] | Dobi E, Monni en F, Kim S, e t al . Impa c t of STAT3 phosphorylation on the clinical effectiveness of anti-EGFR– based therapy in patients with metastatic colorectal cancer[J]. Clin Colorectal Cancer, 2013, 12(1): 28-36. |
| [29] | Heinemann V, Stintzing S, Kirchner T, et al. Clinical relevance of EGFR-and KRAS-status in colorectal cancer patients treated with monoclonal antibodies directed against the EGFR[J]. Cancer Treat Rev, 2009, 35(3): 262-71. |
| [30] | Khatri R, Subramanian S. MicroRNA-135b and its circuitry networks as potential therapeutic targets in colon cancer[J]. Front Oncol, 2013, 3: 268. |
| [31] | Sen M, Joyce S, Panahandeh M, et al. Targeting Stat3 abrogates EGFR inhibitor resistance in cancer[J]. Clin Cancer Res, 2012, 18(18): 4986-96. |
| [32] | Petracco R, Grechukhina O, Popkhadze S, et al. MicroRNA 135 regulates HOXA10 expression in endometriosis[J]. J Clin Endocrinol Metab, 2011, 96(12): E1925-33. |
| [33] | Munding JB, Adai AT, Maghnouj A, et al. Global microRNA expression profiling of microdissected tissues identifies miR-135b as a novel biomarker for pancreatic ductal adenocarcinoma[J]. Int J Cancer, 2012, 131(2): E86-95. |
| [34] | Wu CW, Ng SC, Dong Y, et al. Identification of microRNA-135b in stool as a potential noninvasive biomarker for colorectal cancer and adenoma[J]. Clin Cancer Res, 2014, 20(11): 2994-3002. |
| [35] | Tong AW, Fulgham P, Jay C, et al. MicroRNA profile analysis of human prostate cancers[J]. Cancer Gene Ther, 2009, 16(3): 206-16. |
| [36] | Golubovskaya VM, Sumbler B, Ho B, et al. MiR-138 and miR-135 directly target focal adhesion kinase, inhibit cell invasion, and increase sensitivity to chemotherapy in cancer cells[J]. Anticancer Agents Med Chem, 2013, 14(1): 18-28. |
| [37] | Shin EA, Sohn EJ, Won G, et al. Upregulation of microRNA135a- 3p and death receptor 5 plays a critical role in Tanshinone I sensitized prostate cancer cells to TRAIL induced apoptosis[J]. Oncotarget, 2014, 5(14): 5624-36. |
| [38] | Cheng M, Yang L, Yang R, et al. A microRNA-135a/b binding polymorphism in CD133 confers decreased risk and favorable prognosis of lung cancer in Chinese by reducing CD133 expression[J]. Carcinogenesis, 2013, 34(10): 2292-9. |
| [39] | Xiang S, Fang J, Wang S, et al. MicroRNA-135b regulates the stability of PTEN and promotes glycolysis by targeting USP13 in human colorectal cancers[J]. Oncol Rep, 2014, 33(3): 1342-8. |
| [40] | Sõber S1, Laan M, Annilo T. MicroRNAs miR-124 and miR-135a are potential regulators of the mineralocorticoid receptor gene (NR3C2) expression[J]. Biochem Biophys Res Commun, 2010, 391(1): 727-32. |
| [41] | Anderegg A, Lin HP, Chen JA, et al. An Lmx1b-miR135a2 regulatory circuit modulates Wnt1/Wnt signaling and determines the size of the midbrain dopaminergic progenitor pool[J]. PLoS Genet, 2013, 9(12): e1003973. |
| [42] | He F, Peng F, Xia X, et al. MiR-135a promotes renal fibrosis in diabetic nephropathy by regulating TRPC1[J]. Diabetologia, 2014, 57(8): 1726-36. |
 2015, Vol. 42
2015, Vol. 42


