文章信息
- 陈勇华, 高青, 李文丽.
- CHEN Yonghua, GAO Qing, LI Wenli.
- siRNA干扰Mig-7基因对人胃癌MKN45细胞侵袭和迁移的影响
- Effect of siRNA Targeting Migration-inducing Protein 7 Gene on Invasion and Migration of Human Gastric Cancer Cells MKN45
- 肿瘤防治研究, 2015, 42(10): 979-983
- Cancer Research on Prevention and Treatment, 2015, 42(10): 979-983
- http://www.zlfzyj.com/CN/10.3971/j.issn.1000-8578.2015.10.006
-
文章历史
- 收稿日期: 2014-10-23
- 修回日期: 2015-06-11
2. 400016 重庆,重庆医科大学附属第一医院消化内科
2. Department of Gastroenterology, The First Affiliated Hospital of Chongqing Medical University, Chongqing 400016, China
胃癌是最常见的恶性肿瘤之一,全球范围内其死亡率居第二位,是一种严重危害人类健康的疾病。虽然手术切除是胃癌治疗首选方案,但由于胃癌早期高转移,很多患者在诊断时已为中晚期,治疗常常很棘手[1, 2]。探讨胃癌细胞侵袭和转移的机制,寻找新的治疗靶点对胃癌具有十分重要的意义。胃癌发生发展涉及一系列分子水平的异常,近年来研究发现迁移诱导基因7(migration inducing gene-7,Mig-7),能增加肿瘤细胞的侵袭能力从而促进肿瘤的转移[3]。在前期研究中我们发现在胃癌组织中Mig-7高表达,与胃癌淋巴结转移呈正相关[4, 5]。本研究在前期实验基础上,选用其中一条具有最佳干扰效果的靶向Mig-7基因的siRNA,通过抑制人胃癌MKN45细胞Mig-7基因的表达,观察其对胃癌细胞侵袭和迁移的影响,并探讨可能机制。
1 材料和方法 1.1 材料人胃癌MKN45细胞购自中科院上海细胞库;兔抗人Mig-7抗体为美国Abcam公司产品;兔抗人MMP-2和MMP-9抗体为美国Epitomics公司产品;引物由宝生物公司设计和合成。LipofectamineTM2000 Reagent购自美国Invitrogen公司;Matrigel胶购自美国BD公司;Transwell小室为美国Corning公司产品。
1.2 方法 1.2.1 siRNA设计合成靶向Mig-7基因的特异s iRNA序列为: 正义链5 ' -CUAUAGACUCUGAGCAAGAdTdT-3',反义链3'-dTdTGAUAUCUGAGACUCGUUCU-5'。由广州市锐博生物科技有限公司合成。靶序列位于Mig-7重要功能区,经BLAST确认与人mRNA序列无同源性。(本实验中siRNA为化学合成,由广州市锐博生物科技有限公司合成,合成的siRNA成品为粉末状,研究者将其溶解在灭菌灭酶H2O中,配制成20μmol/L储存液分装保存,按照转染说明书步骤直接进行后续转染)。
1.2.2 siRNA转染人胃癌MKN45细胞采用100 ml/L新生胎牛血清RPMI 1640培养液在37℃、5%CO2条件下培养,转染前一天,将MKN45细胞传代于6孔板中培养,当细胞汇合度达30%~50%时,按LipofectamineTM2000 Reagent说明书进行转染,siRNA终浓度为50 nmol/L。转染后6~8 h更换含血清的完全培养液培养。
1.2.3 Real-time PCR检测将实验分为三组,Mig-7-siRNA转染组、control-siRNA转染组及未转染MKN45组,分别提取各组转染后48 h细胞总RNA,总RNA进行反转录成cDNA,通过实时定量PCR扩增目的基因。反应体系为20 μl,其中Fast SYBR Green MixⅠ10 μl,cDNA 2 μl,上、下游引物各0.8 μl,ddH2O 6.4 μl。反应条件为:94℃预变性20 s,94℃变性5 s,60℃退火、延伸30 s,反应40个循环。采用2-ΔΔCt法分析目的基因mRNA的相对表达水平。扩增基因的特异性引物序列为: GAPDH:正义引物:5′-CTTTGGTATCGTGGAAGGACTC-3′,反义引物:5′-GTAGAGGCAGGGATGATGTTCT-3′;Mig-7:正义引物:5'-GACAAAGTCAAGAAGACAGACCGAG-3',反义引物:5'-ATATTGTTGGATGGGATGTCTCG-3'。
1.2.4 Western blot检测实验分组同1.2.3。转染后72 h提取蛋白,测定浓度。各组相等的总蛋白量进行SDS-PAGE电泳分离后,电转至PVDF膜上,50 g/L脱脂奶粉封闭60~90 min。一抗Mig-7(1:500)、MMP-2、MMP-9(1:1 000)及β-actin(1:2 000)4℃孵育过夜,TBST洗膜,分别室温孵育辣根过氧化物酶标记山羊抗鼠IgG(β-actin为辣根过氧化物酶标记山羊抗兔IgG)(1:2 000)2 h,TBST洗膜,化学发光(ECL)试剂盒显影。
1.2.5 细胞增殖实验实验分组同1.2.3,转染后48 h按细胞密度为1.5×104/ml接种于96孔培养板中,每孔200 μl。每组设3个复孔,分别在接种后0、24、48、72 h,每孔加入MTT液20 μl,4 h后每孔加入200 μl二甲亚砜,酶标仪检测570 nm处吸光度值。以时间为横轴,A570nm值为纵轴,绘制生长曲线。
1.2.6 细胞迁移实验实验分组同1.2.3,转染后48 h按每孔8×104个细胞接种于Transwell小室中,上室终体积为400 μl细胞悬液,下室为RPMI1640培养液600 μl。常规培养20 h,固定、瑞氏染色。倒置显微镜下观察并计数。
1.2.7 细胞侵袭实验实验分组同1.2.3,实验前1天,Transwell小室上室面铺1:5 Matrigel胶,紫外灯照射过夜。转染后48 h按每孔8×104个接种于Transwell小室中,上室终体积为400 μl细胞悬液,下室为RPMI1640培养液600 μl,常规培养30 h,固定、瑞氏染色。倒置显微镜下观察并计数。
1.3 统计学方法采用SPSS19.0统计软件进行单因素方差分析,数据以(x±s)表示。P﹤0.05为差异有统计学意义。
2 结果 2.1 转染siRNA后MKN45细胞中Mig-7 mRNA水平和蛋白水平的变化转染后48 h,分别提取各组细胞的mRNA进行检测,验证其沉默效果,siRNA序列使Mig-7-siRNA转染组MKN45细胞中Mig-7在mRNA水平下降(80±2.91)%(P=0.000),转染阴性对照组siRNA后mRNA水平无明显改变(P=0.351)。转染后72 h,提取各组细胞的蛋白进行Westernblot检测,Mig-7蛋白相对表达强度各组分别为:(11.02±5.01)%,(146.56±0.96)%,(144.02±3.85)%。与未转染组及空白对照组比较Mig-7-siRNA转染组细胞中Mig-7蛋白水平下降(89.1±2.67)%(P=0.000),见图 1~2。说明靶点序列能有效降低MKN45细胞中Mig-7表达,保证后续的实验顺利进行。
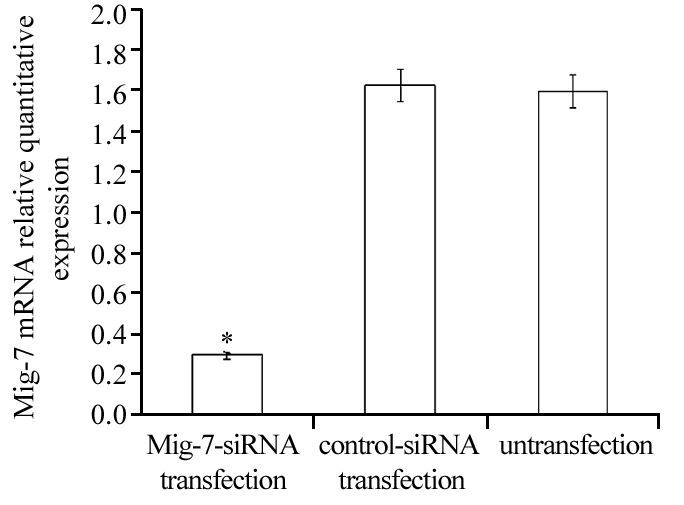
|
| *: P<0.05,compared with control-siRNA transfection and untransfection groups 图 1 转染后MKN45细胞Mig-7 mRNA的表达 Figure 1 Expression of Mig-7 mRNA in MKN45 cells after transfection |
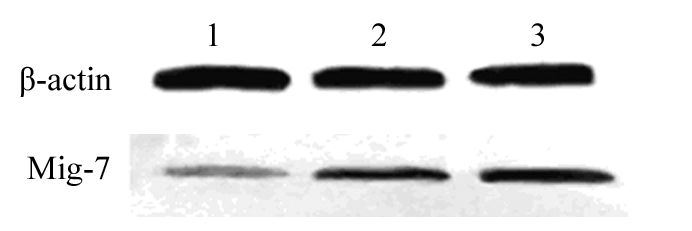
|
| 1: Mig-7-siRNA transfection group; 2. control-siRNA transfection group; 3. untransfection group 图 2 转染后MKN45细胞Mig-7蛋白的表达 Figure 2 Expression of Mig-7 protein in MKN45 cells after transfection |
各时间观察点,转染组和空白转染组、转染组和未转染组、空白转染组和未转染组A570 nm的吸光度值比较,差异均无统计学意义[P=0.328,0.398,0.881(0 h),P=0.969,0.092,0.097(24 h),P=0.248,0.051,0.284(48 h),P=0.539,0.051,0.126(72 h),P>0.05],转染后72 h内细胞增殖差异无统计学意义(P>0.05),见图 3。
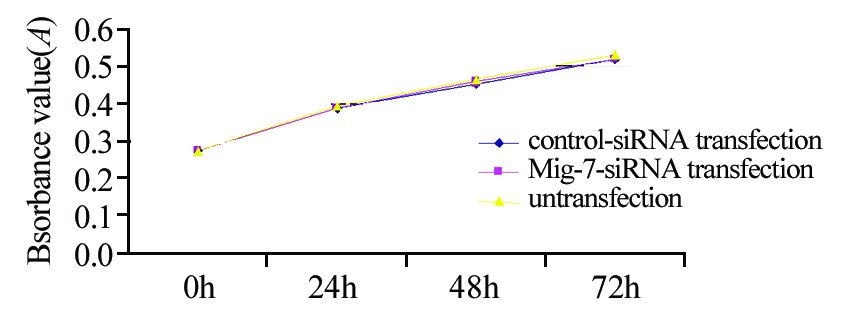
|
| 图 3 各组胃癌细胞生长曲线 Figure 3 Growth curves of each group of gastric cancer cells |
Mig-7-siRNA转染组20 h迁移细胞相对于control-siRNA转染组和未转染MKN45组明显减少(P=0.000),而control-siRNA转染组和未转染MKN45组之间差异无统计学意义(P=0.342),见图 4。Mig-7-siRNA转染组30 h穿过基底膜的细胞相对于control-siRNA转染组和未转染MKN45组亦有明显减少(P=0.000),而后两组差异没有统计学意义(P=0.251),见图 4。可见,由于Mig-7表达受抑制,胃癌MKN45细胞的迁移和侵袭能力受到不同程度抑制。
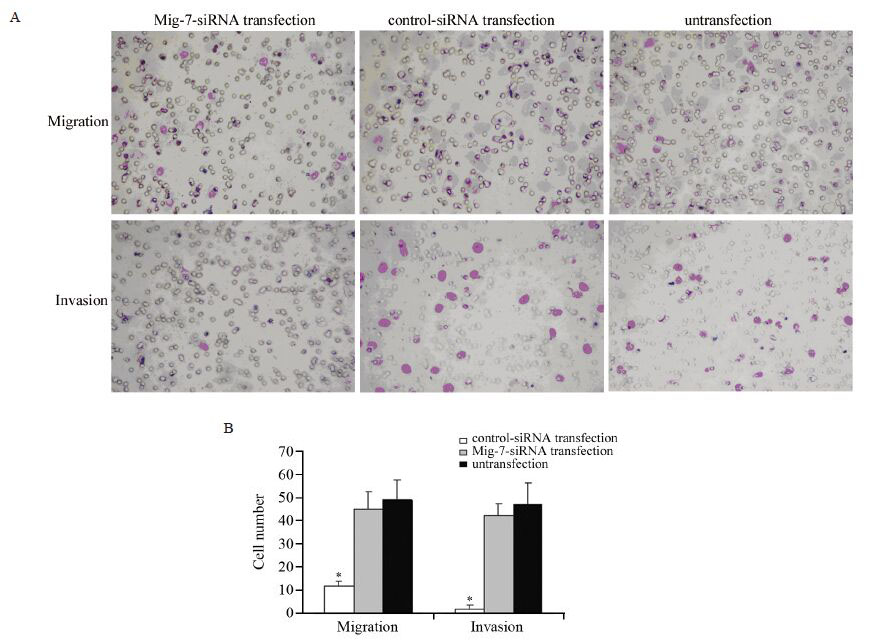
|
| A: change of migration and invasion abilities of MKN45 cells after transfection(Wright’s staining ×200); B: cells number per field at high magnification; *: P<0.05,compared with control-siRNA transfection or untransfection groups 图 4 各组胃癌细胞迁移和侵袭能力 Figure 4 Migration and invasion abilities of each group of gastric cancer cells |
转染后72 h,Mig-7-siRNA转染组细胞MMP-2蛋白表达水平低于control-siRNA转染组与未转染组,差异具有统计学意义(P=0.000),而后两组该蛋白表达量差异没有统计学意义(P=0.777),转染组和空白转染组、转染组和未转染组、空白转染组和未转染组间MMP-9蛋白表达量差异无统计学意义(P=0.600,P=0137,P=0.064),见图 5,其中pro-MMP-2为MMP-2的前肽形式,active-MMP-2为MMP-2的活化状态。
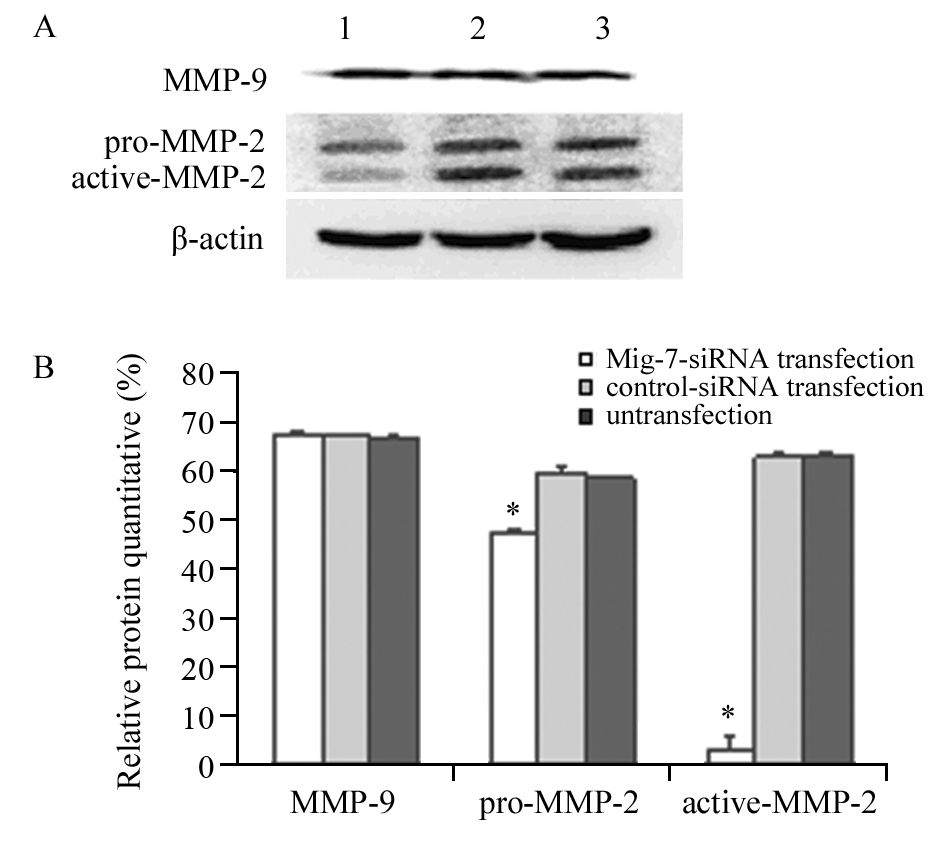
|
| A: the protein levels of MMP-2 and MMP-9 of each group; B: the relative protein quantitative of MMP-2 and MMP-9 of each group; 1: Mig-7-siRNA transfection group; 2. control-siRNA transfection group; 3. untransfection group; pro-MMP-2 was the propeptide form of MMP-2,active-MMP-2 was active form of MMP-2; *: P<0.05, compared with control-siRNA transfection or untransfection groups 图 5 转染后MKN45细胞MMP-2和MMP-9蛋白的表达 Figure 5 Protein expression of MMP-2 and MMP-9 in MKN45 cells after transfection |
肿瘤细胞的侵袭与迁移行为是恶性肿瘤的特征之一,亦是肿瘤发生转移最关键的因素。抑制肿瘤细胞的侵袭迁移、明确其机制,已成为研究的热点。而采取针对肿瘤细胞特异表达基因的靶向治疗,能发挥更有效的、不良反应更小的抗肿瘤治疗效果。
Crouch等[6]发现了一种新的人类基因Mig-7,该基因位于1p22.1,其cDNA全长1 617 bp,编码产物为一富含半胱氨酸,由207个氨基酸组成的蛋白。前期研究已经证实从多种类型肿瘤组织细胞中检测到Mig-7表达,而在正常组织中未检测到其表达[7]。抑制Mig-7表达,能降低子宫内膜癌、肺癌细胞的侵袭能力,而增加Mig-7表达,能增强结肠癌、肺癌细胞的侵袭能力[8, 9]。此外,研究表明Mig-7与肿瘤的恶性程度密切相关,在高侵袭性的黑色素瘤细胞中表达,而在低侵袭性的黑色素瘤细胞中不表达[3]。表明Mig-7在肿瘤的侵袭中起重要作用。结合其在肿瘤细胞中特异表达的特点,Mig-7可作为潜在的抗肿瘤靶点。
本研究采用化学合成的s i RNA下调胃癌MKN45细胞中Mig-7表达,观察了Mig-7水平降低对胃癌细胞增殖、侵袭及迁移能力的影响。结果提示Mig-7-siRNA转染组较control-siRNA转染组及未转染组,细胞增殖无明显差异,而侵袭、迁移能力均显著下降,差异具有统计学意义。表明下调Mig-7表达对细胞增殖影响较小,但可明显降低胃癌MKN45细胞侵袭和迁移能力,与前期实验结果一致。在前期的研究中,我们测定了三种不同分化程度的胃癌细胞株SGC7901、MKN45、MKN28及正常胃黏膜GES-1细胞,观察到Mig-7在前2种细胞中表达,而在后2种细胞中不表达,且抑制SGC7901细胞中Mig-7表达后,也观察到该细胞侵袭及迁移能力受到抑制[5],以上实验结果表明Mig-7在胃癌细胞侵袭中起重要作用。
MMPs是一类可降低细胞外基质的蛋白水解酶,其中MMP-2、MMP-9是MMPs超家族的重要成员,能通过蛋白水解酶的作用降解间质结缔组织和基底膜成分,在肿瘤的侵袭转移中起重要作用[10]。因此,本研究选取该两种蛋白作为观测指标,探讨Mig-7调节胃癌细胞侵袭迁移的可能机制。Petty等[8]发现下调Mig-7表达能抑制MT1-MMP的活性,活化的MT1-MMP与MMP-2激活密切相关[11, 12]。活化的MT1-MMP与MMP-2共同降解层黏连蛋白5γ2链为前迁移片段γ2′和γ2×片段,其中层黏连蛋白5γ2链是肿瘤侵袭转移所需的蛋白,当这些降解的片段释放到肿瘤微环境能增加侵袭和迁移[3]。此外,AI-Raawi等[13]研究表明MT1-MMP可能通过增加MMP-9表达在乳腺癌的进展中起重要作用。本研究观察到Mig-7-siRNA转染组中MMP-2蛋白水平较另外两组明显降低,且活化状态的MMP-2降低更明显,而各组MMP-9蛋白水平差异无统计学意义。由此推测,这可能与Mig-7作用通途有关,Mig-7的激活能促进下游MMP-2的活化,而抑制Mig-7的表达,导致活化状态的MMP-2受到抑制,进而导致层黏连蛋白5γ2 链水解减少,来调节胃癌细胞的侵袭能力,而与MMP-9蛋白无关。
综上所述,本研究证实了Mig-7在胃癌细胞侵 袭转移中发挥重要作用,抑制Mig-7表达可能对延 缓胃癌转移具有重要意义。
| [1] | Huang Z, Wang ZW, Zhang N, et al. Effects of KLF on proliferation,m igration and invasion of human gastric cancer SGC7901 cells inv itro[J]. Chongqing Yi Xue, 2013, 42(2): 130-3. [黄镇, 王子卫,张 能, 等. KLF对人胃癌细胞株SGC7901体外增殖及迁移侵袭能力的影响[J]. 重庆医学, 2013, 42(2): 130-3.] |
| [2] | Li M, Gu Y, Zhang S, et al. Vasculogenic mimicry: a prognostics ign of gastric adenocarcinoma[J]. Pathol Oncol Res, 2010, 16(2):2 59-66. |
| [3] | Petty AP, Garman KL, Winn VD, et al. Overexpression ofc arcinoma and embryonic cytotrophoblast cell-specific Mig-7i nduces invasion and vessel-like structure formation[J]. Am JP athol, 2007, 170(5): 1763-80. |
| [4] | Liao SP, Gao Q. Expressions and clinical significance of vasculogenicm imicry and related protein Mig-7 and MMP-2 in gastricc arcinoma[J]. Xi Bao Yu Fen Zi Mian Yi Xue Za Zhi, 2013,2 9(2): 194-6. [廖世平, 高青. 血管生成拟态及相关蛋白Mig-7、M MP-2在胃癌组织中的表达及临床意义[J]. 细胞与分子免疫学 杂志, 2013, 29(2): 194-6.] |
| [5] | Li WL, Gao Q. Mig-7 enhances vasculogenic mimicry in gastricc ancer cells[J]. Xi Bao Yu Fen Zi Mian Yi Xue Za Zhi, 2012,2 8(11): 1142-5. [李文丽, 高青. 迁移诱导蛋白7促进胃癌血管生成拟态[J]. 细胞与分子免疫学杂志, 2012, 28(11): 1142-5.] |
| [6] | Crouch S, Spidel CS, Lindsey JS. HGF and ligation of alphavbeta5i ntegrin induce a novel, cancer cell-specific gene expressionr equired for cell scattering[J]. Exp Cell Res, 2004, 292(2): 274-87. |
| [7] | Phillips TM, Lindsey JS. Carcinoma cell-specific Mig-7: newp otential marker for circulating and migrating cancer cells[J].O ncol Rep, 2005, 13(1): 37-44. |
| [8] | Petty AP, Wright SE, Rewers-Felkins KA, et al. Targeting migrationi nducting gene-7 inhibits carcinoma cell invasion, early primaryt umor growth, and stimulates monocyte oncolytic activity[J]. MolC ancer Ther, 2009, 8(8): 2412-23. |
| [9] | Ho MY, Liang SM, Hung SW, et al. MIG-7 controls COX-2/PGE2-m ediated lung cancer metastasis[J].Cancer Res, 2013, 73(1):4 39-49. |
| [10] | Wan J, Li XM, Shu SR, et al. Effects of lentivirus-mediateds iRNA targeting IGF-1R on migration and invasion abilities ofe ndometrial carcinoma cells[J].Zhongguo Bing Li Sheng Li ZaZ hi, 2012, 28(8): 1352-7. [万璟, 李小毛, 舒珊荣, 等. 慢病毒介导的靶向沉默胰岛素样生长因子1型受体的siRNA对人子宫内膜 癌细胞迁移和侵袭能力的影响[J]. 中国病理生理杂志, 2012,2 8(8): 1352-7.] |
| [11] | Sato H, Takino T. Coordinate action of membrane-type matrixm etalloproteinase-1 (MT1-MMP) and MMP-2 enhancesp ericellular proteolysis and invasion[J]. Cancer Sci, 2010, 101(4):8 43-7. |
| [12] | Reis ST, Antunes AA, Pontes-Junior J, et al. Underexpressiono f MMP-2 and its regulators,TIMP2,MT1-MMP and IL-8,isa ssociated with prostate cancer[J]. Int Braz J Urol, 2012, 38(2):1 67-74. |
| [13] | AI-Raawi D, Abu-EI-Zahab H, EI-Shinawi M, et al. Membranet ype-1 matrix metalloproteinase (MT1-MMP) correlates with thee xpression and activation of matrix metalloproteinase-2 (MMP-2)i n inflammatory breast cancer[J]. Int J Clin Exp Med, 2011, 4(4):2 65-75. |
 2015, Vol. 42
2015, Vol. 42
