文章信息
- 曲颜丽,王海峰,唐勇. 2014.
- QU Yanli, WANG Haifeng, TANG Yong. 2014.
- 贝伐单抗联合化疗一线治疗转移性结直肠癌的Meta分析
- Bevacizumab Combined with Chemotherapy as First-line Therapy for Metastatic Colorectal Cancer: A Meta-analysis
- 肿瘤防治研究, 2014, 41(09): 1002-1008
- Cancer Research on Prevention and Treatment, 2014, 41(09): 1002-1008
- http://www.zlfzyj.com/CN/10.3971/j.issn.1000-8578.2014.09.011
-
文章历史
- 收稿日期:2014-03-26
- 修回日期:2014-07-14
贝伐单抗(bevacizumab,BEV)是一种重组 的血管内皮生长因子(vascular endothelial growth factor,VEGF)单克隆抗体。基础研究显示,在结 直肠癌中,VEGF存在于整个肿瘤生命周期中, 血管生成与疾病进展、癌症复发转移和总生存下 降相关。临床前及Ⅲ期临床研究均表明BEV可持 续抑制血管生成,对于肿瘤生长有良好的控制, 可为患者带来持续生存获益。AVF2107研究[1]证 实BEV联合IFL方案(伊立替康+5-氟尿嘧啶+四氢 叶酸钙)较单用IFL方案能显著延长无进展生存 时间 (progression-free survival,PFS)和中位生存 时间 (overall survival,OS)。美国食品药品管理 局于2004年批准将BEV作为治疗晚期结直肠癌 (metastatic colorectal cancer,mCRC)的一线治疗 选择。2013年ITACA研究[2]结果表明与单用标准化 疗方案(FOLFOX/FOLFIRI)相比,BEV联合化疗 一线治疗mCRC并不能带来生存获益,BEV的地位 是否会发生变化?本研究总结近年来BEV联合化 疗一线治疗mCRC的Ⅱ期和Ⅲ期随机对照临床研究 (randomized controlled trial,RCT),用Meta分析方 法评估其疗效和安全性,为mCRC临床治疗提供更 多依据。 1 资料与方法 1.1 检索策略
检索相关数据库,英文数据库包括Cochrane Library、PubMed、Embase;中文数据库包括中 国期刊全文数据库(CNKI)、中国生物医学文 献数据库(CBM)、维普中文科技期刊及万方 数据库。检索词包括:结直肠癌、化疗、贝伐珠 单抗、阿瓦斯汀、安维汀和colorectal neoplasms, colorectal cancer,colon neoplasms,rectal neoplasms, chemotherapy,Bevacizumab,Avastin。检索2000年1 月至2013年12月的相关文献。 1.2 文献纳入和排除标准 1.2.1 纳入标准
(1)试验设计:随机对照试验 (randomized control trial,RCT),不论是否采用盲 法;(2)研究对象:经病理确诊为mCRC患者,既 往未曾使用过BEV或类似靶向药物;(3)干预措 施:试验组和对照组化疗方案相同,试验组增加 BEV;(4)观察结果:治疗疗效和化疗药物及靶向 药物相关的不良反应。 1.2.2 排除标准
(1)非RCT;(2)研究对象纳入研 究前曾使用过BEV或类似靶向药物;(3)同时接受 其他靶向治疗方案的研究;(4)BEV联合化疗为二 线治疗方案;(5)观察结果未能提供治疗疗效相关 的不良反应数据。 1.2.3 结局指标
主要研究指标是无进展生存时 间(progression free survival,PFS)和总生存时间 (overall survival,OS),次要研究指标包括有效 率(objective response rate,ORR)和不良反应。 PFS是指化疗开始至肿瘤出现进展或死亡的时间。 OS是指从化疗开始至死亡或末次随诊时间。ORR 是指可评价患者中取得完全缓解或部分缓解的比 例(按RECIST实体肿瘤疗效评价标准)。 1.3 数据提取
对纳入研究文献提取相关数据,包括:(1)基 本数据:题目、作者、发表日期及来源等;(2) 研究设计:患者数量、病理分期及具体化疗方案 等;(3)结局指标:PFS、OS、RR及不良反应。为 确保分析的质量,由两位研究者独立地进行数据 提取。 1.4 质量评价
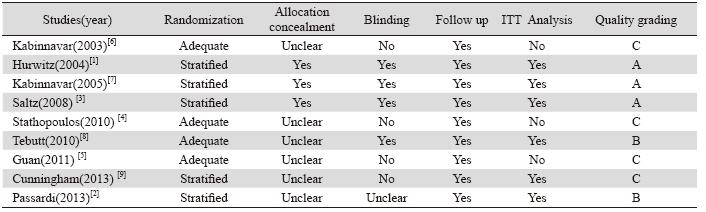
对纳入的临床试验质量评价按Cochrane协作网 偏倚风险评价标准进行。主要从是否随机化、盲 法、分配有无隐藏、随访(失访或退出)及意向 性分析(intension to treat,ITT)等5方面。分为3 个等级,“A”级(低度偏倚):上述标准均为“正确或 充分”者; “B”级(中度偏倚):有1项或1项以上标 准未描述则为不清楚;“C”级(高度偏倚):有1项或 1项以上标准不正确或未使用。 1.5 统计学方法
数据分析采用Stata12.0软件,以相对危险度 (relative risk,RR)和风险比(hazard ratios,HR) 作为效应量,PFS、OS等生存指标由疾病进展风 险(HR of disease progression)、疾病死亡风险 (HR of disease death)进行合并分析,各效应量 以95%置信区间(95%CI)表示。采用卡方检验进 行研究间的非均质性研究,P<0.1为差异有统计 学意义;对研究间的非均质性采用I2定量分析,低 异质性( P≥0.1,I2<30%) ,采用固定效应模型; 高异质性 ( P<0.1,I2≥30%) ,采用随机效应模 型。依据Cochrane协作网的指导方针作为研究偏倚 的评估依据,对研究偏倚采用漏斗图进行鉴定,P <0.05为差异有统计学意义。 2 结果 2.1 检索结果
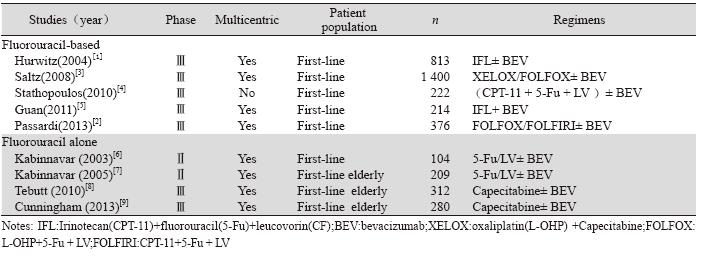
通过检索词初步检出相关文献278篇(中文23 篇,英文255篇);通过阅读文献题目和摘要,排 除不符合要求的文献253篇(例如综述、观察性研 究、Meta分析、非随机研究等),获得文献25篇; 阅读全文排除文献16篇,最终检索出9篇文献[1,2,3,4,5,6,7,8,9], 共3 930例mCRC患者。 2.2 研究特征
检索出2项Ⅱ期临床研究[6,7]和7项Ⅲ期临床研 究[1,2,3,4,5,8,9];8项临床研究[1,2,3,5,6,7,8,9]是多中心临床研究,仅 Stathopoulos等研究[4]是单中心临床研究;均为一 线使用BEV联合化疗,其中3项临床研究[7,8,9]针对老 年mCRC患者;5项临床研究[1,2,3,4,5]化疗方案以氟尿嘧 啶为基础方案,4项临床研究[6,7,8,9]化疗方案是氟尿嘧 啶类单药方案。因Passardi研究[2]中既有FOLFOX 又有FOLFIRI方案,故按化疗强度分为联合或单药 方案,见表 1。
 |
本Meta分析评价“A”级有3项研究[1,3,7],“B”级 有2项研究[2,8],“C”级有4项研究[4,5,6,9],见表 2。
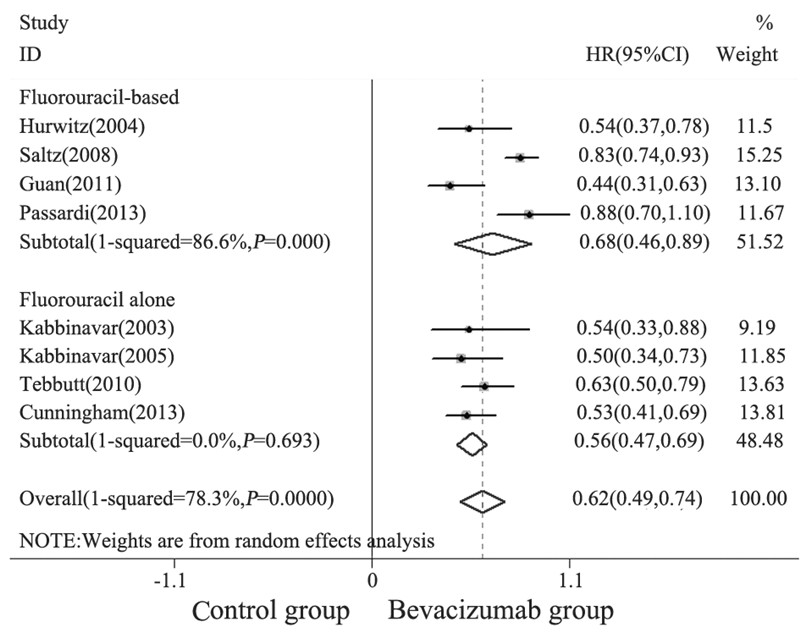
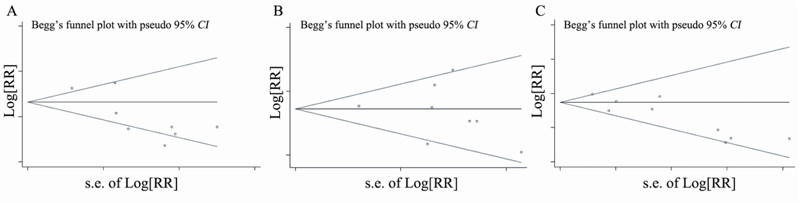
纳入的9项研究中有8项[1,2,3,5,6,7,8,9]报道了 PFS,共3 708例患者。本Meta分析结果显示, BEV联合化疗一线治疗mCRC的PFS与单纯化疗 相比,差异具有统计学意义(HR=0.62,P<0.0001, 95%CI: 0.49~0.74),见图 1。临床研究间异质 性明显(I2=78.3%,P<0.0001),可能与化疗强度 或化疗方案有关。按化疗强度进行亚组分析, 结果显示BEV联合氟尿嘧啶为基础方案或联合 氟尿嘧啶类单药均可降低mCRC患者的疾病进展 风险,差异具有统计学意义(HR=0.68,P<0.001, 95%CI: 0.46~0.89; HR=0.56,P<0.001,95%CI: 0.47~0.64)。BEV联合氟尿嘧啶为基础方案间存 在明显异质性(I2=86.6%,P<0.0001),可能与氟尿 嘧啶为基础联合方案包括氟尿嘧啶类联合奥沙利 铂或伊立替康有关。BEV联合氟尿嘧啶类单药方 案间无异质性(I2=0.0%,P=0.693)。漏斗图显示不 存在明显发表偏倚,见图 2A。
|
| 图 1 贝伐单抗联合化疗治疗转移性结直肠癌患者的PFS的 Meta分析 Figure 1 A Meta-analysis of PFS of metastatic colorectal cancer(mCRC) patients treated with BEV combined with chemotherapy |
|
| 图 2 贝伐单抗联合化疗治疗转移性结直肠癌的无进展生存期(A)、总生存期(B)和缓解率(C)的漏斗图 Figure 2 Funnel plots of PFS(A),OS(B) and ORR(C) of mCRC patients treated with BEV combined with chemotherapy |
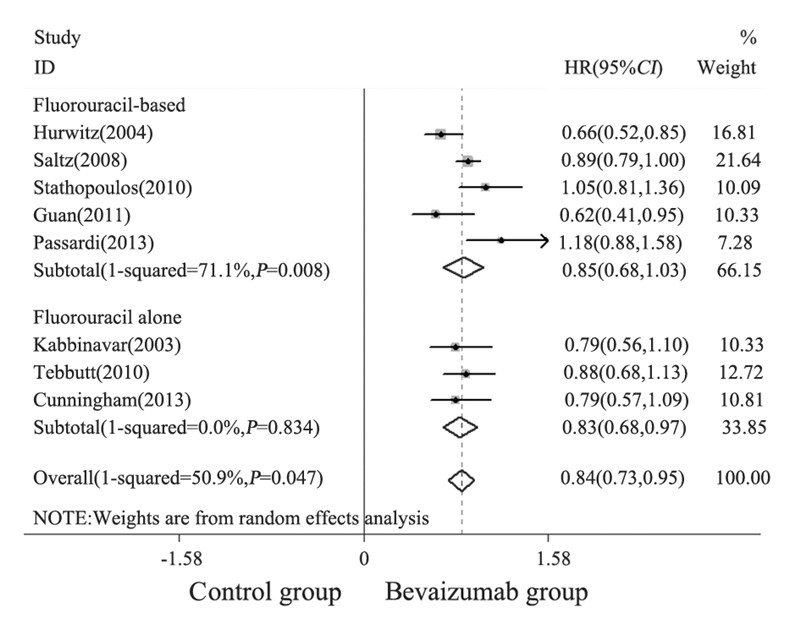
纳入9项研究中8项[1,2,3,4,5,6,8,9]报道了OS, 共3 826例患者。本Meta分析结果显示,BEV 联合化疗一线治疗mCRC的O S 与单纯化疗相 比,差异具有统计学意义(HR=0.84,P<0.001, 95%CI: 0.73~0.95),见图 3。临床研究间有异质 性 (I2=50.9%,P=0.047)。按化疗强度进行亚组 分析,BEV联合氟尿嘧啶为基础方案间存在明 显异质性(I2=71.1%,P<0.0001),结果显示BEV 联合氟尿嘧啶为基础方案没有降低mCRC患者的 疾病死亡风险,差异无统计学意义(HR=0.85, P=0.068,95%CI: 0.68~1.03);而BEV联合氟尿嘧 啶类单药可降低mCRC患者的疾病死亡风险,差 异具有统计学意义(HR=0.83,P<0.001,95%CI: 0.68~0.97)。漏斗图显示不存在明显发表偏倚, 见图 2B。
|
| 图 3 贝伐单抗联合化疗治疗转移性结直肠癌患者的OS的 Meta分析 Figure 3 A Meta-analysis of OS of mCRC patients treated with BEV combined with chemotherapy |
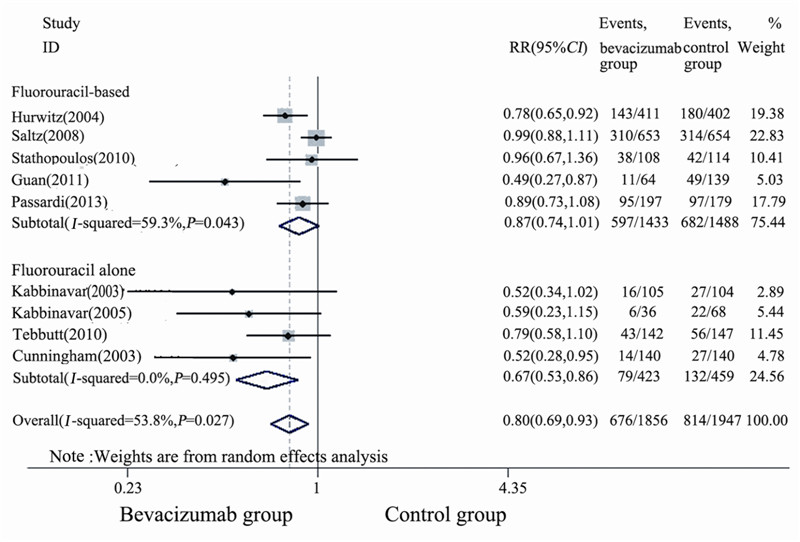
纳入9项研究[1,2,3,4,5,6,7,8,9]均报道了ORR,共 3 803例患者。本Meta分析结果显示,BEV联合 化疗一线治疗mCRC的ORR与单纯化疗相比,差 异具有统计学意义(RR=0.80,P<0.001,95%CI: 0 . 6 0 ~ 0 . 9 3 ) ,见图 4 。临床研究间有异质性 (I2=53.8%,P=0.027),按化疗强度进行亚组分 析,BEV联合氟尿嘧啶为基础方案间存在异质性 (I2=59.3%,P=0.043),结果显示BEV联合氟尿嘧 啶为基础方案没有提高mCRC患者的ORR,差异 无统计学意义(RR=0.87,P=0.055,95%CI: 0.74~ 1.01);而BEV联合氟尿嘧啶类单药可提高ORR, 差异具有统计学意义(RR=0.67,P<0.001,95%CI: 0.53~0.86)。漏斗图显示不存在明显发表偏倚, 见图 2C。
|
| 图 4 贝伐单抗联合化疗治疗转移性结直肠癌的ORR的Meta分析 Figure 4 A Meta-analysis of ORR of mCRC patients treated with BEV combined with chemotherapy |
异质性检验显示仅腹 泻、治疗中断在两组间存在异质性,采用随机 效应模型进行分析;其余采用固定效应模型进 行分析。Meta分析结果显示,与单纯化疗方案 比较,增加了BEV相关不良反应发生率,如: 所有级别高血压(RR=4.20,P<0.00001,95%CI: 3.12~5.65)、高血压(3~4级)(RR=4.80,P <0.00001,95%CI: 3.07~7.51)、胃肠道穿孔(3~4 级)(RR=3.59,P=0.01,95%CI: 1.34~9.60)、 蛋白尿(3~4级)(RR=2.87,P=0.03,95%CI: 1.13~7.25)、血栓性事件(3~4级)(RR=1.35, P=0.02,95%CI: 1.06~1.73),但没有增加治疗中 断(RR=1.22,P=0.34,95%CI:0.81~1.82)和出血 (3~4级)的发生率(RR=1.35,P=0.22,95%CI: 0.83~2.20);也没有增加化疗药物相关不良反应 发生率,如白细胞减少(RR=1.18,P=0.22,95%CI: 0.91~1.52)和腹泻(RR=1.06,P=0.76,95%CI: 0.74~1.51)等,见表 3。
6项研究[1,3,5,7,8,9]报道了治疗相关死亡率,BEV 联合化疗与单纯化疗相比,差异无统计学意义 (RR=0.97,P=0.91,95%CI: 0.62~1.54)。 3 讨论
本Meta分析合并纳入的9项研究[1,2,3,4,5,6,7,8,9]的中位PFS 和OS效应量和95%CI,结果显示,虽然临床研究 间存在异质性,但仍显示出BEV联合化疗可提高 mCRC患者的PFS和OS,可降低38%的疾病进展风 险和16%的死亡风险。为进一步显示化疗强度对 于BEV联合化疗的影响,按化疗强度分为联合或 单药方案进行亚组分析,联合方案包括氟尿嘧啶 类联合奥沙利铂或伊立替康,结果显示BEV联合 氟尿嘧啶为基础方案降低mCRC患者的32%疾病进 展风险,没有降低疾病死亡风险,并且没有提高 ORR;而BEV联合氟尿嘧啶类单药结果显示降低 mCRC患者的44%疾病进展风险和17%死亡风险, 并且提高33%ORR。本Meta分析提示BEV联合标 准化疗方案仅带来边缘生存获益。
从2003年至今已有多项有关BEV联合不同化 疗方案治疗mCRC的临床研究和临床观察,显示其 在延长患者PFS及OS方面较单用化疗具有优势。 但是BEV应用于mCRC的一线治疗在AVF2107 [1]、 ITACA[2]和NO16966[3]这些RCT研究中仍存在一 定争议。AVF2107研究[1]结果表明BEV联合IFL 较单用IFL能够降低44%疾病进展和34%死亡风 险(P<0.001),显著延长患者OS(20.3月vs. 15.6 月,P=0.00003),并提高RR(44.8% vs. 34.8%, P=0.004),然而这些结果并未在随后的BEV联合 标准化疗中完全证实。在NO16966研究[3]中,与单 用FOLFOX或XELOX相比,BEV联合化疗达到主 要研究终点,降低17%疾病进展风险(P=0.0023), OS的有延长趋势(21.3月vs.19.9月),但未达 统计学意义(HR=0.89,95%CI: 0.76~1.03, P=0.077),两组RR相似。NO16966研究未有OS 获益的可能原因:试验组只有29%患者治疗到进 展,而对照组有47%;治疗中止原因主要与化疗 毒性相关,如神经毒性、胃肠道反应、骨髓抑制 等;远超过AVF2107研究[1]中治疗中止患者比率。 在2013年ASCO年会上报道的ITACA研究[2]发现 BEV联合标准化疗方案(FOLFOX/FOLFIRI)一 线治疗不能带来生存获益:与单用标准化疗方案 相比,BEV联合化疗的ORR、PFS和OS均未见改 善。考虑不同的研究间结果不尽相同,可能与不 同的研究采用化疗方案不同、也有可能与BEV缺 乏预测疗效的分子生物标志,不能对优势人群进 行选择有关。
尽管目前RCT研究结果显示BEV联合氟尿 嘧啶为基础一线治疗mCRC并不都能带来生存获 益,但多个一线大型临床观察和汇总分析均显示 BEV联合氟尿嘧啶为基础化疗可为患者带来生存 获益,这些大型临床观察和汇总分析纳入患者 数远远超过RCT研究,或许更能代表我们临床实 践。有两个mCRC一线大型观察性研究-BriTE[10]和 BEAT研究[11],共入组近4 000例患者,BEV联合 FOLFOX、FOLFIRI或XELOX方案,结果显示PFS 约9~12月,OS约2年左右,该研究结论为BEV联合 化疗安全性和有效性均与既往前瞻性临床研究相 似。Hurwitz等[12]基于患者个体资料进行了汇总分 析,共纳入了7项BEV联合化疗的随机对照研究, 其中一线研究有6项(患者总数3 178例),结果 显示,与一线单纯化疗组相比,BEV联合组的中 位PFS明显延长(9.1月vs. 6.9月,P<0.0001),疾病 进展风险降低42%(HR=0.58);BEV联合组的中位 OS明显延长(19.8月vs. 17.6月,P=0.034),疾病死 亡风险降低19%(HR=0.81);亚组分析显示无论是 氟尿嘧啶联合伊立替康还是联合奥沙利铂,氟尿 嘧啶为基础联合化疗均可有显著的PFS优势。该研 究的结论为BEV联合氟尿嘧啶为基础不同化疗方 案疗效无明显差别,能为患者带来更多的生存获 益,提示这些标准一线化疗方案均适合与BEV联 合使用。
Macedo等[13]系统评价BEV联合化疗一线治 疗mCRC的疗效和安全性,与单纯化疗相比, BEV联合化疗治疗mCRC可提高mCRC患者的PFS (HR=0.84,95%CI: 0.77~0.91,P<0.00001)和 OS(HR=0.72,95%CI: 0.66~0.78,P<0.00001)。 Loupakis等[14]和Strickler等[15]研究亦得出相似的结 论。结合以上的研究,虽然2013年ITACA研究是 一个阴性结论,并不能改变BEV在mCRC一线治疗 中的地位。
本Meta分析中单药方案均是氟尿嘧啶类药 物,共纳入了4项临床研究,其中3项是老年患 者,老年患者总数801例(占88.5%),亚组分析结 果显示BEV联合氟尿嘧啶类单药降低mCRC患者的 疾病进展风险和死亡风险。2013年首项BEV联合卡 培他滨一线治疗老年mCRC患者的Ⅲ期研究[9]共入 组280例年龄≥70岁的初治mCRC患者,随机分为 卡培他滨组或BEV联合卡培他滨组。结果显示, 与卡培他滨单药组相比,BEV联合组的中位PFS明 显延长(9.1月vs. 5.1月,P<0.001);BEV联合组的 中位OS有延长趋势(20.7月vs. 16.8月,P=0.182), RR(19.3% vs. 10%,P=0.042)也更高。在安全性方 面,BEV联合卡培他滨组与卡培他滨单药组均无 明显差异。越来越多证据显示对于不适合氟尿嘧 啶为基础联合化疗老年患者来说,BEV联合氟尿 嘧啶类单药是可选治疗之一。
BEV有自己特殊的不良反应,在结直肠癌患 者我们尤其关注出血及穿孔等不良反应发生率。 本Meta分析显示,BEV联合化疗治疗mCRC增加所 有级别高血压的发生率,尤其是3~4级高血压的发 生率;增加蛋白尿、胃肠道穿孔、血栓性事件等 3~4级不良事件的发生率;3~4级的出血发生率多 见于BEV联合组,有增加出血的趋势;没有导致 更多的mCRC患者中止治疗;而且治疗相关死亡率 与单纯化疗组相当,概率较低;没有增加化疗药 物相关不良反应发生率;绝大部分的不良反应是 预期和可控的。与Dai等[16]对15项在mCRC中BEV 联合化疗的研究进行的不良反应发生率Meta分析 结果相似。
本Meta分析表明BEV联合化疗治疗mCRC可降 低疾病进展风险和死亡风险。然而,BEV联合不 同化疗方案所带来生存获益大小不同,尤其BEV 联合标准化疗方案仅带来边缘生存获益。希望在 今后的工作中能够明确BEV的疗效预测标志物和 最适合化疗方案,使得患者获益最大化,真正实 现肿瘤的个体化治疗。
| [1] | Hurwitz H, Fehrenbacher L, Novotny W,et al. Bevacizumab plusirinotecan, fluorouracil, and leucovorin for metastatic colorectalcancer[J].N Engl J Med,2004,350(23):2335-42. |
| [2] | Alessandro P, Emanuela S, Luigi C,et al.Effectiveness ofbevacizumab added to gold standard chemotherapy in metastaticcolorectal cancer (mCRC): Final results from the Itaca randomizedclinical trial[J]. J Clin Oncol, 2013 ASCO Ann Meet Abstr,3517. |
| [3] | Saltz LB, Clarke S, Díaz-Rubio E, et al. Bevacizumab incombination with oxaliplatin-based chemotherapy as first-linetherapy in metastatic colorectal cancer: a randomized phase Ⅲstudy [J]. J Clin Oncol,2008,26(12):2013-9. |
| [4] | Stathopoulos GP, Batziou C, Trafalis D, et al. Treatment ofcolorectal cancer with and without bevacizumab: a phase Ⅲstudy[J].Oncology,2010,78(5-6):376-81. |
| [5] | Guan ZZ, Xu JM, Luo RC, et al. Efficacy and safety ofbevacizumab plus chemotherapy in Chinese patients withmetastatic colorectal cancer: a randomized phase Ⅲ ARTISTtrial[J]. Chin J Cancer, 2011,30(10):682-9. |
| [6] | Kabbinavar F, Hurwitz HI, Fehrenbacher L, et al. Phase Ⅱ,randomized trial comparing bevacizumab plus fluorouracil (FU)/leucovorin (LV) with FU/LV alone in patients with metastaticcolorectal cancer[J]. J Clin Oncol, 2003,21(1):60-5. |
| [7] | Kabbinavar FF, Schulz J, McCleod M, et al. Addition ofbevacizumab to bolus fluorouracil and leucovorin in first-linemetastatic colorectal cancer: results of a randomized phase Ⅱ trial[J].J Clin Oncol, 2005,23(16):3697-705. |
| [8] | Tebbutt NC, Wilson K, Gebski VJ, et al. Capecitabine,bevacizumab, and mitomycin in first-line treatment of metastaticcolorectal cancer: results of the Australasian GastrointestinalTrials Group Randomized Phase Ⅲ MAX Study[J].J Clin Oncol,2010,28(19):3191-8. |
| [9] | Cunningham D, Lang I, Marcuello E, et al. Bevacizumab pluscapecitabine versus capecitabine alone in elderly patients withpreviously untreated metastatic colorectal cancer (AVEX): anopen-label, randomised phase 3 trial[J].Lancet Oncol,2013,14(11):1077-85. |
| [10] | Kozloff M, Yood MU, Berlin J, et al.Clinical outcomes associatedwith bevacizumab-containing treatment of metastatic colorectalcancer: The BRiTE observational cohort study[J]. Oncologist,2009,14(9):862-70. |
| [11] | Van Cutsem E, Rivera F, Berry S, et al. Safety and efficacy offirst-line bevacizumab with FOLFOX, XELOX, FOLFIRI andfluoropyrimidines in metastatic colorectal cancer: the BEATstudy[J].Ann Oncol,2009,20(11):1842-7. |
| [12] | Hurwitz HI, Tebbutt NC, Kabbinavar F, et al. Efficacy andsafety of bevacizumab in metastatic colorectal cancer: pooledanalysis from seven randomized controlled trials[J].Oncologist,2013,18(9):1004-12. |
| [13] | Macedo LT, da Costa Lima AB, Sasse AD. Addition ofbevacizumab to first-line chemotherapy in advanced colorectalcancer: a systematic review and meta-analysis, with emphasis onchemotherapy subgroups[J].BMC Cancer, 2012,12:89. |
| [14] | Loupakis F, Bria E, Vaccaro V, et al. Magnitude of benefit of theaddition of bevacizumab to first-line chemotherapy for metastaticcolorectal cancer: meta-analysis of randomized clinical trials[J].JExp Clin Cancer Res,2010, 29:58. |
| [15] | Strickler JH, Hurwitz HI. Bevacizumab-based therapies in thefirst-line treatment of metastatic colorectal cancer[J].Oncologist,2012,17(4):513-24. |
| [16] | Dai F, Shu L, Bian Y, et al. Safety of bevacizumab in treatingmetastatic colorectal cancer: a systematic review and meta-analysisof all randomized clinical trials[J].Clin Drug Investig,2013,33(11):779-88. |
 2014, Vol. 41
2014, Vol. 41