2.伊犁友谊医院消化内科;
3.新疆 生产建设兵团农四师医院消化内科
2.Department of Gastroenterology, Friendship Hospital of Yili;
3.Department of Gastroenterology,The Fourth Hospital of Xinjiang Production and Construction Corps
我国是食管癌发病率和死亡率最高的国家, 新疆是我国食管癌高发区之一,而在新疆居住的 13个民族中哈族食管癌的发病率(155.9/10万)[1] 和死亡率(68.88/10万)[2]均高于其他民族。目前 认为哈族食管鳞癌的高发主要与其特殊的饮食生 活习惯如大量饮酒、喝热奶茶、酸奶疙瘩、饮食 快、饮食粗糙等相关[3]。
smad4基因是由Hahn发现的[4],该基因是定位 于胰腺癌染色体18q21.1上的一种抑癌基因。抑癌 基因启动子区CPG岛发生高甲基化是基因失活的 重要机制,而基因失活可导致肿瘤的发生[5]。 1 资料和方法 1.1 临床资料
组织标本来源于2009年1月—2011年12月新疆 哈萨克自治州新源县人民医院就诊的食管癌患者, 由新疆石河子大学医学院第一附属医院经内镜病 理诊断为食管鳞癌,其中哈族食管鳞癌和正常食 管组织分别为37和33例;汉族食管鳞癌和汉族正常 食管组织分别为31和33例。所有患者均未行放 、 化疗和手术治疗。其中男66例,女68例,年龄分布 30~80岁,中位年龄55岁。组织学分级高、中、低 分化食管鳞癌分别为21、25、22例。 1.2 方法 1.2.1 引物设计
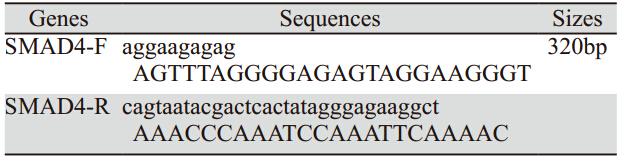
内参β-actin引物由上海生工生物 有限公司设计合成,甲基化引物使用Sequenom公 司Epidesigner设计软件对smad4基因启动子区CpG 片段扫描、设计引物。引物扩增片段为320bp,见 表 1。引物序列用PCR扩增,在正向引物5’端加入 10mertag,用于平衡PCR反应条件;反向引物5’端 加入T7-Promoter 序列,用于后续的体外转录。
|
|
表 1 smad4基因甲基化引物序列 Table 1 The primer sequences of smad4 gene methylation |
取50 mg组织标本,研磨成粉末 状,加入裂解液、蛋白酶K等,56℃过夜,第二天用 QIAGENDNA提取试剂盒提取DNA并收集约50μg DNA样本,内参β-actin用于检测DNA,所有DNA应 用分光光度计定量,电泳主带明显没有降解,浓度 高于75ng/μl,总量不小于2μg,A260/A280=1.7~2.1,质 检合格DNA样本于-20℃冰箱保存,见图 1。
 |
1-8:esophageal squamous cell carcinoma tissues of the Kazaks
图1 哈萨克族食管癌组织中DNA提取
Figure 1 DNA extraction from the ESCC tissues of the Kazaks |
DNA样 本亚硫酸处理应用EZDNAMethylation-GoldKit, ZYMO试剂盒,PCR扩增应用PCR Accessory Set试 剂盒,将5'-primer-(T7)primer混合成primerMAX使 用,终浓度为1μmol/L。 1.2.4 碱性磷酸酶处理及体外转录、RNase酶切、 纯化、点样及质谱分析
应用MassCLEAVEKit 试剂盒对样本进行碱性磷酸酶处理及体外转录 和RNase酶切。应用MassARRAYNanodispenser RS1000点样仪将纯化后的产物点至3 8 4格式 的Spectr oCHI P芯片上,最后将芯片放入Mass ARRAY Compact System进行检测。SpectroCHIP芯 片使用MALDI-TOF基质辅助激光解吸附电离飞行 时间质谱分析技术,通过EpiTYPER软件完成数据 分析。 1.3 统计学方法
应用SPSS17.0统计学软件对数据进行分析, 两独立样本Wilcoxon秩和检验对两样本间甲基化 率进行比较,P<0.05为差异有统计学意义。 2 结果 2.1 食管癌组织smad4基因启动子区总体平均甲基 化率的比较
汉族食管癌组和对照组、哈族食管癌组和对 照组中smad4基因启动子区平均甲基化率分别为 3.4%和2.8%(P=0.488)、3.4%和2.5%(P=0.271),差 异均无统计学意义。 2.2 食管癌组织smad4基因启动子区不同CPG位点甲基化率比较
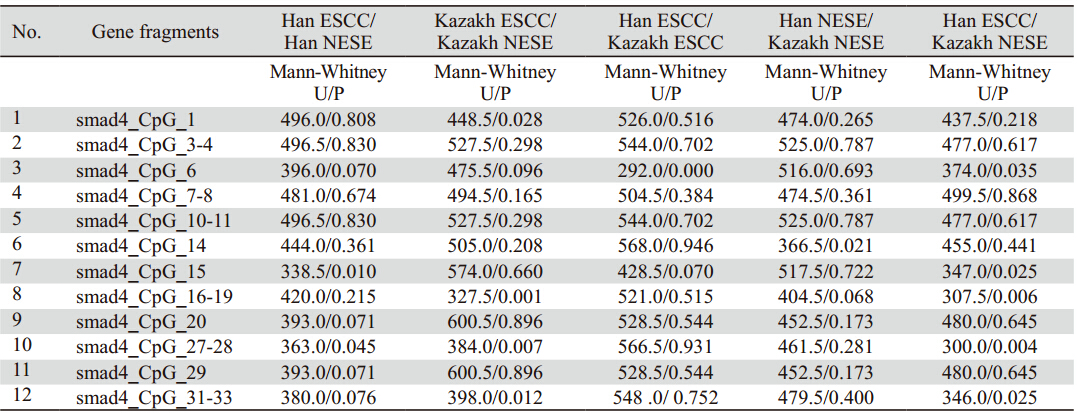
smad4基因启动子区CpG-15、CpG-27的平 均甲基化率在汉族食管癌中(4.7%、4.9%)明 显高于正常对照组(2.8%、3.5%)(P=0.018、 0.045);CpG- 1、CpG- 16- 19、CpG- 27- 28、 C p G - 3 1 - 3 3在哈族食管癌中的平均甲基化率 (1.7%、4.5%、4.9%、6.8%)明显高于正常对照组的(0.7%、2.2%、3.0%、5.5%)(P=0.028、 0.001、0.007、0.012),CpG-6在哈族食管癌中 的平均甲基化水平(1.9%)明显高于汉族食管癌 (0.4%)(P=0.000);CpG-14在哈族正常组织 中的平均甲基化水平(6.2%)与在汉族正常组织 中的甲基化水平也有差异(7.3%)(P=0.021); CpG- 6、CpG- 15、CpG- 16- 19、CpG- 27- 28、 Cp G- 3 1 - 3 3在哈族正常组织中的平均甲基化率 (1.1%、3.1%、2.2%、3.1%、5.5%)与在汉族食 管癌组织中的平均甲基化率的差异(0.4%、4.8%、 4.1%、4.9%、7.6%)也有统计学意义(P=0.035、 0.025、0.006、0.004、0.025),见表 2。
|
|
表 2 哈萨克族和汉族病例SMAD4基因CpG片段甲基化水平的Wilcoxon W秩和检验 Table 2 Wilcoxon W rank-sum test of methylation levels of CPG sites in smad4 gene in the Kazaks and the Hans |
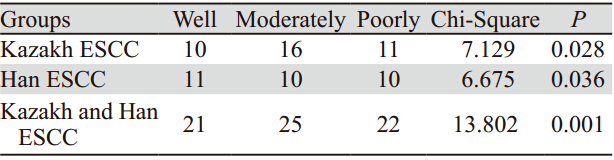
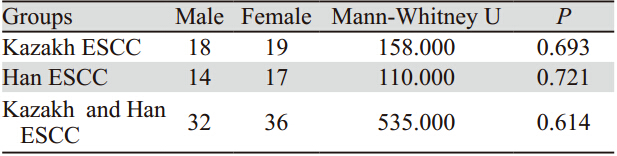
smad4基因在汉族、哈族食管鳞癌组织中的不 同的分化程度的平均甲基化率的差异有统计学意 义,且随分化程度增高甲基化率降低。但smad4基 因在汉族、哈族食管癌组织不同性别中的甲基化 率的差别没有统计学意义,见表 3~4。
|
|
表 3 食管癌患者smad4基因启动子区总甲基化率在不同分化程度之间的差异 Table 3 Differences of total methylation rates of smad4 gene promoters at different differentiated degrees in esophageal cancer patients |
|
|
表 4 食管癌患者smad4基因启动子区总甲基化率在不同性别之间的差异 Table 4 Differences of total methylation rates of smad4 gene promoters in different gender of esophageal cancer patients |
遗传学和表观遗传学的改变是影响肿瘤形成 的两大机制,DNA甲基化是一种重要的表观遗传 学现象。DNA启动子区高甲基化存在于多种肿 瘤中,可作为肿瘤诊断、预防、治疗、预后判断 的指标[6,7,8]。在食管鳞癌中也存在多种基因的异常 甲基化,如P16、MGMT、Hmlh1、RASSF1A、 hMSH2、RIZ1 [9,10,11]等,均说明基因异常甲基化与 食管癌的发生有关。转化生长因子β(TGF-β)在 细胞的生长、增殖、分化、凋亡、基质产生、肿 瘤形成等过程中均起着重要的作用,TGF-β/smad 信号传导通路能通过抑制肿瘤细胞增殖从而抑制 肿瘤的发生、发展[12],smad4基因表达产物smad4 蛋白是TGF-β/smad信号传导通路中的组成成分, smad4基因缺失或突变可引起肿瘤细胞逃避TGF-β 对肿瘤细胞增殖的抑制作用引起肿瘤的发生[13]。
本实验采用MassARRAY甲基化DNA定量分 析技术检测食管鳞癌组织中smad4基因的甲基化水 平,共分析了33个CpG位点,12个CpG单位。试验 结果中汉族食管癌组和对照组、哈族食管癌组和 对照组中smad4基因启动子区CpG位点的平均甲基 化率的差异不明显,但总体甲基化率之间的差异对试验结论的影响较小,总体中存在每个位点的甲 基化率,试验中研究的是个别位点的甲基化率。郭 炜[14]和董稚明[15]等分别对汉族贲门腺癌和食管鳞癌中 smad4基因甲基化状态进行分析,发现smad4基因在启 动子区发生了高甲基化并使smad4基因沉默,导致肿 瘤的发生,这与本试验结果相近。
汉族食管癌组织中smad4基因启动子区CpG-15、CpG-27的平均甲基化率(4.7%、4.9%) 明显高于对照组(2.8%、3.5%),表明这两个位点 的高甲基化可能与汉族食管鳞癌的发生有关,可以 作为汉族食管鳞癌的诊断标志物,可通过大样本 试验来判断其对汉族食管癌诊断的意义;CpG-1、 CpG-16-19、CpG-27-28、CpG-31-33的平均甲基化 率在哈族食管癌组(1.7%、4.5%、4.9%、6.8%) 明显高于哈族正常对照组(0.7%、2.2%、3.0%、 5.5%),故这四个位点的高甲基化可能参与了哈 族食管癌的发生;CpG-6在哈族食管癌和哈族正 常组织中的平均甲基化水平(1.9%,1.1%)均明显高 于汉族食管癌组(0.4%),CpG-15、CpG-16-19、 CpG-27-28、CpG-31-33的平均甲基化率在哈族对照 组(3.1%、2.2%、3.1%、5.5%)与在汉族食管癌组 (4.8%、4.1%、4.9%、7.6%)的差异也有统计学意 义。故CpG-6的高甲基化可能参与了哈族食管癌的 发生,是哈族食管鳞癌的高危因素,可能是哈族较 汉族食管鳞癌高发的关键性原因之一。因为哈族食 管鳞癌高发,那么理论上就可能会存在某个CpG位 点的甲基化率在哈族食管鳞癌组或哈族对照组中较 在汉族食管组织中高,本试验中发现的CpG-6很可 能是哈族smad4基因特异的高甲基化位点之一,这一 发现若得到证实将对哈族食管癌患者有重要意义。
smad4基因在汉族、哈族食管鳞癌组织中不同 分化程度的平均甲基化率差异有统计学意义,且随 分化程度增高甲基化率降低;smad4基因在汉族、 哈族食管癌不同性别中甲基化率差别没有统计学意 义。故smad4基因启动子区高甲基化不仅参与了食 管鳞癌的发生,还可能与食管鳞癌的发展有关系, 可作为食管鳞癌诊断及治疗的指标。由于试验时间 有限,目前随访工作正在进行,smad4基因是否可 以作为食管鳞癌预后监测的指标尚需继续验证。
研究发现甲基化是可逆的,因此应用去甲基化 剂来抑制癌细胞的增殖成为治疗食管鳞癌的新方 法。CpG-6对哈族食管鳞癌高发的原因研究中有重 要意义,需进一步探索研究。随着对肿瘤抑制基因 启动子区甲基化研究的深入,找到与食管鳞癌密切 相关的基因对食管鳞癌患者的预防、诊治、指导放 化疗及新药的开发等方面均有很大意义。
| [1] | Li JY. Epidemiology of esophageal cancer in China[J]. Natl Cancer Inst Monogr,1982,62:113-20. |
| [2] | Zhang YM. The distribution of esophageal cancer in Xinjiang[J]. Xinjiang Yi Ke Da Xue Xue Bao, 1988,11(2):139-45.[张月明.新 疆食管癌的分布[J].新疆医科大学学报,1988,11(2):139-45.] |
| [3] | Zhang HX, Chen Y, Yin D, et al. Exploration of the risk factors of esophageal cancer in Xinjiang kazak nationality[J]. Xian Dai Yu Fang Yi Xue,2009,36(10):1804-6. [张慧霞,陈艳,尹东, 等. 新疆哈萨克族食管癌危险因素的探讨[ J ] .现代预防医学,2009,36(10):1804-6.] |
| [4] | Hahn SA, Schutte M, Hoque AT, et al. DPC4, a candidate tumor suppressor gene at human chromosome 18q21.1[J]. Science,1996, 271(5247):350-3. |
| [5] | Jain PK. Epigenetics: the role of methylation in the mechanism of action of tumor suppr essor genes[ J] . Ann N Y Acad Sci,2003,983:71-83. |
| [6] | Jones PA, Laird PW. Cancer epigenetics comes of age[J]. Nat Genet,1999,21(2):163-7. |
| [7] | Roossink F, de Jong S, Wisman GB, et al. DNA hypermethylation biomarkers to predict response to cisplatin treatment, radiotherapy or chemoradiation: the present state of art[J]. Cell Oncol (Dordr), 2012,35(4):231-41. |
| [8] | Chen J, Huang ZJ, Duan YQ, et al. Aberrant DNA methylation of P16, MGMT, and hMLH1 genes in combination with MTHFR C677T genetic polymorphism and folate intake in esophageal squamous cell carcinoma[J]. Asian Pac J Cancer Prev,2012,13(10):5303-6. |
| [9] | Mao WM, Li P, Zheng QQ, et al. Hypermethylation-modulated downr egulation of RASSF1A expr ession is associated with the progression of esophageal cancer[J]. Arch Med Res,2011,42(3):182-8. |
| [10] | Zhang GY, Ma CX, Liu QL, et al. Detection of methylation of h MSH2 gene promoter region of esophageal cancer[J]. Zhonghua Zhong Liu Za Zhi,2005,27(9):541-3. [张功员,马春晓,刘秋亮,等. 食管癌组织中hMSH2基因启动子区甲基化检测[J].中华肿瘤杂志, 2005,27(9):541-3.] |
| [11] | Hata A, Shi Y, Massagué J. TGF-beta signaling and cancer: structural and functional consequences of mutations in Smads[J]. Mol Med Today,1998,4(6):257-62. |
| [12] | Bierie B, Moses HL. TGF-beta and cancer[J]. Gytokine Growth Factor Rev,2006,17 (1-2):29-40. |
| [13] | Guo W, Dong ZM, Guo YL, et al. CpG island methylation of Smad4 gene in gastric cardia adenocarcinoma[J]. Ai Bian·Ji Bian·Tu Bian,2011,23(4):269-74.[郭炜,董稚明,郭艳丽,等. 贲 门腺癌中Smad4基因甲基化状态分析[J]. 癌变·畸变·突变, 2011,23(4):269-74.] |
| [14] | Dong ZM, Guo W, Guo YL, et al. Methylation status of CpG island of Smad4 gene in esophageal squamous cell carcinoma[J]. Zhongguo Zhong Liu Sheng Wu Zhi Liao Za Zhi,2010,17(6):597-603.[董稚明,郭炜,郭艳丽,等.食管鳞状细胞 癌中Smad4基因CpG岛甲基化状态分析[J].中国肿瘤生物治疗 杂志,2010,17(6):597-603.] |
 2014, Vol.41
2014, Vol.41