2.中南大学湘雅医院卫生部肿瘤蛋白质组学重点实验室
2. Key Laboratory of Cancer Proteomics of Chinese Ministry of Health
近年来 ,我国恶性淋巴瘤的发病率不断增长,多种亚型的淋巴瘤患者5年生存率不足 50%[1]。除了化疗、单克隆抗体治疗外,基因治疗 也是目前淋巴瘤治疗的研究热点之一。尽管肿瘤 的基因治疗取得了许多成果,但仍然面临许多的 问题与挑战,其中最主要的问题是目的基因靶向 性较差与表达效率较低。本课题组前期研究已证 实survivin启动子在淋巴瘤细胞中具有较高的特异 性[2],很大程度上解决了肿瘤基因治疗的靶向性 问题,但是相对于通常使用的巨细胞病毒启动子 (CMV)而言,survivin启动子的活性较弱,目的基 因表达量不能满足临床治疗需要。
研究资料显示二步转录放大系统(two-step transcriptional amplification,TSTA)和土拨鼠肝 炎病毒转录后调控元件(woodchuck hepatitis virus posttranscriptional regulatory element,WPRE)能 通过不同方式增强目的基因表达。TSTA系统是一 种嵌合型转录因子,由酵母GAL4-DNA结合域、 Ⅰ型单纯疱疹病毒即刻早期反式作用因子VP16激 活结构域及含有5个GAL4结合域和E4TATA盒的 启动元件G5E4T组成[3]。WPRE是一种基因转录 后调控因子。应用基因重组技术构建的含VP16-GAL4与WPRE的整合型系统性基因表达信号扩增 器(VP16-GAL4-WPRE integrated systemic amplifier, VISA)可以大幅提高目的基因的表达效率。本研 究中我们拟构建survivin启动子与WPRE、TSTA和 VISA系统分别构成的表达质粒,通过比较淋巴瘤 细胞转染后的荧光素酶表达水平,选择在淋巴瘤 细胞中具有较高表达效率的信号放大系统,为进 一步研究淋巴瘤基因治疗奠定基础。 1 材料与方法 1.1 材料 1.1.1 质粒
pGL3-Survivin质粒由本科室唐友红博士 惠赠[2],pCMVgDWPRE质粒由意大利帕尔马大学Dr Gaetano Donofrio惠赠[4],TSTA-NSN质粒由美国加州 大学洛杉矶分校医学院Dr Mike Carey惠赠[5],pGL3-CMV、pGL3-Basic质粒购自Promega公司。 1.1.2 细胞
人淋巴瘤Ramos、U937、 Raji细胞 株购自上海麦莎生物科技有限公司,人肝细胞株 Chang Liver购自中科院上海生命科学院细胞所。 1.1.3 试剂
实验所用内切酶均为N E B( N e w England Biolabs公司)产品,连接酶(宝灵曼B.M公 司),DNA连接酶、luciferase assay system试剂盒、 TD-20/20荧光检测计(Promega公司)。新生小牛 血清(杭州四季青生物公司),DMEM、RPMI 1640 培养液(美国Gibco公司),质量小量提取试剂盒(美 国Omega公司)、胶回收试剂盒(TaKaRa公司), Lipofectamine 2000脂质体购自Invitrogen公司。 1.2 方法 1.2.1 WPRE基因扩增
根据pCMVgDWPRE质粒 序列设计WPRE上下游引物,由上海英骏生物技术 有限公司合成。上游引物序列为:5'-TGTCTAGAATCAACCTCTGGATTAC-3’,下游引物序列为: 5'-CATCTAGACCAGGCGGGGAGGCGGC-3’, 上、下游引物5'端带有Xba Ⅰ酶切位点(用下划线 标示)。以pCMVgWPRE质粒为模板扩增WPRE 基因,PCR反应条件为:95℃ 5 min;94℃ 30 s, 55℃ 30 s,72℃ 1 min,30个循环;72℃ 8 min。 反应结束后,取PCR产物5 μl电泳,并送上海生工 生物工程技术服务有限公司作DNA测序。 1.2.2 pGL3-Survivin-WPRE(S-WPRE)载体构 建
WPRE基因PCR产物经XbaⅠ酶切、纯化后, 应用T4 DNA连接酶与pGL3-Survivin载体经Xba Ⅰ 酶切、纯化后的产物进行连接,构建成S-WPRE载 体,经PCR及XbaⅠ酶切鉴定并送上海英骏生物技 术有限公司纯化测序。 1.2.3 pGL3-Survivin-TSTA(S-TSTA)载体的构 建
KpnⅠ和NheⅠ双酶切TSTA-NSN和pGL3-survivin质粒,回收约6 000 bp的TSTA载体片段和 约1 000 bp的survivin启动子片段,用T4 DNA连接 酶连接,构建成S-TSTA载体,利用PCR及双酶切 (KpnⅠ/NheⅠ)鉴定。 1.2.4 pGL3-survivin- VISA(S-VISA)载体构 建
(1)pGL3-G5E4T-WPRE载体的构建:根据 TSTA-NSN质粒序列设计G5E4T片段上下游引物, 由上海英骏生物技术有限公司合成。上游引物序 列为:5'-TGGGTACCTGCCTGCAGGTCCGGAG-3’,下游引物序列为:5'-GGTCGACTTACTTAGATCGCAGATT-3’,上下游引物5'端分别带有Kpn Ⅰ、SalⅠ酶切位点(用下划线标识)。以TSTANSN为模板扩增G5E4T。PCR反应条件为:95℃ 5 min;94℃ 30 s,53.5℃ 30 s,72℃ 30s 30个循 环,72℃ 8 min。反应结束后,取PCR产物5 μl电 泳分析结果。 KpnⅠ和SalⅠ双酶切G5E4T片段 PCR产物,连入KpnⅠ和XhoⅠ双酶切的S-WPRE 载体(SalⅠ酶切后的末端可以和XhoⅠ酶切后的 末端钝性连接)构建成pGL3-G5E4T-WPRE过渡载 体。利用KpnⅠ及HindⅢ酶切鉴定(因钝性连接 后XhoⅠ已被破坏)。(2) S-VISA载体的构建: KpnⅠ和SalⅠ双酶切pGL3-S-TSTA和pGL3-G5E4TWPRE载体,回收约4 800 bp的S-TSTA片段(保留 了survivin启动子、除G5E4T外的TSTA系统和部分 载体序列)和约2 800 bp的G5E4T-WPRE片段(保 留了G5E4T、荧光素酶编码基因、WPRE和poly A 序列)。用T4 DNA连接酶连接,构建成S-VISA载 体。利用PCR及双酶切(KpnⅠ/SalⅠ)鉴定。 1.2.5 质粒转染与荧光素酶检测
取对数生长期 的Ramos细胞及Chang Liver细胞,用脂质体法分别 瞬时转染重组质粒pGL3-CMV (阳性对照组)、pGL3-survivin /S-WPRE/S-TSTA/S-VISA(实验组)和pGL3-basic(阴性对照组),转染方法按照Lipof ectamine 2000操作说明进行。48 h按照luciferase assay system试剂盒的步骤进行细胞裂解液制备,并用TD-20/20 荧光检测计进行荧光素酶检测。 1.3 统计学方法
本实验中所有数据均采用均数±标准差(x±s) 表示。应用SPSS16.0软件,各组数据进行分析比 较,以α=0.05为检验标准。多组间比较采用OneWay ANOVA检验,多个样本均数间两两比较采用 S-N-Kq检验法,相关分析采用直相关计算Pearson 相关系数,P<0.05为差异有统计学意义。 2 结果 2.1 WPRE序列测序结果
以pCMVgWPRE质粒为模板扩增WPRE基因, 扩增产物进行测序,所得序列结果(图略)与 GenBank报道的完全一致。 2.2 重组载体的鉴定
重组载体S-WPRE、S-TSTA及S-VISA的酶切鉴定, 见图 1~3。同时测序结果显示S-WPRE载体构建成功。
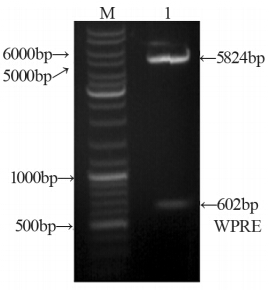 |
S-WPRE:pGL3-survivin-WPRE; Lane1: S-WPRE vector digested by
XbaⅠ; M:MBI DNA ladder SM0331
图1 重组载体S-WPRE酶切鉴定图
Figure 1 Rest rict ion enzyme digest ion analysis of
recombinant vector S-WPRE |
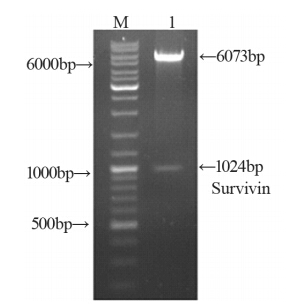 |
S-TSTA: pGL3-survivin-TSTA; Lane1: S-TSTA vector digested by
KpnⅠ and NheⅠ; M: MBI DNA ladder SM0331
图2 重组载体S-TSTA酶切鉴定图
Figure 2 Rest rict ion enzyme digest ion analysis of
recombinant vector S-TSTA |
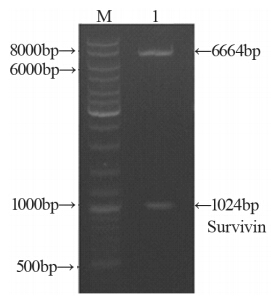 |
S-VISA: pGL3-survivin-VISA; Lane1: S-VISA vector digested by Kpn
Ⅰand NheⅠ; M: MBI DNA ladder SM0331
图3 重组载体S-VISA酶切鉴定图
Figure 3 Rest rict ion enzyme digest ion analysis of
recombinantvector S-VISA |
以pGL3-CMV为阳性对照(100%),pGL3-Basic 为阴性对照,荧光素酶检测结果,见表 1。转染 S-WPRE后Ramos、U937、Raji及chang liver细胞的 荧光素酶表达水平均明显低于转染pGL3-CMV细 胞(P<0.01);转染S-TSTA、S-VISA后Ramos、 U937、Raji细胞的荧光素酶表达水平均高于转染 pGL3-CMV细胞(P<0.01),而Chang Liver细胞中 的表达水平低于转染pGL3-CMV细胞(P<0.01)。 转染S - VSIA后Ramos、U937、Raji细胞 中的荧光素酶表达水平高于转染S - TSTA细胞 (P<0.05),而在Chang Liver细胞中表达水平差 异无统计学意义(P>0.05)。
|
|
表 1 S-VISA、S-TSTA、S-WPRE及pGL3-CMV在不同细胞中的荧光素酶活性 Table 1 The luciferase activities of recombinant vectors S-VISA, S-TSTA, S-WPRE and pGL3-CMV in different cells |
目前应用于淋巴瘤基因治疗的目的基因表达 量较低,不能满足治疗基因高水平表达的需求。 因此,提高目的基因在淋巴瘤细胞中的表达水平 成为进一步临床应用必需要解决的问题。
目的基因表达要经过基因激活、转录、翻译等 多个阶段,这些阶段受到多种调节因素影响。组织 特异性启动子能驱动转录因子VP16-GAL4,增强下 游目的基因表达,VP16-GAL4增强的转录信号通过 与G5E4T结合而再次放大,进一步提高目的基因表 达水平。Iyer等[6]在前列腺癌LNCaP细胞系中应用 TSTA系统来增强前列腺特异性抗原启动子的转录 活性,驱动荧光素酶基因及突变型Ⅰ型单纯疱疹病 毒(herpes simplex virus,HSV1)胸苷激酶(HSV1-sr39tk)基因,结果显示荧光素酶活性提高了约50 倍,HSV1-sr39tk活性提高了约12倍。Song等[7]研究表 明,含人端粒酶反转录酶启动子(human telomerase reverse transcriptase promoter,hTERTp)与TSTA的 重组质粒能使hTERTp在hTERTp阳性卵巢癌细胞中 的转录活性提高200倍左右,进而促进靶基因表达增强。本研究结果也证实TSTA系统促进了淋巴瘤 Ramos、Raji、U937细胞中的荧光素酶表达,其表达 水平高于转染pGL3-CMV的细胞。
WPRE是一种转录后调控因子,将其插入目的 基因下游可以增强目的基因mRNA转录后蛋白的 翻译,增加目的基因编码蛋白的表达量。Sims等[8] 在鼠神经细胞中将WPRE插入目的基因下游,实 验结果显示目的基因编码蛋白表达量提高了8倍。 Mariati等[9]研究证实WPRE在人胚肾HEK293细胞 中的转录后调控作用。本研究结果显示单独转染 WPRE促进荧光素酶表达的能力弱于CMV启动子。
Xie等[10]利用TSTA和WPRE构建出VISA系统 表达载体,以胆囊收缩素A受体(CCKAR)启动 子作为胰腺癌特异性启动子介导荧光素酶报告基 因转染胰腺癌细胞及正常胰腺导管上皮细胞,结 果显示,使用C-VISA作为基因表达载体驱动报告 基因表达的效率明显高于使用C-TSTA及单独使用 CCKAR启动子。Sher等[11]在肺癌基因治疗研究中 发现,在鼠肺癌TC-1细胞中联合了VISA系统的 survivin启动子活性持续性增强,S-VISA的启动子 活性比单独的survivin启动子提高了17倍,并且其 促进目的基因表达的效率明显高于CMV启动子。 卵巢癌基因治疗研究中得出类似的结论[12]。本研 究也发现S-VISA能促进荧光素酶表达,且效率高 于CMV启动子,与前述研究结果一致。
在本研究中,我们成功构建了S - WP R E、 S-TSTA及S-VISA表达质粒,以其转染淋巴瘤细胞, 荧光素酶检测结果表明,相对于CMV、S-WPRE和 S-TSTA,S-VISA在淋巴瘤细胞Ramos、U937、Raji 中驱动荧光素酶表达具有明显的优势,同时保持了 survivin启动子的淋巴瘤特异性,证实了Survivin启 动子和VISA放大系统的联合可以作为一种淋巴瘤 特异性高效基因表达载体,为进一步研究淋巴瘤基 因治疗提供了良好的实验依据和新的思路。
| [1] | Murawski N, Zwick C, PfreundschuhM. Unresolved issues in diffuse large B-cell lymphomas[J].Expert Rev Anticancer Ther, 2010, 10(3):387-402. |
| [2] | Tang YH, Zhong MZ, Liu W, et al. Clone of the Survivin promoter and its specific transcriptional activity in human lymphoma cells[J]. Bai Xue Bing·Lin Ba Liu, 2010, 19(2): 84-7. [唐友红,钟 美佐,刘巍,等. 人类生存蛋白启动子的克隆及其在淋巴瘤细胞 中的转录活性研究[J].白血病·淋巴瘤, 2010, 19(2): 84-7.] |
| [3] | Ray S, Paulmurugan R, Patel MR, et al.Noninvasive imaging of therapeutic gene expression using a bidirectional transcriptional amplification strategy[J]. Mol Ther, 2008, 16(11):1848-56. |
| [4] | Donofrio G, Cavirani S, Vanderplasschen A, et al. Recombinant bovine herpesvirus 4 (BoHV-4) expressing glycoprotein D of BoHV-1 is immunogenic and elicits serum-neutralizing antibodies against BoHV-1 in a rabbit model[J]. Clin Vaccine Immunol, 2006, 13(11):1246-54. |
| [5] | Zhang L, Adams JY, Billick E, et al. Molecular engineering of a two-step transcription amplification(TSTA) system for transgene delivery in prostate cancer[J]. Mol Ther, 2002, 5(3):223-32. |
| [6] | Iyer M, Wu L, Carey M,et al. Two-step transcriptional amplification as a method for imaging reporter gene expression using weak promoters[J]. Proc Natl Acad Sci U S A, 2001, 98(25):14595-600. |
| [7] | Song Y, Shen K, He CX. Construction of autocatalytic caspase-3 driven by amplified human telomerase reverse transcriptase promoter and its enhanced efficacy of inducing apoptosis in human ovarian carcinoma [J]. Zhonghua Fu Chan Ke Za Zhi, 2007, 42(9):617-22. [宋悦,沈铿,何春霞.人端粒酶逆转录酶 启动子-二步转录增强系统调控下的活性半胱氨酸天冬氨酸蛋白酶3的构建及其对卵巢上皮性癌的治疗作用[J]. 中华妇产科杂志, 2007, 42(9):617-22.] |
| [8] | Sims K, Ahmed Z, Gonzalez AM, et al. Targeting adenoviral transgene expression to neurons[J]. Mol Cell Neurosci, 2008, 39(3):411-7. |
| [9] | Mariati, Ho SC, Yap MG, et al. Evaluating post-transcriptional regulatory elements for enhancing transient gene expression levels in CHO K1 and HEK293 cells[J]. Protein Expr Purif, 2010, 69(1):9-15. |
| [10] | Xie X, Xia W, Li Z, et al. Targeted expression of BikDD eradicates pancreatic tumors in noninvasive imaging models[J]. Cancer Cell, 2007, 12(1):52-65. |
| [11] | Sher YP, Liu SJ, Chang CM,et al. Cancer-targeted BikDD gene therapy elicits protective antitumor immunity against lung cancer[J]. Mol Cancer Ther, 2011, 10(4): 637-47. |
| [12] | Xie X, Hsu JL, Choi MG, et al. A novel hTERT promoter-driven E1A therapeutic for ovarian cancer[J]. Mol Cancer Ther, 2009, 8(8):2375-82. |
 2014, Vol.41
2014, Vol.41