2.湖北省肿瘤医院妇科肿瘤科
2.Department of Gynecologic Oncology,Hubei Cancer Hospital
宫颈癌是女性生殖系统最常见的恶性肿瘤, 人乳头瘤病毒(Human papillomavirus,HPV)感 染是其主要病因,其中70%为HPV16型和18型感染 所引起[ 1 ]。流行病学显示,临床上以HPV16型感染的子宫颈鳞状细胞癌最为常见[ 2 ]。在宫颈癌发生发 展过程中,HPV的两个重要癌蛋白E6/E7起着关键 作用。现有研究表明E6/E7蛋白可分别与肿瘤抑制 蛋白p53和pRb结合,使p53通路和Rb通路失活,导致 细胞周期调控异常,引起细胞增殖失控,抑癌基因 对DNA的损伤修复功能丧失,导致癌前病变及癌症 的发生及发展,与宫颈癌的发生发展密切相关[ 3 ]。 因此针对HPV16 E6/E7为靶点的基因研究及治疗成 为热点。然而长期以来对HPV16 E6/E7的研究主 要集中在其对宫颈癌发生的作用,而在宫颈癌侵 袭、转移方面的研究一直处于空白状态。
本研究通过基因工程技术,构建靶向HPV16 型E6/E7基因的shRNA真核表达载体,并将其转 染入人宫颈癌SiHa细胞,建立和鉴定稳定表达 psilencer 2.1-U6 hygro-shE6/E7的SiHa细胞株,并 运用CCK-8细胞增殖实验及细胞划痕愈合实验观 察其细胞增殖和迁移能力变化,为探究宫颈癌疾 病发展中HPV16 E6/E7促进侵袭转移机制的研究提 供实验基础,及为以HPV16 E6/E7为靶点的基因治 疗提供实验依据。 1 材料与方法 1.1 材料
人宫颈癌细胞系SiHa购自美国标准生物品 典藏中心(American Type Culture Collection , ATCC)。表达载体psilencer 2.1-U6 hygro购自Life Technologies公司,大肠埃希菌DH5α购自北京天 根生化科技有限公司。限制性内切酶Hind Ⅲ和 BamHⅠ、T4 DNA连接酶及凝胶回收试剂盒均购 自Fermentas公司,反转录酶试剂盒购自TaKaRa公 司,小量质粒提取试剂盒购自天根公司,大量去 内毒素质粒抽提试剂盒购自博大泰克公司,引物 由上海英骏公司合成,脂质体Lipo2000和Trizol购 自Invitrogen公司,β-actin抗体购自Abmart公司, HPV16 E6和HPV16 E7抗体购自Abcam公司。 1.2 方法 1.2.1 HPV16型基因E6/E7 shRNA表达载体的构建
根据GenBank提供的E6/E7基因序列,使用 美国Ambio公司在线设计软件,通过基因序列比 对,挑选3条长度均为19个碱基的特异性寡核苷酸 序列(5'-GTTATGCACAGAGCTGCAA-3';5'-GCA TGGAGATACACCTACA-3';5'-GTGTGACTCTA CGCTTCGG-3'),人工合成E6/E7基因的shRNA寡 核苷酸,具体序列见表1。将这两段互补的寡核苷 酸退火,形成具有黏性末端的互补双链。运用限 制性内切酶HindⅢ和BamHⅠ对表达载体psilencer 2.1-U6 hygro进行酶切纯化回收,并在T4 DNA连 接酶的作用下将其与退火后的双链DNA 22℃4 h定 向连接,连接产物转化感受态大肠埃希菌DH5α, 涂布氨苄青霉素抗性平板后挑取阳性克隆,送上 海英骏生物技术有限公司测序。鉴定正确的阳性 克隆分别命名为psilencer 2.1-U6 hygro-shE6/E7Ⅰ、 psilencer 2.1-U6 hygro-shE6/E7Ⅱ、psilencer 2.1-U6 hygro-shE6/E7Ⅲ。
|
|
表1 HPV16 型E6/E7 shRNA序列 Table 1 HPV16 E6/E7 shRNA sequences |
6孔板接种SiHa细胞,细胞密度80%,贴壁24 h 后,加入含潮霉素B浓度分别为100、200、300、 400、500、600 μg/ml的培养液。每3 d换液1次,由 细胞的死亡程度决定观察时间(一般3周)。筛选 SiHa的最小致死剂量(200 μg/ml)作为后续筛选 克隆细胞使用。 1.2.3 脂质体介导的重组质粒转染SiHa细胞
将生长状态良好的人宫颈癌SiHa细胞接种 于6孔板,待细胞60%~70%融合时,将重组质粒 psilencer 2.1-U6 hygro-shE6/E7Ⅰ、psilencer 2.1-U6 hygro-shE6/E7Ⅱ、psilencer 2.1-U6 hygro-shE6/E7 Ⅲ分别转染入SiHa细胞,设立空白载体对照,具 体操作按Lipo2000脂质体转染说明书进行,转染后 48 h收取细胞,鉴定筛选出效应最好的重组质粒。 1.2.4 潮霉素B筛选稳定表达psilencer 2.1-U6 hygro-shE6/E7重组质粒的SiHa细胞株
将沉默效应最好的shRNA质粒和空载质粒转 染入SiHa细胞,48 h后首次换液,加入最小致死剂 量的潮霉素B(200 μg/ml)。之后每2天换液1次, 维持潮霉素B的浓度,直到形成单个细胞克隆。分 别挑取转染shRNA重组质粒和空载质粒的SiHa细 胞单克隆至96孔板中,继续加入半量最小致死剂 量(200 μg/ml)的潮霉素B培养。标记好克隆的编号,待克隆细胞长满96孔板后,传至24孔板,待 其再长满传至6孔板和25 cm2培养瓶中,之后加入半量潮霉素B最小致死剂量(100 μg/ml)培养克隆 细胞。 1.2.5 real time-PCR鉴定
Trizol法提取转染有shRNA重组质粒和空载 质粒的SiHa细胞克隆总RNA,将mRNA逆转录为 cDNA。在BIO-RAD荧光定量PCR仪上进行PCR反 应。E6上游引物5'-CAG AGC TGC AAA CAA CTA TAC-3',下游引物5'-AGT GGC TTT TGA CAG TTA ATA C-3';E7上游引物5'-GAC AAG CAG AAC CGG ACA G-3',下游引物5'-ATT CCT AGT GTG CCC ATT AAC A-3'。以18S为内参,上游引 物5'-TGACTCAACACGGGAAACCTCAC-3',下游 引物5'-GGACATCTAAGGGCATCACAGACC-3'。反应条件:95℃30 s;95℃5 s,59℃ 15 s,39个循 环;65℃5 s,95℃ 15 s,用2-ΔΔCt法计算(E6/E7) /18S比值。在PCR过程中设立无模板阴性对照, 在实验结束后进行曲线分析,以鉴定产物是否单 一。本实验重复3次。 1.2.6 Western blot法鉴定
RIPA法提取转染有shRNA重组质粒和空载质 粒的SiHa细胞克隆总蛋白,考马斯亮蓝测定蛋白 浓度。80 μg总蛋白进行10%SDS-PAGE电泳,180 mA 1 h转至PVDF膜。PVDF膜经5%脱脂奶粉的 TBST溶液室温封闭1 h后,与小鼠抗人E6、E7单 克隆抗体(1∶500,Abcam)及兔抗人β-Actin抗 体4℃孵育过夜。1×TBST溶液洗膜3次(20 分钟 /次)后,PVDF膜与辣根过氧化物酶标记的山羊抗 小鼠及山羊抗兔二抗(1∶4 000,Novogene )37℃孵 育1 h,1×TBST溶液漂洗3次(15 分钟/次)后ECL 发光显影,采用Quantity one软件对各条带进行灰 度值观察。 1.3 CCK-8法检测细胞增殖
将SiHa、SiHa-psilencer 2.1-U6 hygro、SiHa- psilencer 2.1-U6 hygro-shE6/E7细胞,胰酶消化后 进行计数,调整细胞密度为1×105个/ml,96孔板 中每孔接种100 μl SiHa细胞悬液,即每孔1×104个 细胞,每组设5个平行副孔。分别于24、36、48、 60、72 h取出96孔板,每孔避光加入10 μl CCK-8溶 液,在细胞培养箱内继续避光孵育2 h后用酶标仪 测定在450 nm处的吸光度值,记录结果,以时间 为横坐标,以吸光度值为纵坐标绘制细胞生长曲 线。以只加培养液不加细胞的空白对照孔调零。 1.4 细胞划痕愈合实验
将SiHa、SiHa-psilencer 2.1-U6 hygro、SiHa- psilencer 2.1-U6 hygro-shE6/E7细胞悬液种于6孔 板,待细胞长到完全融合时,用10 μl的枪头在6孔 板的底面上沿直线轻轻进行划痕,PBS冲洗2次后 换含2%胎牛血清的DMEM培养液继续培养,分别 于0、12、24、36、48 h在倒置显微镜下观察细胞 划痕愈合情况并照相,以细胞划痕愈合百分比表 示细胞的运动能力(0 h的细胞划痕愈合为0)。 1.5 统计学方法
计量资料结果以(x±s)表示。采用SPSS11.5 软件对数据进行t检验和非参检验,以P<0.01为差异 有统计学意义。 2 结果 2.1 HPV16型E6/E7基因shRNA真核表达载体的测 序鉴定
上海Invitrogen公司测序结果显示,合成的双链 DNA片段已成功连接入shRNA载体的预计位点, 并且序列完全一致(图略),表明靶向E6/E7基因 的psilencer 2.1-U6 hygro-shE6/E7载体构建成功。 2.2 重组质粒的筛选
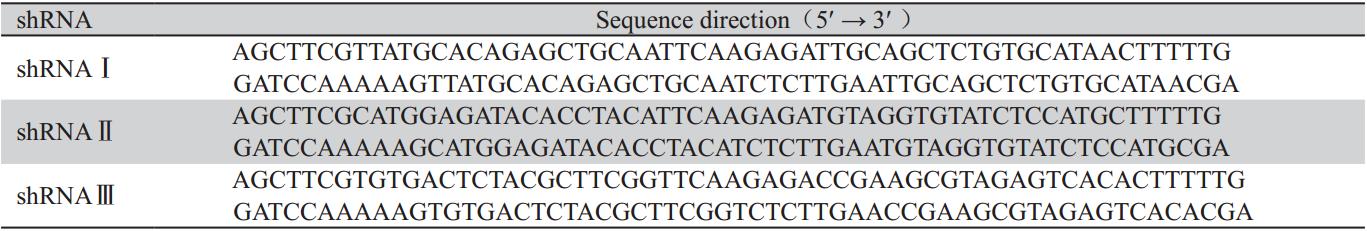
采用Real-time PCR技术检测三对psilencer 2.1-U6 hygro-shE6/E7重组质粒对人宫颈癌细胞 SiHa的沉默效应。结果显示,三对shE6/E7重组质 粒转染后48 h,SiHa细胞中E6、E7基因的mRNA表 达水平较转染空质粒细胞显著下降,其下降幅度 分别为:shRNAⅠ(85.97±4.90)%和(95.58±1.89)% (P<0.01);shRNAⅡ(61.09±11.97)%和(91.25± 3.40)%(P<0.01);shRNAⅢ(24.68±10.38)%和 (74.41±3.45)%(P<0.01),差异有统计学意义, 见图1。数据显示,本实验设计的shRNAⅠ能最为 有效而特异地沉默E6/E7基因,抑制其mRNA水平 的表达,故选择重组质粒psilencer 2.1-U6 hygroshE6/E7Ⅰ进行下一步的稳筛鉴定。
 |
1:SiHa-Blank; 2:SiHa-psilencer2.1-U6 hygro; 3:SiHa- psilencer2.1-U6
hygro-shE6/E7I; 4:SiHa- psilencer2.1-U6 hygro-shE6/E7II; 5:SiHa-
psilencer2.1-U6 hygro-shE6/E7III
图1 重组质粒转染SiHa细胞后检测HPV16 E6/E7 mRNA
的表达
Figure 1 HPV16 E6/E7 mRNA expression after shRNA
eukaryotic expression vectors transfected SiHa cells |
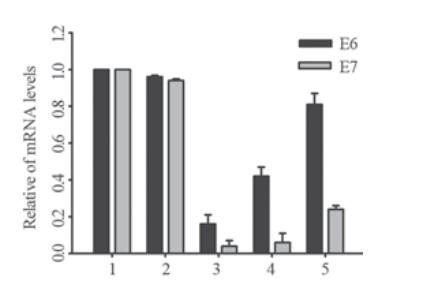
维持最小潮霉素B致死剂量(200 μg/ml)筛选 分别转染psilencer 2.1-U6 hygro、psilencer 2.1-U6 hygro-shE6/E7Ⅰ及空白对照SiHa细胞,每天观察 细胞死亡情况,3周后可见转染后的克隆细胞,见 图2。
 |
A:SiHa-psilencer 2.1-U6 hygro(×40);B:SiHa-psilencer 2.1-U6
hygro-shE6/E7Ⅰ(×40)
图2 稳定表达psilencer2.1-U6 hygro-shE6/E7Ⅰ的SiHa细
胞形态
Figure 2 Cell morphology of SiHa cells with stable
psilencer2.1-U6 hygro-shE6/E7Ⅰexpression |
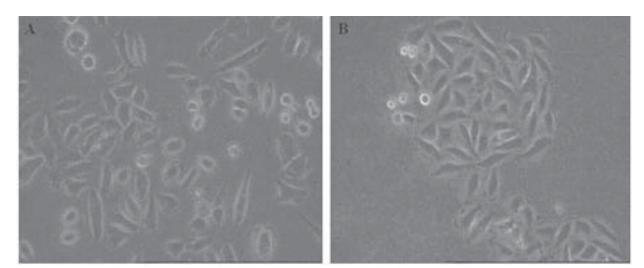
检测psilencer 2.1-U6 hygro、psilencer 2.1-U6 hygro-shE6/E7Ⅰ及空白对照SiHa细胞E6/E7 mRNA 的表达情况。结果显示,稳筛克隆细胞E6/E7的 mRNA表达水平较空载对照组下降幅度分别为:(85.97±4.90)%和(95.58±1.89)%,P<0.01,差异有 统计学意义,见图3A。
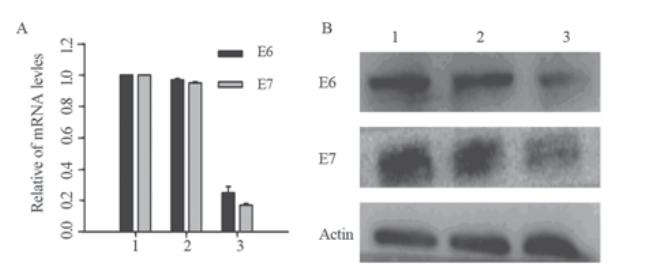 |
A:real-time PCR analysis; B:Western blot analysis
1:SiHa-Blank; 2: SiHa-psilencer2.1-U6 hygro; 3: SiHa- psilencer2.1-U6
hygro-shE6/E7I
图3 稳定表达psilencer 2.1-U6 hygro-shE6/E7Ⅰ的SiHa细
胞鉴定
Figure 3 Validation of SiHa cells with stable
psilencer2.1-U6 hygro-shE6/E7Ⅰexpression |
采用Western印迹法检测psilencer 2.1-U6 hygro、psilencer 2.1-U6 hygro-shE6/E7Ⅰ及空白对 照SiHa细胞E6/E7 蛋白的表达情况。结果显示,稳 定筛选shE6/E7的人宫颈癌SiHa细胞E6/E7蛋白的 表达与空载对照组降幅分别为(61.09±11.97)%和 (91.25±3.40)%,(P<0.01),差异有统计学意义, 见图3B。 2.6 psilencer 2.1-U6 hygro-shE6/E7对SiHa细胞增 殖能力的影响
运用CCK-8增殖检测实验检测psilencer 2.1-U6 hygro、psilencer 2.1-U6 hygro-shE6/E7Ⅰ及空白 对照SiHa细胞的增殖能力。结果显示,稳定表达 psilencer 2.1-U6 hygro-shE6/E7Ⅰ的SiHa细胞克隆 增殖能力明显减弱。于24、36、48、60、72 h分别 测量差异均有统计学意义(P<0.01),表明E6/E7可 以促进宫颈癌SiHa细胞的增殖,见图4A。
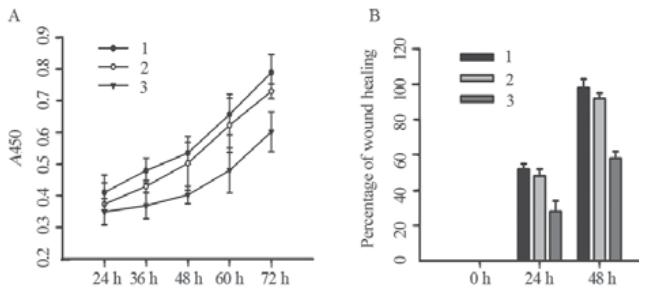 |
A:CCK-8 cell proliferation assay;B:cell scratch wound healing assay;1:
SiHa-Blank;2:SiHa-psilencer2.1-U6 hygro;3:SiHa- psilencer2.1-U6
hygro-shE6/E7I
图4 稳定表达psilencer 2.1-U6 hygro-shE6/E7Ⅰ的SiHa细
胞增殖及迁移能力检测
Figure 4 Proliferation and migration of SiHa cells with
stable psilencer 2.1-U6 hygro-shE6/E7Ⅰexpression |
运用细胞划痕实验检测psilencer 2.1-U6 hygro、psilencer 2.1-U6 hygro-shE6/E7Ⅰ及空白 对照SiHa细胞的迁移能力。0、24、48 h时点细 胞迁移情况对比显示,稳定表达psilencer 2.1-U6 hygro-shE6/E7Ⅰ的SiHa细胞迁移能力明显低于空 白对照及空载质粒组,且差异具有统计学意义(P <0.01),见图4B。 3 讨论
人类乳头瘤病毒是一种小型无包膜、具有环 状双链结构的DNA病毒,具有嗜上皮性,易侵及 皮肤和黏膜。它由约8 000个碱基对组成,其基因 结构含有6个早期开放读码框架(E1,E2,E4,E5, E6,E7)、2个晚期读码框架(L1,L2)和1个非编码 调控区(LCR)。早期读码框的基因主要参与病 毒DNA的复制、转录、翻译调控和细胞转化等功 能,晚期读码框内的基因则主要编码病毒蛋白[ 4 ]。 根据HPV基因序列结构的不同,人们确认的HPV 类型大约有200种基因型[ 5 ]。现有的流行病学和分子生物学资料证实,高危型HPV的持续感染是 导致宫颈癌发生的主要病因,以高危型HPV16、 HPV18最为常见[ 6 ]。流行病学显示,我国HPV16 型感染的人群多于HPV18型感染,且子宫颈鳞状细胞癌较腺癌多见[2]。因此,研究高危型HPV16的 功能及致病机制对于宫颈癌的诊断及治疗至关重 要。
研究表明,HPV16的早期基因E6/E7是其最重 要的致癌基因[ 7 ]。E6基因编码的蛋白可与细胞内 泛素水解酶E6-AP特异性结合形成E6-E6-AP复合 体,并依赖蛋白水解酶系统水解P53蛋白,使其对 细胞生长负调节功能丧失,引起细胞无限增生并 向恶性转化[ 8 ]。E6还可以通过诱导端粒酶的限速 成分-人端粒酶反转录酶(human telomerase reverse transcriptase,hTERT)激活端粒酶促使细胞发生永生化及异常增殖[ 9 ]。E7基因编码的蛋白可与生长 抑制蛋白pRb 结合,使其磷酸化失去活性从而释放出核转录因子E2F,最终导致感染细胞得以实现基因转录、异常增殖及恶性转化[10]。抑癌基因 P53、Rb的失活及端粒酶的激活会增加外源性HPV 病毒DNA在宫颈基底细胞的整合及突变,抵抗细 胞凋亡,最终导致癌变[ 11 ]。E6和E7蛋白不仅具有 转化和致癌作用,而且还具有对病毒基因和细胞 基因转录的反式激活活性,其在宫颈癌的发生过 程中起到关键性作用。宫颈癌发生后很容易发生 恶性增殖及转移,虽然早期筛查和手术联合放化 疗的防治模式已有效改善早期宫颈癌的预后,然 而对于发生宫旁浸润和远处转移的宫颈癌治疗和 预后的改善仍是棘手问题[ 12 ]。因此寻找肿瘤进展 过程中的关键因子有助于我们建立肿瘤进展的预 测体系,开展个体化诊治和靶向干预,从而为晚 期宫颈癌患者争取治疗时机、改善预后。HPV16 E6/E7在宫颈癌侵袭转移方面的作用研究仍处于 初步探究状态。近期有研究证实,在正常人包皮 角质细胞中HPV16 E7可诱导其发生上皮间质转 化(EMT),从而促进其侵袭转移[ 13 ]。然而在以 HPV感染为主要病因的宫颈癌中HPV16 E6/E7是否 也可诱导EMT发生并促进癌症侵袭转移,这点仍 需要进一步的研究。
本研究采用RNA干扰技术(RNAi),以 HPV16 E6/E7为靶点,在E6/E7基因的CNS区设计 多对短发夹RNA(shRNA),并以psilencer 2.1-U6 hygro为载体构建psilencer 2.1-U6 hygro-shE6/E7 重组质粒。将重组质粒转染入HPV16阳性的人宫 颈癌SiHa细胞系,用Real-time PCR检测E6、E7 在mRNA水平的表达改变并从中筛选沉默效应最 好的重组质粒,进而用潮霉素筛选获得稳定表达 psilencer 2.1-U6 hygro-shE6/E7的SiHa细胞系。另 外,本研究进一步运用CCK-8细胞增殖实验及细 胞划痕实验检测了HPV 16 E6/E7对SiHa细胞增殖 及迁移能力的影响,为探究HPV16 E6/E7在宫颈癌 发生、发展中的功能及作用机制奠定基础。
| [1] | Moody CA, Laimins LA. Human papillomavirus oncoproteins: pathways to transformation[J]. Nat Rev Cancer,2010,10(8):550-60. |
| [2] | Mu?oz N, Bosch FX, de Sanjosé S,et a1.Epidemioologic classification of human papillomavirus types associated with cervical cancer [J]. N Engl J Med,2003,348(6):518-27. |
| [3] | McCloskey R,Menges C,Friedman A,et al.Human papillomavirus type 16 E6/E7 upregulation of nucleophosmin is important forproliferation and inhibition of differentiation. [J]. J Virol,2010,84(10):5131-9. |
| [4] | Hoenil Jo, Jae Weon Kim. Implications of HPV infection in uterine cervical cancer[J]. Cancer Therapy,2005,3:419-34. |
| [5] | McLaughlin-Drubin ME,Münger K.Oncogenic activities of human papillomaviruses[J]. Virus Res,2009,143(2):195-208. |
| [6] | Corusi?A, Skrgati?L, Mahovli?V,et al.Cervical cancer as a public health issue--what next? [J]. Coll Antropol, 2010, 34(1):301-7. |
| [7] | Woodman CB,Collins SI,Young LS.The natural history of cervical HPV infection: unresolved issues[J]. Nat Rev Cancer,2007,7(1):11-22. |
| [8] | Berghella V,Figueroa D,Szychowski JM,et al.17-alphahydroxyprogesterone caproate for the prevention of preterm birth in women with prior preterm birth and a short cervical length[J]. Am J Obstet Gynecol,2010,202(4):351.e1-6. |
| [9] | Massimi P, Shai A, Lambert P,et al.HPV E6 degradation of p53 and PDZ containing substrates in an E6AP null background[J]. Oncogene,2008,27(12):1800-4. |
| [10] | American College of Obstetricians and Gynecologists. ACOG Committee Opinion. Use of progesterone to reduce preterm birth[J]. Obstet Gynecol,2003,102(5 Pt 1):1115-6. |
| [11] | Kisseljov F, Sakharova O, Kondratjeva T. Cellular and molecular biological aspects of cervical intraepithelial neoplasia[J]. Int Rev Cell Mol Biol,2008,271:35-95. |
| [12] | Feng SY,Zhang YN,Liu JG.Risk factors and prognosis of nodepositive cervical carcinoma[J].Ai Zheng,2005,24(10):1261-6. [冯 淑瑜,张彦娜,刘建刚.宫颈癌淋巴结转移的高危因素及预后分 析[J].癌症,2005,24(10):1261-6.] |
| [13] | Hellner K,Mar J,Fang F,et al.HPV16 E7 oncogene expression in normal human epithelial cells causes molecular changes indicative of an epithelial to mesenchymal transition[J].Virology,2009,391 (1):57-63. |
 2014, Vol.41
2014, Vol.41