细胞侵袭和转移是恶性肿瘤的重要生物学特 征。现已发现多种促进细胞运动的因子,如:表皮 生长因子(EGF),肝细胞生长因子(HGF),转 化生长因子(TGF)等。自分泌运动因子(AMF) 是重要的促进细胞运动和侵袭的因子,随着对该因 子研究和认识的深入,AMF在恶性肿瘤中的作用也 日益显著。本文就AMF及其受体(AMFR)在肿瘤 细胞侵袭和转移中的作用进行综述。 1 AMF/AMFR概述 1.1 自分泌运动因子-AMF
AMF又称磷酸己糖异构酶或者葡萄糖6磷酸异 构酶,参与糖酵解和糖异生代谢过程,促进葡萄 糖6磷酸转化为果糖6磷酸。作为神经白细胞介素 (NLK)易化胚胎脊髓和感觉神经元的生长,此外 在B细胞和髓细胞白血病细胞成熟方面也有一定作 用。AMF最早是Liotta等学者从人A2058恶性黑色素 瘤细胞培养液中分离和发现的。AMF以还原和非还 原两种状态下的多种形式存在[1]。还原状态下有5种 变异体,相对分子质量分别为65、57、46、38和31 kD。非还原状态则以65和57 kD的同源或异源二聚 体3种形式存在。相对分子质量为46 kD的变异体仅 存在于肿瘤细胞中,肿瘤细胞选择性分泌相对分子 质量为57 kD的变异体到胞外,作用于细胞的运动。 不同细胞中AMF的差异可能与AMF基因突变、转录 的裂解或者蛋白的糖基化修饰等因素有关。 1.2 自分泌运动因子受体-AMFR
AMFR,位于细胞膜结构的跨膜糖蛋白,相 对分子质量78 kD。在人、鼠和线虫等不同物种间 AMFR基因高度同源。蛋白结构N端有7个跨膜结构 域,一个RING-H2模体和一个亮氨酸拉链模体。作 为跨膜糖蛋白AMFR具有一个潜在的N-糖基化和多 个O-糖基化修饰位点。关于糖基化的修饰作用目前 尚不十分明确。Haga等[2]研究发现AMFR N-糖基位 点基因突变后会改变AMF与受体的结合。由此推 测AMFR N-糖基化修饰可能与配体-受体相结合有 关。AMFR位于细胞膜小凹处及胞质内滑面内质网 上。后者作为泛素连接酶参与蛋白酶体的降解。 1.3 AMF/AMFR结合及胞吞过程
作为细胞因子的AMF与胞膜小凹处AMFR结 合,经胞吞进入滑面内质网,参与泛素连接酶3降 解蛋白。这一过程受小窝蛋白的负向调节,而PI3K 则是该过程的正向调节因子。另一途径[3]:AMF与 AMFR结合后,胞膜内陷形成膜下囊泡。囊泡并不 继续进入胞质内细胞器或进入核内,囊泡进一步形 成多囊小体,转运至细胞表面纤连蛋白纤维处,如 此循环。不同于前者,这一途径依赖于网格蛋白。 位于纤连蛋白处的AMF/AMFR复合物可能作为分子 伴侣或纤连蛋白受体调节细胞与基质之间的黏附。 胞外基质含有丰富的整合素α5β1,而AMF激活受体 后可以促进肿瘤细胞高表达αIIbβ1及α5β1整合素。 抑制这一循环则导致细胞运动明显减弱。由此证明 AMF/AMFR—纤连蛋白循环途径是细胞迁移的限制 性因子。 2 AMF/AMFR与肿瘤侵袭和转移 2.1 AMF/AMFR与肿瘤细胞运动
细胞侵袭能力增强后,多种细胞伪足形成,伪 足带动整个细胞向运动方向“蠕动”。侵袭-蠕动如此 循环的结果宏观表现就是细胞的迁移运动。这一过 程的顺利完成与细胞外基质微环境的改变、细胞与 基质的黏附能力的改变密切相关。整合素是改变细 胞-基质之间黏附的主要因素。受AMF作用后的肝 癌细胞,活性整合素β1表达增加,同时伴MEK1/2磷 酸化增强[4],利用整合素β1抑制剂可以阻断细胞对 MMPs的分泌,细胞运动也随之减弱。因此,AMFR 与配体AMF结合后,细胞的随机或定向的运动增强 与整合素的表达有关。Wang等[5]发现在食管鳞状细 胞癌中上调AMFR,细胞运动增强还伴有ICAM-1 的高表达。细胞迁移依赖于细胞外基质的改变、而 这种改变不仅仅限于整合素。明胶酶谱法分析发 现AMF刺激后的肝癌细胞分泌更多的MMPs,但不 同细胞对不同的MMP分泌有选择差异。由此可见 AMF通过调节多种细胞因子促进细胞运动。
体外的细胞运动在动物体内则表现为肿瘤的转 移。表达AMFR的小鼠纤维瘤细胞GC-4PF转染AMF 基因后,细胞的迁移能力明显增强,克隆后细胞静 脉注入小鼠体内,肺内转移灶明显多于对照组[6], 而在AMFR无表达的大鼠骨肉瘤细胞内转染AMF 后,细胞的迁移能力、小鼠体内种植后肺转移均无 增强。这足以说明AMF可以促进细胞运动,而这一 过程需要AMFR介导。AMF是受体介导的细胞因子 在其他实验中也有验证[2, 7]。AMF与AMFR结合引起 受体磷酸化,继而激活受体偶联的百日咳毒素敏感 的G蛋白,由蛋白激酶C和磷脂酰肌醇-激酶引起细 胞内其他信号分子改变,最终细胞行为改变[8]。如 上调AMF后伴随着RhoGDP解离抑制剂(GDI-β)和 驱动蛋白运动因子3A(KIF3A)表达增加。在人恶性 黑色素瘤SBCL-2细胞中,AMF通过ERK磷酸化,启 动JNK磷酸化,诱导IL-8转录,增强IL-8分泌[9],促 进细胞运动,见图 1。
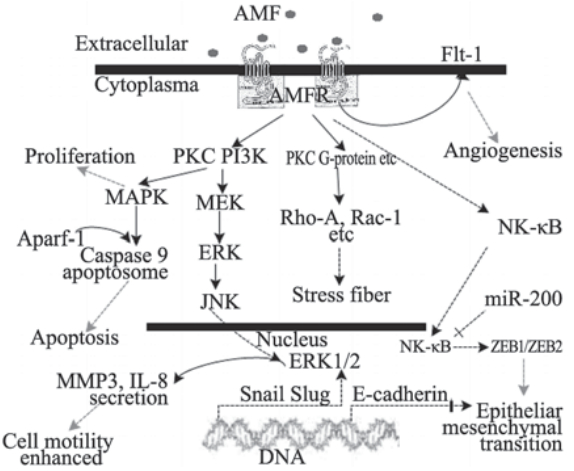 |
图 1 AMF/AMFR在恶性肿瘤侵袭和转移方面的作用 Figure 1 Effect of AMF/AMFR on invasion and metastasis of malignancy tumor |
侵袭是肿瘤转移的前提条件,细胞改变与原 发肿瘤及细胞外基质的黏附,为侵袭提供可能。E-钙黏蛋白,决定细胞之间黏附能力的重要因子,在 表达下调时细胞之间的黏附减弱,使细胞更有利于 进入脉管系统。由于基因突变,上皮表型改变或者 蛋白降解等原因致使E-钙黏蛋白失表达或弱表达后 常伴随着肿瘤侵袭能力增强,恶性程度增加。转染 AMF后的乳腺上皮形态改变,E-钙黏蛋白和细胞角 蛋白等上皮性标志物弱表达,取而代之的是纤连蛋 白和波形蛋白 [10]。AMF促进了上皮组织向间叶组织 转化(EMT),启动了肿瘤的侵袭过程。进一步实 验发现:EMT由NF-κB和ZEB1/ZEB2基因介导,受 miR-200调节 [11]。AMF/AMFR可以促进EMTɼ反之亦 然[12, 13]。以拮抗AMF基因G390位点的锤头型核酶序 列转染骨肉瘤细胞,不仅使AMF分泌减少,细胞增 殖,迁移和侵袭能力减弱,相关的上皮性因子恢复 表达,重要的是骨肉瘤细胞逆向分化,转化为成熟 的成骨细胞。携带乳腺肿瘤病毒及AMFR基因的转 基因小鼠在mRNA和蛋白水平高表达AMFR [7]和野生 型小鼠相比,转基因小鼠乳腺导管和乳腺小叶更加 致密,增生明显。同样发现转染AMFR的NIH3T3纤 维母细胞瘤增殖能力明显增强,导致裸鼠体内肿瘤 形成,沉默AMFR基因后,细胞增殖速度减慢。近 年来随着有关EMT的研究不断开展和深入,逐渐使 我们认识到这一转化与上皮源性恶性肿瘤的发生和 发展多个过程关系密切。AMF/AMFR促进EMT的发 生,促进肿瘤的侵袭和转移,是否也通过这一途径促 进了肿瘤的发生,还需进一步研究探讨。 2.3 AMF/AMFR与血管生成
AMF/AMFR不仅对肿瘤细胞有迁移作用,对正 常细胞同样显示着促进运动作用。受AMF影响的人 脐静脉内皮细胞上调受体AMFR表达后,VEGF受 体Flt-1表达增强 [14]。AMF高表达的HT1080细胞诱导 小鼠体内新生血管网形成,同样含有10 ng AMF的 基质膜内可见大量入侵细胞及管腔样结构生成[15]。 VEGF及其受体在肿瘤体内新生血管形成方面有着 十分重要的调节作用,与肿瘤的增殖、转移和耐药 等密不可分。VEGF通过促进血管内皮细胞,动员 内皮起源细胞和血管壁外周细胞的生长,促进新生 血管的形成。AMF作用于内皮细胞运动,促进Flt-1 表达,发挥着类似于VEGF的作用,从而促进新血 管形成,通过更加强有力的途径促进肿瘤的生长和 转移。除了人脐静脉内皮细胞,AMF对腹膜和膈肌 等处的间皮细胞也显示了促进细胞移动作用[16]。这 种移动使细胞收缩,细胞间隙增大,腹膜等通透性 增强,体腔积液形成,为肿瘤转移提供了条件。
研究表明:AMF/AMFR影响着肿瘤细胞多方面 的代谢,通过绝对或相对的细胞运动,参与了肿瘤 的转移,如图1。此外AMF/AMFR在抗肿瘤细胞凋 亡方面有一定的作用[17, 18]。临床上也已经发现部分 实体瘤 [19]如肺癌等高表达AMF/AMFR与患者预后直 接相关,但是并非所有临床数据与基础研究一致, 所以在临床实践中,是否可以检测AMF/AMFR的表 达量,以其表达程度判断疾病预后仍有待于研究。 AMF/AMFR与恶性肿瘤转移关系密切,参与了肿瘤 细胞侵袭和转移的多阶段和多环节。如何通过抑制 AMF/AMFR来抑制肿瘤的转移呢?这正是我们研 究的目的所在。已经发现抗AMFR的抗体可以拮抗 AMF/AMFR的诱导肿瘤转移作用,近来Nakajima 等[20]报道,高热可以抑制肿瘤细胞分泌AMF,从而 抑制细胞的运动,为抗肿瘤研究提供了新的思路。 3 结语
恶性肿瘤的侵袭和转移一直是困扰临床医生的 难题。这方面也有许多研究,但是迄今为止仍未完 全了解和解决这一问题。本文综述了AMF/AMFR在 肿瘤黏附力改变、基质降解、组织转化等肿瘤侵袭 过程和细胞迁移,新血管生成等肿瘤转移等方面的 作用,使我们认识和掌握该因子及其受体对恶性肿 瘤的影响,对进一步寻找更加有效的抗肿瘤治疗手 段具有重要的指导意义。
| [1] | Niinaka Y, Paku S, Haga A, et al. Expression and secretion of neuroleukin/phosphohexose isomerase/maturation factor as autocrine motility factor by tumor cells[J]. Cancer Res,1998,58(12):2667-74. |
| [2] | Haga A, Komazaki S, Funasaka T, et al. AMF/G6PI induces differentiation of leukemic cells via an unknown receptor that differs from gp78[J]. Leuk Lymphoma, 2006, 47(10):2234-43. |
| [3] | Le PU, Benlimame N, Lagana A, et al. Clathrin-mediated endocytosis and recycling of autocrine motilityfactor receptor to fibronectin fibrils is a limiting factor for NIH-3T3 cell motility[J]. J Cell science, 2000,113(Pt 18):3227-40. |
| [4] | Torimura T, Ueno T, Kin M,et al. Autocrine motility factor enhances hepatoma cell invasion across the basement membrane through activation of β1 integrins[J]. Hepatology,2001,34(1):62-71. |
| [5] | Wang L, Hou G, Xue L, et al. Autocrine motility factor receptor signaling pathway promotes cell invasion via activation of ROCK-2 in esophageal squamous cell cancer cells[J]. Cancer Invest, 2010, 28(10):993-1003. |
| [6] | Yanagawa T, Watanabe H, Takuechi T, et al. Overexpression of autocrine motility factor in metastatic tumor cells: possible association with augmented expression of KIF3A and GDI-β[J].Lab invest,2004,84(4):513-22. |
| [7] | Joshi B,Li L,Nabi IR.A role for KAI1 in promotion of cell proliferation and mammary gland hyperplasia by the gp78 ubiquitin ligase[J].J Biol Chem,2010,285(12):8830-9. |
| [8] | Tsutsumi S, Gupta SK, Hogan V, et al.Activation of small GTPase Rho is required for autocrine motility factor signalling[J]. Cancer Res, 2002,62(15):4484-90. |
| [9] | Araki K, Shimura T, Yajima T, et al. Phosphoglucose isomerase/ autocrine motility factor promotesmelanoma cell migration through ERK activation dependent on autocrine production of interleukin-8[J]. J Biol Chem,2009,284(47):32305-11. |
| [10] | Funasaka T, Hogan V, Raz A.Phosphoglucose isomerase/autocrine motility factor mediates epithelial and mesenchymal phenotype conversions in breast cancer[J]. Cancer Res,2009, 69(13):5349-56. |
| [11] | Ahmad A,Aboukameel A,Kong D,et al. Phosphoglucose isomerase/ autocrine motility factor mediates epithelial-mesenchymal transition regulated by miR-200 inbreast cancer cells[J]. Cancer Res,2011,71(9):3400-9. |
| [12] | Funasaka T, Hu H, Yanagawa T,et al. Down-regulation of phosphoglucose isomerase /autocrinemotility factor results in mesenchymal-to-epithelial transition of human lung fibrosarcoma cells[J]. Cancer Res,2007,67(9):4236-43. |
| [13] | Niinaka Y, Harada K, Fujimuro M, et al. Silencing of autocrine motility factor induces mesenchymal-to-epithelial transition and suppression of osteosarcoma pulmonary metastasis[J]. Cancer Res, 2010,70(22):9483-93. |
| [14] | Funasaka T, Haga A, Raz A, et al.Autocrine motility factor secreted by tumor cells upregulates vascular endothelial growth factor receptor (Flt-1) expression in endothelial cells[J]. Int J Cancer, 2002,101(3):217-23. |
| [15] | Funasaka T, Haga A, Raz A, et al.Tumor autocrine motility factor is an angiogenic factor that stimulates endothelial cell motility[J]. Biochem Biophys Res Commun, 2001,285(1):118-28. |
| [16] | Funasaka T, Haga A, Raz A, et al.Tumor autocrine motility factor induces hyperpermeability of endothelial and mesothelial cells leading to accumulation of ascites fluid[J]. Biochem Biophys Res Commun, 2002,293(1):192-200. |
| [17] | Haga A, Funasaka T, Niinaka Y, et al. Autocrine motility factor signaling induces tumor apoptotic resistance by regulations Apaf-1 and caspase 9 apoptosome expression[J]. Int J Cancer, 2003,107(5): 707-14. |
| [18] | Fu M, Li L, Albrecht T, et al. Autocrine motility factor/phosphoglucose isomerase regulates ER stress and cell death through control of ER calcium release[J]. Cell Death Differ, 2011,18(6):1057-70. |
| [19] | Dobashi Y, Watanabe H, Sato Y,et al. Differential expression and pathological significance of autocrine motility factor/glucose-6-isomerase expressionin human lung carcinomas[J]. J Pathol, 2006,210(4):431-40. |
| [20] | Nakajima K, Yanagawa T, Watanabe H, et al. Hyperthermia reduces migration of osteosarcoma by suppression of autocrine motility factor[J]. Oncol Rep,2012,28(6):1953-8. |
 2014, Vol.41
2014, Vol.41


