2.结直肠外科
2.Surgical Department of Colon
结直肠癌是消化道常见的恶性肿瘤,其发病 率和死亡率呈逐年上升趋势,随着肿瘤干细胞理 论的提出,突破了以往对肿瘤发生发展的认识,认为肿瘤的发生以及耐药性源于肿瘤组织中存在 的肿瘤干细胞[1]。既往的大多数研究都是基于结直 肠肿瘤细胞系,然而对细胞系的研究不能体现人 体内的真实状况,本研究以人结直肠肿瘤组织来源细胞为研究对象,从原代培养的肿瘤细胞中获得 能持续传代的肿瘤干细胞克隆,建立纯化的肿瘤干 细胞群,并对克隆细胞生物学特性进行研究。 1 资料与方法 1.1 临床资料
随机选取宁夏医科大学总医院2009年9月— 2011年9月结直肠外科手术切除结直肠肿瘤组织标 本37例,术前与患者签订标本使用知情同意书。 1.2 主要试剂与仪器
DMEM、F12、HEPES、EGF、N2、胎牛血 清均购于Gibco公司;bFGF(R&D);鼠抗人 CD133-PE(MACS);鼠抗人CD166-PE、CD24-PE、CD47-PE、EPCAM-PE、CD200-PE、CD90-FITC、CD44-FITC、IgG1-PE、IgG2a- FITC均购于 美国BD公司(Becton,Dickinson and Company); RNeasy plus Mini Kit(QIAGEN);T ReverAid First Strand cDNA Synthesis Kit(Fermentas); Trans Start Green qPCR Super Mix(TIANGEN); 所用引物由上海捷瑞生物工程公司合成;流式 细胞仪(FACS,Caliber,美国BD公司);实 时荧光定量PCR 仪(ABI,Prism 7300,美国 ABI公司);核酸蛋白测定仪(ND- 1000,美国 NanoDrop)。 1.3 结直肠肿瘤细胞的原代培养
结直肠肿瘤组织标本取自病理鉴定为肠腺癌 的实体肿瘤组织。术中在无菌条件下取结直肠癌 患者肿瘤组织标本。用眼科剪将组织反复剪切至 1 mm 3的小块;加入胶原酶37℃水浴1 h,每10 min 充分振摇试管一次;离心(700 r/min,4 min),弃 上清液;加入适量的含血清培养液(取DMEM培 养液46 ml,F12培养液46 ml,向DMEM/F12混合 培养液中加入5 ml FBS,10 μl 200 μg/ml的EGF,10 μl 100μg/ml的bFGF,100 μl 1 000×ITS配成含 50%DMEM,50%F12,5%FBS,1% Anti-Anti,1% Pen Strep,1%HEPES,bFGF终浓度为10 ng/ml,EGF终浓度为20 ng/ml及ITS终浓度为1×ITS的溶 液)培养细胞;第二天观察细胞状态,若状态良 好5~7天后换液并进行常规传代冻存培养。 1.4 肿瘤细胞的无血清培养
将培养的原代肿瘤细胞消化后以2×102/ml接种 于培养皿中,培养液采用无血清培养液(DMEM 50%,F12 50%,1×N2,葡萄糖6 mg/ml,1×谷 氨酰胺,NaHCO3 1 mg/ml,1×HEPES,1×AntiAnti,1×Pen Strep,肝素4 μg/ml,人血清白蛋白 0.5%,10 ng/ml bFGF,20 ng/ml EGF),细胞在 37℃、5%CO2培养箱中培养。每3~4天换液1次,连续观察细胞生长情况。 1.5 有限稀释法培养肿瘤细胞克隆
取生长状态良好的原代肿瘤细胞,用消化液 消化后经锥虫蓝染色后计数细胞,应用有限稀释 法以每孔2~3个细胞种于96孔板中,次日观察96孔 板中每孔存活的细胞数,选取只有一个细胞的孔 并标记。7天后观察标记孔,并观察细胞状态,去 除细胞死亡的孔,给有细胞存活的孔换液。10~14 天后观察已经换液的孔,将生长状态良好的孔进 行标记,每三天观察一次并换液直至细胞可传代 为止。 1.6 流式细胞术检测
对原代培养细胞及克隆细胞进行流式分析,将细胞悬液计数并离心(80 g×4 min),以浓度为 1×10 5/500 μl PBS重悬细胞于流式管中,每管中加 入相应的荧光标记抗体10 μl,并设置同型对照,室温避光孵育15 min后PBS洗涤一次,加500 μl PBS重悬后上机检测。 1.7 细胞生长曲线的检测
取对数生长期的细胞(原代细胞及克隆细 胞),调整细胞浓度为2×10 5/ml,以每孔100 μl接种 于已经处理好的48孔板中(每孔20 000个细胞)。 每种细胞设置3个平行对照,及空白对照(不加细 胞只加培养液,其他步骤相同); 将加好细胞的48 孔板培养过夜,并在培养后12、24、36、48、60、 72 h分别用MTT法检测细胞生长情况。 1.8 Sox2、Oct4、C-myc、Nanog四种基因mRNA 水平的检测
取克隆细胞以及原代细胞,根据RNeasy plus Mini Kit(QIAGEN)试剂盒提取总RNA。核 酸蛋白测定仪确定提取的RNA 浓度和纯度。 按照ReverAid First Strand cDNA Synthesis Kit (Fermentas)试剂盒将RNA 反转录成cDNA 保存 于-20℃备用。运用荧光定量PCR 方法检测4种基 因在克隆细胞以及原代细胞中的表达差异,以管 家基因GAPDH作为对照。所用引物序列见表1 。 反应体系为20 μl,0.5 μl cDNA,10 μl Trans Start Green qPCR Super Mix(TIANGEN),Forward Primer(10 μmol/ L) 0.5 μl,Reverse Primer (10μmol/ L) 0.5 μl,0.3 μl reference 染料,加RNase Free dH2O至总体积20 μl。反应条件:50℃2 min,95℃ 10 min; 95℃15 s,55℃30 s,72℃30 s,共45个 循环。
| 表1 PCR扩增所用引物序列以及扩增的长度(5'~3') Table 1Primer sequence and length for PCR amplification (5'-3') |
所有数据采用SPSS 13.0软件包进行分析。计 量资料以均数±标准差(x±s)表示,组间比较采用单 因素方差分析(One-Way Anova),P<0.05表示差异 有统计学意义。 2 结果 2.1 原代培养结直肠肿瘤细胞的生长情况
新鲜的肿瘤组织经消化后培养,第3天部分细 胞贴壁生长,7天后,大量细胞贴壁,小部分细胞 已经开始进行分裂。12天后细胞数量较多,局部 细胞密度较大,不同的贴壁区域细胞形态差别较 大,部分区域细胞生长较好,细胞较小呈梭形,细胞核大,胞质内颗粒较少,可见正在分裂的细 胞。部分区域细胞已经开始分化,细胞变大细胞 形态不规则,核质比减小,见图1。
 | 图1 原代培养后12天观察细胞发现贴壁细胞形态不一 (× 200)Figure 1The cell morphology is different after 12 days of primary cell culture (× 200) |
选择能够形成肿瘤球的原代细胞进行克隆培 养,培养至7天后发现标记的培养孔中细胞数量增 加,继续培养12~14天后发现有明显的克隆形成,通过有限稀释法培养共获得克隆10个。 2.3 流式细胞仪分析原代细胞以及克隆细胞的表 面标记
主要检测的表面标记物有CD133、CD166、 EPCAM、CD24、CD44、CD47、CD200、CD90。 检测结果发现,在无血清培养条件下能够形成 肿瘤球的原代培养细胞,其CD166阳性细胞所占 比例分别为61.9%、52.4%、47.8%,CD47阳性 细胞所占比例分别为99.8%、97.2%、99.9%;不 能形成肿瘤球的原代培养细胞中CD166阳性细胞 为10.8%,CD47阳性细胞为0.1%;其中CD133、 EPCAM、CD24、CD200四个表面标志物在两种细 胞中的表达均低于0.5%,CD44、CD90在两种细胞 中的表达均高于95%,见表2。此外,从10例克隆 细胞中随机选取6例做流式分析,结果显示6例克 隆细胞的表面标记物表达基本一致,且与克隆来 源细胞相比差异不大,分析结果见表3。
| 表2四例原代培养细胞的表面标记表达情况 Table 2Four cases of primary cultured cell surface marker expression |
| 表3 原代细胞及克隆细胞表面标记的表达情况 Table 3The expression of cell surface markers in primary cell and clone cell |
运用MTT比色实验绘制细胞生长曲线,见图2,在相同的时间点上,克隆细胞的吸光度值较其原代细胞的吸光度值高,说明在相同的增殖条件 和时间内克隆细胞比其原代细胞的细胞数量多,也就是说克隆细胞较其原代细胞具有更强的体外 增殖能力。
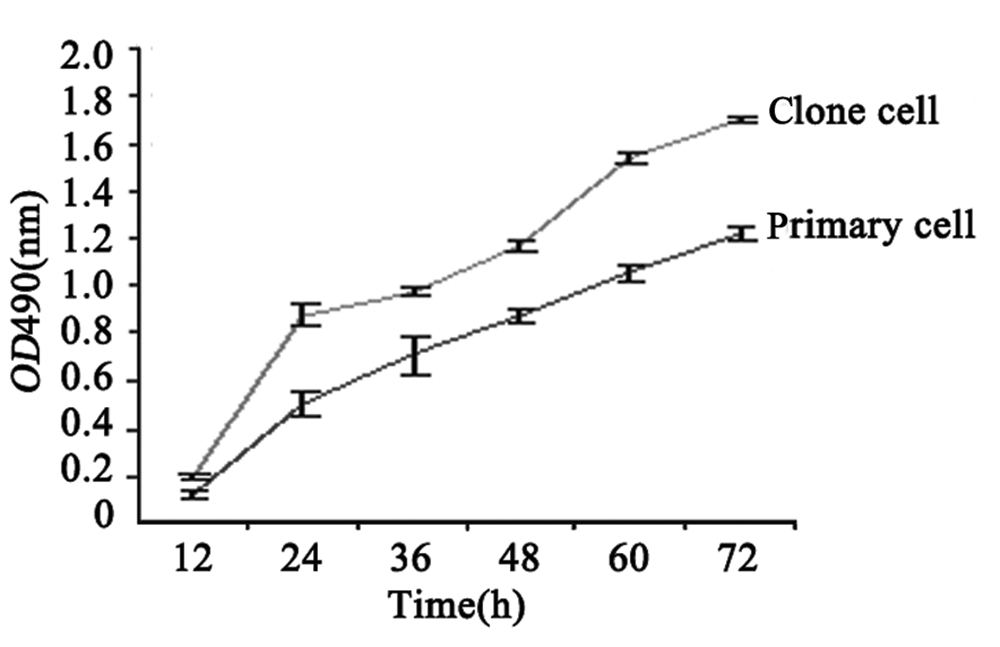 | 图2 原代培养细胞和克隆细胞的生长曲线Figure 2The growth curve of primary cell and clone cell |
提取总RNA后用1%的琼脂糖凝胶电泳鉴定其 质量,在凝胶上可以看到三条带,其中18S和28S的 条带明显、清晰,而5S的条带亮度比较弱,28S的 条带亮度是18S条带亮度的2倍左右,说明RNA保 持完整。用核酸蛋白测定仪检测RNA的浓度及纯 度,A260/A280在1.8~2.0之间,总RNA纯度较好可 用于合成cDNA。运用PCR技术检测克隆细胞与原 代细胞Oct4、Sox2、Nanog、C-myc基因的表达情 况,凝胶电泳结果显示克隆细胞与原代细胞同时表 达Oct4、Sox2、C-myc但都不表达Nanog,见图3。
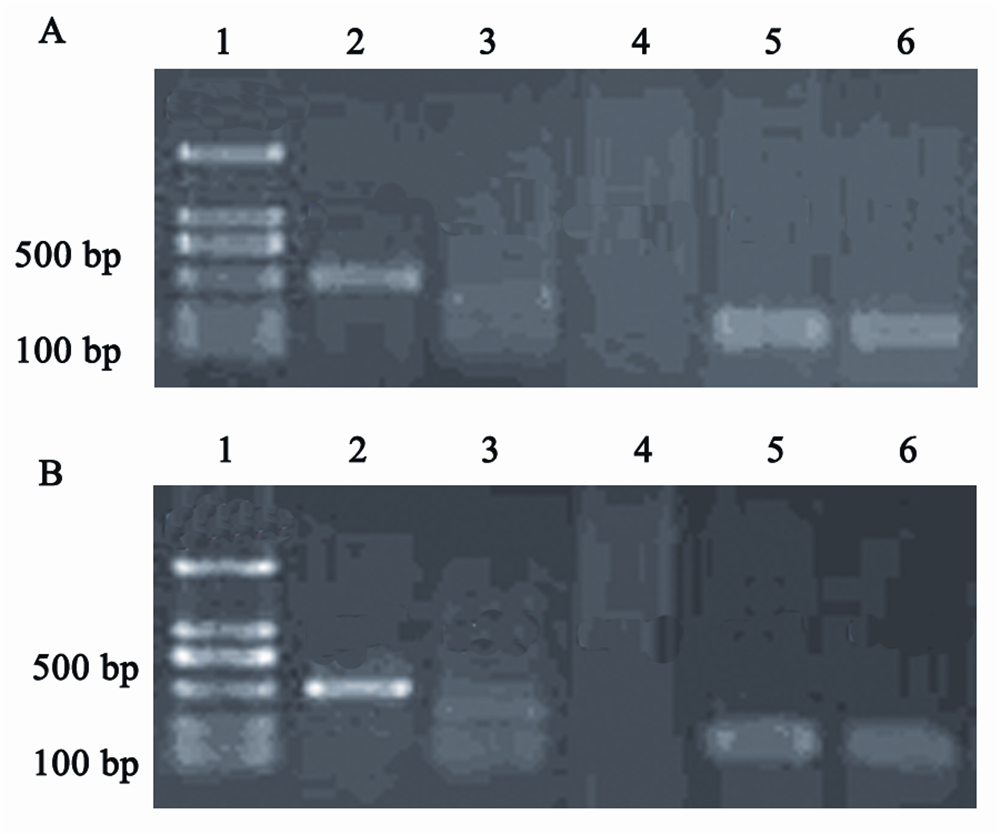 | 图3 克隆细胞(A)和克隆来源细胞(B)中胚胎干细胞相关基因的电泳图Figure 3Electrophoretogram of embryonic stem cell gene expression in clone cell(A)and primary cell(B) |
进一步用荧光定量PCR检测Oct4、Sox2、 C-myc三个基因在克隆细胞以及原代细胞中的表达差异。用?CT、2 -??CT相对定量的方法分别表示在 不同细胞中三个基因相对于管家基因GAPDH的表 达水平及克隆细胞相对于其原代细胞三个基因表 达水平的倍数,见表4。分析结果发现三种基因在 四种克隆细胞的表达水平均高于原代细胞,其中 C-myc基因在克隆细胞的表达水平高于原代细胞 (P<0.01),Oct4在三种克隆细胞中的表达明显高于 原代细胞(P<0.05),但克隆细胞B10的表达水平与 原代细胞基本持平。
| 表4 荧光定量PCR检测不同细胞中Oct4、Sox2、C-myc基因的表达情况 Table 4Fluorescence quantitative PCR detect Oct4, Sox2,C-myc gene expression in different cells |
肿瘤干细胞具有自我更新的能力,在无血清 的培养条件下肿瘤干细胞可增殖形成致密的球体 且保持未分化的状态。本实验在无血清的培养条 件下培养原代的肿瘤细胞,其中三例原代培养的 细胞在无血清环境中形成了肿瘤球,说明这三例 原代培养的细胞中存在肿瘤干细胞,而一例原代 培养的肿瘤细胞不能形成肿瘤球,认为这一例原 代培养的细胞中没有或有少量的肿瘤干细胞,这 可能是因为在不同患者来源的肿瘤组织中肿瘤干 细胞的数量存在差异。
为了在肿瘤细胞中获得肿瘤干细胞亚群,本 实验运用有限稀释法培养获得了10例肿瘤克隆细 胞,并对克隆细胞和原代细胞的体外增殖情况进 行了研究,结果发现克隆细胞可传代至20代,且 生长状态良好,而作为克隆来源的原代培养细胞 只可传代至12代。说明克隆细胞较原代培养细胞 有更强的生长能力和自我更新能力。同时由于原 代培养的细胞是一个混杂的群体,因此在培养过 程中大量的肿瘤干细胞经历了分化;而克隆细胞 群体相对均一,在培养过程中能够保持原有的细 胞特性,这可能是原代细胞在体外培养过程中增 殖能力较克隆细胞差的原因之一。
O’Brien等[2]于2006年首先证实CD133+的细胞在注射NOD/SCID小鼠后能够产生肿瘤,而 CD133-的细胞并不具有小鼠致瘤性。但2008年 Shmelkov等[3]报道在正常的结直肠细胞中有部分 表达CD133,在转移的结直肠肿瘤中CD133阴性 的肿瘤细胞也具有肿瘤再生的能力,提示CD133 本身与肿瘤生长并没有直接的联系。有研究报道 CD47与CD200分子与肿瘤的免疫逃逸相关,表达 在巨噬细胞表面的CD47R与CD47结合后可以抑制 巨噬细胞对其的吞噬作用[4],CD200分子具有免疫 调节作用,其可下调啮齿类动物组织或器官的同 种移植排斥反应[5]。本实验观测了肿瘤克隆和克隆 来源的原代细胞表面CD133、CD166、EPCAM、 CD24、CD200、CD47、CD44以及CD90的表达情 况,发现不论是克隆还是克隆来源的原代细胞表 面均表达CD166、CD44、CD47、CD90等细胞表 面标记,然而CD133、EPCAM、CD200、CD24为 阴性表达,这与Shmelkov等报道一致;然而对原 代培养的四例肿瘤细胞做流式分析发现,其中三 例能够在无血清的环境中形成肿瘤球的细胞表面 均为CD166、CD47高表达细胞。
肿瘤干细胞具有与干细胞相似的表面抗原; 相同的信号通路如Wnt信号通路[6];表达相似的蛋 白(Oct-4、Sox2、Nanog)保持干细胞的永生性并具 有自我更新的能力[7, 8]。有研究表明,在结肠癌细 胞中也有Sox2的表达,认为这种转录因子在肿瘤细 胞中异位表达的现象可能是导致肿瘤的原因[9]。基 于以上的研究,本实验运用荧光定量PCR检测了 克隆细胞及原代细胞的四种基因表达差异,由于 对扩增产物进行电泳发现Nanog在两种细胞中均未 表达,因此只对Oct4、Sox2、C-myc三种基因进行 了定量检测,结果发现Oct4和C-myc在两种细胞中 的差异较大,而Sox2在两种细胞中的差异不大。 这也与体外增殖实验的实验结果相符,即具有自 我更新能力的克隆细胞高表达Oct4、C-myc,而增 殖能力较差的克隆来源细胞其Oct4、C-myc表达也 较低。EpCAM被认为是一个肿瘤标志物,其表达 的强度可以作为临床上皮来源肿瘤诊断和预后的标 志,EpCAM可上调癌基因C-myc的表达,使细胞增 殖速度加快[10]。本实验发现克隆细胞C-myc的表达 是克隆来源原代细胞的62.03±10.43倍,而通过流 式鉴定发现克隆细胞不表达EpCAM,其机制有待 后续的研究。本实验从人结直肠肿瘤中得到具有 自我更新和增殖潜能的结直肠肿瘤干细胞,在体 外可将其分离、培养和纯化,为进一步研究结直 肠肿瘤干细胞的体内功能奠定了基础。
| [1] | Hirschmann-Jax C, Foster AE, Wulf GG, et al. A distinct “side population” of cells with high drug efflux capacity in human tumor cells [J]. Proc Natl Acad Sci U S A, 2004, 101(39): 14228-33. |
| [2] | O’Brien CA, Pollett A, Gallinger S, et al. A human colon cancer cell capable of initiating tumour growth in immunodeficient mice[J]. Nature,2007,445(7123):106-10. |
| [3] | Shmelkov SV, Butler JM, Hooper AT, et al. CD133 expression is not restricted to stem cells, and both CD133+ and CD133? metastatic colon cancer cells initiate tumors[J]. J Clin Invest, 2008, 118(6): 2111-20. |
| [4] | Valk PJ, Verhaak RG, Beijen MA, et al. Prognostically useful gene-expression profiles in acute myeloid leukemia[J]. N Engl J Med, 2004, 350(16):1617-28. |
| [5] | Gorczynski RM, Chen Z, Hu J, et al. Evidence of a role for CD200 in regulation of immune rejection of leukaemic tumor cells in C57BL/6 mice [J]. Clin Exp Immunol, 2001,126(2):220-9 |
| [6] | Bisson I, Prowse DM.WNT signaling regulates self-renewal and differentiation of prostate cancer cells with stem cell characteristics [J]. Cell Res, 2009, 19(6): 683-97 |
| [7] | Huang D, Gao Q, Guo L, et al. Isolation and identification of cancer stem-like cells in esophageal carcinoma cell lines[J]. Stem Cells Dev, 2009, 18(3): 465-73 |
| [8] | Cicalese A, Bonizzi G, Pasi CE, et al. The tumor suppressor p53 regulates polarity of self-renewing divisions in mammary stem cells [J]. Cell, 2009, 138(6): 1083-95. |
| [9] | Tani Y, Akiyama Y, Fukamachi H, et al. Transcription factor SOX2 up-regulates stomach specific pepsinogen A gene expression[J]. J Cancer Res Clin Oncol, 2007, 133(4):263-9. |
| [10] | Gires O, Klein CA, Baeuerle PA. On the abundance of EpCAM on cancer stem cells [J].Nat Rev Cancer, 2009, 9(2):143. |
 2014, Vol.41
2014, Vol.41