2.吉林医药学院附属医院肛肠科(*:现单位:138000 吉林松原,吉林油田总医院胸乳腺外科)
2. Department of Anorectal Surgical,The Affiliated Hospital of Jilin Medical College(*:Present:Department of Thoracic Surgery &Breast Surgery, Jinlin Oil Field General Hospital,Songyuan 138000,China)
肺癌是世界上发病率最高的恶性肿瘤之一[1], 目前位居癌症死因的第一位。迄今为止,除手术 外,化疗是最主要的治疗手段之一。木脂素是芝 麻中主要活性成分[2, 3],其中芝麻素占约木脂素一 半含量,在体内表现为较强的生物学活性[4]。本实 验主要研究芝麻素的体外抗肺癌及诱导细胞凋亡 的作用并揭示其可能的抗肿瘤机制,为芝麻素开 发成抗肿瘤辅助用药或抗肿瘤新药提供进一步的 实验和理论依据。 1 材料和方法 1.1 材料
人肺腺癌A549细胞株(由中国医学科学院购 置,由本科室体外传代培养)。肺腺癌A549细胞 株培养于含体积分数为10%胎牛血清的DMEM培 养液中,置37℃、5%的CO2培养箱中培养,实验时 取对数生长期细胞。 1.2 方法 1.2.1 MTT检测
测定开始实验前24 h进行细胞换 液,取对数生长期人肺腺癌A549细胞,消化制备 成单细胞悬液,低倍镜下进行细胞计数后,接种 于96孔板中,细胞浓度为1×106个/毫升。细胞贴壁 后,每孔分别加入药物20 μl,使实验组芝麻素终 浓度达10、20、40 、60、80 μg/ml,并另设空白组 和对照组,分别培养24、48、72 h后,每孔分别加 入5 mg/ml的MTT溶液20 μl,37℃孵育4 h后,小心 弃上清液,每孔分别加入二甲基亚砜(DMSO) 150 μl,轻轻振荡10 min后用酶标仪在492 nm处 测定吸光度(A)值。计算细胞生长抑制率及药 物抑制率,并利用NDST软件计算半数抑制浓度 (IC50)。计算公式:肿瘤细胞增殖抑制率(%) =1- [加药孔A值/对照孔A值]×100%。 1.2.2 倒置显微镜观察
取对数生长期人肺癌 A549细胞,0.25%胰酶常规消化,吹打均匀,制备 成浓度为1×106个/毫升的细胞悬液,接种于75 ml 培养瓶中,贴壁生长后加入芝麻素40 μg/ml,另设 对照组,CO2培养箱培养24、48、72 h后,利用倒 置显微镜进行细胞形态学观察,并拍照记录。 1.2.3 HE染色
取对数生长期人肺腺癌A549细 胞,制备成浓度为1×106个/毫升细胞悬液,接种于 6孔板中,每孔细胞2 ml,设空白对照组(不加药 物)、芝麻素40 μg/ml组,细胞贴壁牢固后,分别 加入相应药物,在CO2培养箱培养48 h后,按照常 规染色法进行HE染色观察。 1.2.4 流式细胞术检测细胞周期
取对数生长期 的人肺腺癌A549细胞,用0.25%胰酶消化,吹打 均匀,制备成1×106个/毫升细胞悬液,置于100 ml 的培养瓶中培养,加入芝麻素40 μg/ml,另设立对 照组(不加药物),放入CO2恒温细胞培养箱, 放入CO2恒温细胞培养箱,继续培养48 h后,收集 细胞悬液,按以下步骤进行:冷PBS (pH:7.2~7.4) 缓冲液洗涤,1000 r/min,离心3 min,2次;加 入2 ml冷PBS缓冲液,制备成单细胞悬液;加入4 ml预冷的70%乙醇固定,4℃保存过夜;将细胞悬 液1 000 r/min,离心5 min,小心弃上清液;冷PBS 缓冲液2 ml 洗涤,1 000 r/min,离心5 min,2次; 加入RNA酶,37℃水浴30 min;加碘化丙锭(PI)染 色液混匀,4℃避光30 min;上机检测,检测凋亡 率,查看变异率,分析细胞周期分布等情况。 1.2.5 Annexin V/PI双染色法检测细胞凋亡
取对 数生长期的人肺腺癌A549细胞,用0.25%胰酶消 化,吹打均匀,制备成1×106个/毫升细胞悬液,置 于100 ml的培养瓶中培养,加入芝麻素40 μg/ml, 另设立对照组(不加药物),放入CO2恒温细胞培 养箱,继续培养48 h后,收集细胞悬液,按以下步 骤进行:将待测细胞的培养液用移液器吸入到15 ml试管中,用冷PBS洗涤两次,PBS洗液亦收集到 试管中。加胰酶消化;用收集的弃液和PBS洗涤液 终止消化,混匀分别收入到各自的离心管中,300 r/min,离心5 min弃上清液;冷PBS(1~2)ml洗 涤2次,300 r/min,离心5 min弃上清液;用冷PBS 洗涤各组待检细胞2次,并在1×binding buffer中重 悬细胞浓度为1×106 个/毫升。吸取100 μl的细胞(1 ×105)至试管中;加入5 μl的Annexin V试剂(BD) 和5 μl的碘化丙锭(PI)(BD)(在室温下进行,上 机前添加PI)。轻柔混匀后避光室温下孵育15 min 后每管加入400 μl结合缓冲液,立即上流式细胞仪 分析,检测细胞凋亡。 1.2.6 流式细胞术检测Bcl-2、Bax凋亡蛋白表 达
取对数生长期的人肺腺癌A549细胞,用0.25% 胰酶消化,吹打均匀,制备成1×106个/毫升细胞悬 液,置于100 ml的培养瓶中培养,加入芝麻素40 μg/ml,另设立对照组(不加药物),放入CO2恒 温细胞培养箱,继续培养48 h后,收集细胞悬液, 按以下步骤进行:将待测细胞的培养液用移液器 吸入到15 ml试管中,用冷PBS洗涤两次,PBS洗 液亦收集到试管中。加胰酶消化;用收集的弃液 和PBS洗涤液终止消化,混匀分别收入到各自的 离心管中;300 r/min离心5 min弃上清液;冷PBS(1~2)ml洗涤2次,300 r/min离心5 min弃上清 液;收集各组待检细胞,加入冷PBS (1~2)ml, 轻柔混匀;300 r/min离心5 min,弃上清液;加入 1 ml 1×的细胞通透液(按说明书细胞通透液1:9稀 释)。室温孵育10 min;500 r/min离心5 min,倒 掉上清液;加入特异性包内荧光抗体:对照管加 IgG1 FITC(20 ul)或IgG1 PE(20 μl),检测管加Bcl-2 FITC 20 μl(BD)或bax PE20 ul(BD),轻柔震 荡;室温避光孵育30 min;加入2 ml的PBS缓冲 液,轻柔震荡混匀;500 r/min离心5 min,倒掉上 清液;加入0.5 ml PBS,混悬,以流式细胞术检测 Bcl-2、Bax凋亡蛋白表达。 1.2.7 免疫细胞化学染色
细胞爬片参考体外细 胞培养方法中的爬片方法,实验操作按照SABC试 剂盒即Caspase3、8、9试剂盒(武汉博士德)的 说明,参照实验程序,略加修改。光学显微镜下 观察,并拍照记录。结果判断:细胞内观察到清 晰的棕色颗粒为阳性细胞。Caspase在细胞质中呈 现黄色颗粒为阳性表达,以细胞轻微着色或未着 色判定为阴性,每张爬片在显微镜下用10×40放大 倍率观察10个视野,每个视野中,分别计算出阳 性细胞数和细胞总数,并计算细胞阳性表达率。 细胞阳性表达率(%)=阳性细胞数/细胞总数× 100%,免疫组织化学染色中,以已知阳性物质的 肺癌组织切片为阳性对照,以PBS缓冲液代替单抗 工作液为阴性对照。 1.3 统计学方法
应用SPSS17.0统计软件进行统计学分析,数 据资料以均数±标准差表示,各组之间均数比较采 用t检验,以P<0.05为差异具有统计学意义。 2 结果 2.1 MTT检测细胞生长增殖情况
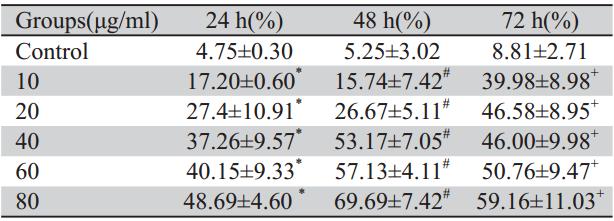
MTT结果显示芝麻素10、20、40、60、80 μg/ml分别对肺癌A549细胞均有抑制作用,随时 间延长而逐渐增强,组间比较差异有统计学意义 (P<0.01),见表1。我们以接近半数抑制浓度 (IC50)为参考,观察不同浓度的药物对肺腺癌 A549细胞的抑制作用,48 h结果显示芝麻素40 μg/ ml组较对照组,抑制率明显(P<0.01),最接近 IC50。
|
|
表1 MTT法检测各组药物不同时间段的细胞抑制率 Table 1 MTT detected cell growth inhibiting rate of each groups in different time periods |
倒置显微镜见对照组细胞形态为多角形或梭 形,细胞密集,贴壁牢固,细胞间距小,细胞体 积大,细胞膜完整;胞质丰富且分布均匀,饱满而 透亮,可见核分裂相;芝麻素作用24 h组,细胞间 距变大,细胞数量较对照组有所减少,体积略缩 小,胞质凝缩,折光率增强,细胞膜完整,贴壁牢 固,部分癌细胞呈逐渐变圆趋势,可见部分凋亡细 胞;芝麻素作用48 h组,细胞数明显减少,细胞稀 疏,细胞凋亡明显,细胞间隙变大;芝麻素作用 72 h组,细胞数量明显减少,凋亡增多,细胞数量 明显减少,细胞轮廓增强,变圆的细胞数量更加增 多,贴壁细胞很少,视野中细胞凋亡增加。 2.3 HE染色情况
HE染色形态学观察对照组细胞形态呈不规则 多角形,细胞排列致密,细胞间空隙少,胞质丰 富,细胞核染色明显,细胞核中可见多个核仁, 核分裂相多见;芝麻素作用24 h组细胞形态不规 则,细胞排列较疏松,视野中可见部分凋亡细 胞;芝麻素作用48 h组肿瘤细胞表现为核浓缩,胞 质浓缩减少,体积缩小,呈圆形或不规则形,核 染色质浓缩或染色质块形成,染色体被染成深蓝 色,视野中可见凋亡细胞;芝麻素作用72 h组可见 细胞排列疏松,胞质浓缩,变圆的细胞较对照组 更多,视野中可见较多的凋亡细胞,见图1。
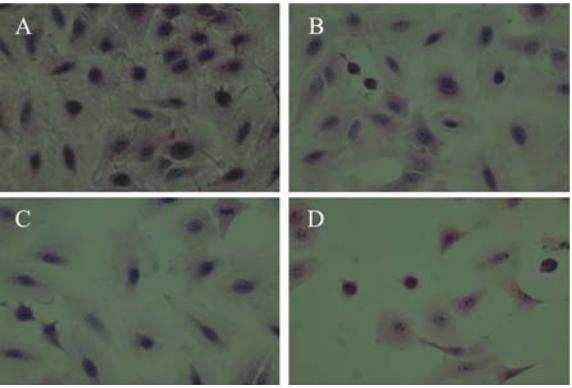 | 图1 对照组人肺腺癌A549细胞和40 μg/ml芝麻素作用不同 时间的细胞形态 Figure 1 The cellular morphology of human lung adenocarcinoma cell line A549 and different time after 40μg/ml sesamin treatmentA:control group;B:24 h after 40 μg/ml sesamin treatment;C:48 h after 40 μg/ml sesamin treatment;D:72 h after 40 μg/ml sesamin treatment |
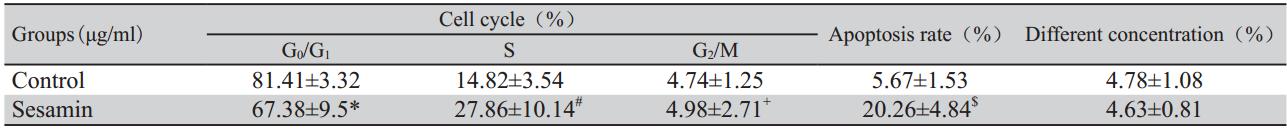
40 μg/ml芝麻素作用于肺腺癌A549细胞48 h 后,与对照组相比,其细胞分布周期发生了明显 变化,表现在G期细胞明显减少,多数细胞阻滞在 S期,见表2。由于采用特殊的设门技术,细胞周 期中并没有出现典型的亚二倍体峰,即凋亡峰。
|
|
表2各浓度芝麻素作用A549细胞48小时细胞周期、凋亡率及变异系数变化 Table 2 The rate of cell cycle and apoptosis and coefficient of variation in human lung adenocarcinoma cell line A-549 of 48h after different concentration sesamin treatment |
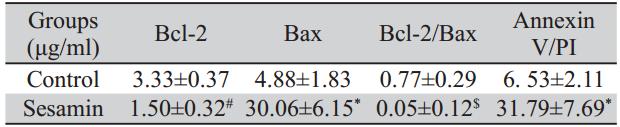
Annexin V/PI检测细胞早期凋亡结果和对照组 相比,芝麻素干预组凋亡明显,与对照组相比, 有显著差异,见图2和表3。流式细胞仪检测凋亡 蛋白Bcl-2及Bax结果示与对照组相比较,芝麻素 干预后,Bcl-2蛋白的表达降低,而Bax蛋白的表达升高,Bcl-2/Bax比值降低,与对照组相比,差 异有统计学意义,见图3、4和表3。
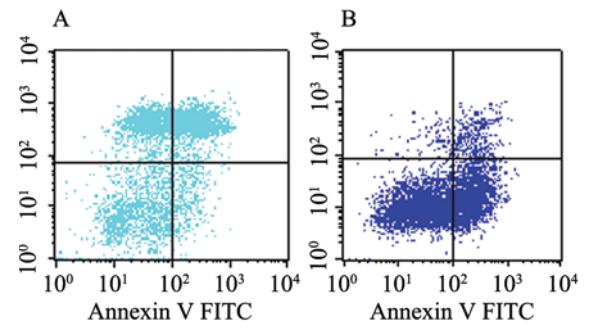 | 图2 Annexin V/PI检测细胞凋亡Figure 2 Cell apoptosis detected by Annexin V/PI stainingA: control group; B:experiment group |
|
|
表3 检测芝麻素干预组细胞抑制率(%) Table 3 Inhibitory rates to cells were detected in sesamin treatment(%) |
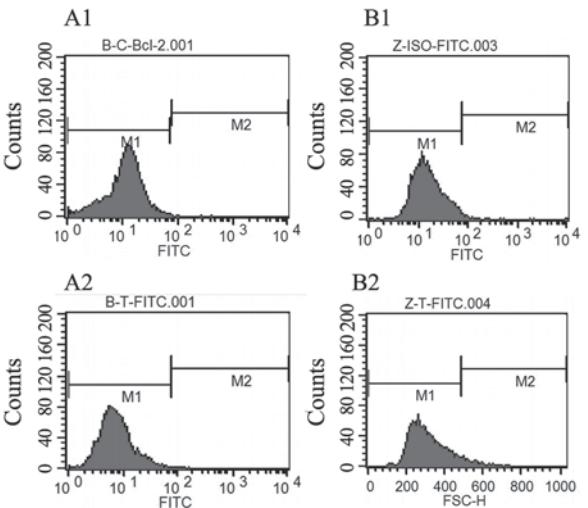 | 图3 流式细胞仪检测凋亡蛋白Bcl-2表达Figure 3 Bcl-2 expression detected by flow cytometryA1,A2: control group; B1,B2:experiment group |
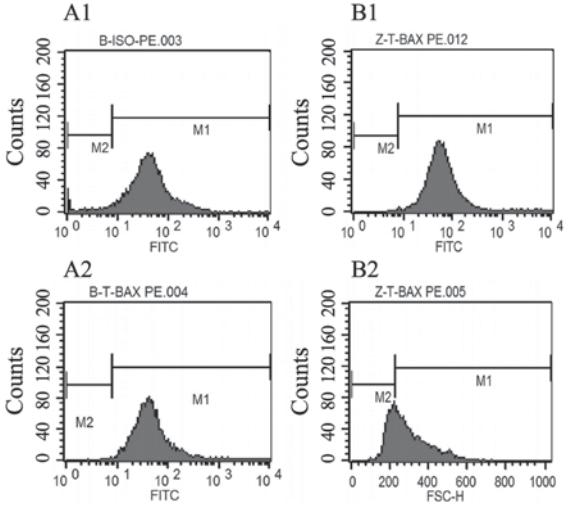 | 图4 流式细胞仪检测凋亡蛋白Bax表达Figure 4 Bax expression detected by flow cytometryA1,A2: control group; B1,B2:experiment group |
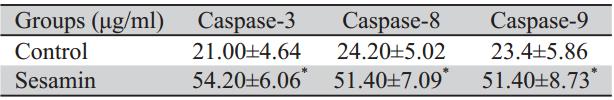
经免疫细胞化学染色后,在光学显微镜下观 察,和对照组相比,芝麻素干预组较发生显著改 变,表达增高。与对照组相比,有明显的差异, 见图5~7、表4。
 | A:control group;B:24 h after 40 μg/ml sesamin treatment 图5 对照组人肺腺癌A549细胞和40 μg/ml芝麻素作用48 h Caspase-3的表达(SABC法 ×400) Figure 5 The expression of Caspase-3 in human lung adenocarcinoma cell line A549 and 24 h after 40 μg/ml sesamin treatment(SABC ×400) |
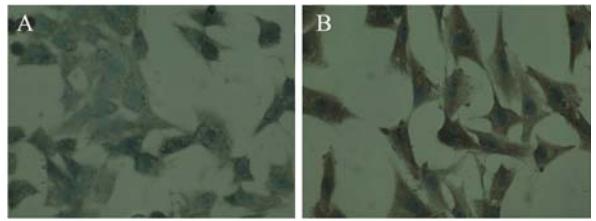 |
A:control group;B:24 h after 40 μg/ml sesamin treatment 图6 对照组人肺腺癌A549细胞和40 μg/ml芝麻素作用48 h Caspase-8的表达(SABC法 ×400)Figure 6 The expression of Caspase-8 in human lung adenocarcinoma cell line A549 and 24 h after 40 μg/ml sesamin treatment(SABC ×400) |
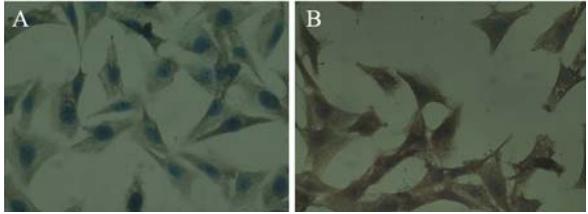 |
A:control group;B:24 h after 40 μg/ml sesamin treatment 图7 对照组人肺腺癌A549细胞和40 μg/ml芝麻素作用48 h Caspase-9的表达(SABC法 ×400)Figure 7 The expression of Caspase-9 in human lung adenocarcinoma cell line A549 and 24 h after 40 μg/ml sesamin treatment(SABC ×400) |
|
|
表4 芝麻素作用48 h后Caspase-3、Caspase-8、Caspase-9表达(%) Table 4 Expression of Caspase-3,8,9 in 48 h after sesamin treatment(%) |
细胞凋亡是在一定的生理或病理条件下主动 的遵循自身程序结束其生命的过程[5],故又称为程 序性死亡(programmed cell death,PCD)。近年来研究发现,各种抗癌药物引发细胞死亡的主要方 式是促进肿瘤细胞的凋亡,通过对细胞凋亡的相 关研究,为肿瘤治疗提供了新的思路及靶点,诱 导肿瘤细胞凋亡成为肿瘤治疗的一条新途径[6]。文 献表明[7],肿瘤治疗机制之一可能是在肿瘤细胞中 诱导凋亡,而各种细胞凋亡阈值的不同造成了治 疗效果的不同。凋亡诱导剂己经应用于肿瘤的治 疗,并且展示了其广阔而乐观的应用前景[8]。国 内外学者已相继证实芝麻素对人类淋巴样白血病 Molt4B细胞[9]、胃癌KATOⅢ细胞[10]、小鼠肝癌Ⅱ 22细胞[11]及S180肿瘤细胞[12]均具有增殖抑制生长 作用。凋亡诱导作用是常规抗肿瘤治疗包括放射 线和化疗药物发挥作用的一个主要途径。
本实验中,采用MTT法测得芝麻素对肺腺癌 A549细胞有很好的抑制作用,我们以接近半数抑 制浓度(IC50)为参考,采用相同条件下检测芝麻 素来观察对肺腺癌A549细胞的抑制作用,结果显 示,48 h芝麻素的IC50为40 μg/ml,芝麻素对肺腺 癌A549的最大抑制率为71.06%。利用倒置显微镜 及HE染色观察到,随着药物浓度的增加细胞凋亡 特征性形态逐渐明显,提示芝麻素具有抑制肿瘤 细胞增殖及诱导凋亡作用。
本实验经流式细胞术分析结果显示,芝麻素 对人肺腺癌细胞有凋亡诱导效应,同时,肺腺癌 细胞周期产生了影响,细胞周期结果分析显示, 芝麻素处理过的细胞大部分阻滞在S期,考虑芝麻 素抑制了A549细胞的分裂,并通过启动凋亡机制 阻止肿瘤细胞恶性增殖。
Annexin V-FITC与PI双染荧光标记法是区别早 期凋亡和晚期凋亡的较可靠的常用方法之一。在 肿瘤的基础与临床研究中,Annexin V-FITC与PI 双染荧光标记可以协同MTT检测细胞凋亡情况, 便于上市的药物或化合物的药理和毒理分析、新 的抗肿瘤药物的筛选、抗肿瘤药物IC50剂量确定、 抗肿瘤药物干预或联合干预的疗效评判以及新的 诱导肿瘤细胞凋亡机制研究等。实验显示:芝麻 素干预组出现早期凋亡细胞。提示芝麻素在早期 就具有抑制细胞增殖和诱导细胞凋亡作用,推测 芝麻素参与肿瘤细胞脂质代谢,改变A549细胞膜 双层脂质镶嵌模型的完整性与通透性,导致细胞 膜及线粒体膜上Ca2+泵的活性异常,致使细胞内 Ca2+增多(钙超载)、线粒体内Ca2+减少,从而激活线粒体凋亡途径及细胞内ROS水平表达,引起氧化应激反应,诱导细胞凋亡。
细胞凋亡的实现主要通过两种通路,即内源 性通路和外源性通路,均最终导致Caspase-3的 活化,切割底物产生凋亡效应。本实验采用免 疫组织化学法以及流式细胞术对凋亡相关蛋白 Caspase-3、Caspase-8、Caspase-9以及Bcl-2/Bax 蛋白进行检测。结果显示芝麻素作用肺腺癌A549 细胞48 h后Caspase-8、Caspase-9和Caspase-3活 性与阴性对照组比较均显著增高,芝麻素可能对 细胞凋亡的内源性通路有上调的作用,芝麻素 诱导肿瘤细胞凋亡可能与其激活了Caspase-3、 Caspase-8和Caspase-9有关。Bcl-2/Bax是Bcl-2家 族两个具有代表性的重要成员,凋亡通路受到抑 制时会有Bcl-2过度表达,而Bax的过度表达时使 Caspase-9活化并引发Caspase的级联反应,进而 下游的Caspase-3的激活促进线粒体通路诱导细胞 凋亡[13]。本实验中,实验组Bcl-2阳性表达率明 显下降(P<0.01),而Bax阳性表达率明显升高 (P<0.01),结合线粒体通路的凋亡机制,考虑 芝麻素诱导凋亡可能是通过抑制信号转导通路上 的关键酶来实现的,通过下调Bcl-2和上调Bax影 响细胞凋亡的线粒体通路;Bcl-2/Bax比值降低 (P<0.01),芝麻素可能通过改变Bcl-2和Bax的平 衡,诱导Bax表达,从而抑制Bcl-2表达,进而诱导 A549细胞凋亡,这可能是芝麻素抗肿瘤作用的机 制之一。
综上所述,芝麻素可使人肺癌A549细胞株细 胞在细胞增殖周期的静止期聚集,从而干扰细胞 周期的进程抑制肿瘤细胞的增殖生长。芝麻素诱 导凋亡机制可能是通过下调bcl-2,上调Bax蛋白 的表达,Bcl-2/Bax比值降低,激活了Caspase-3、 Caspase-8和Caspase-9,从而影响凋亡通路实现。 根据实验结果,可初步判断芝麻素对人肺癌A549 细胞株的细胞周期及凋亡通路有影响,其机制可能 是芝麻素作用于人肺癌A549细胞株的凋亡相关基 因调控来实现。这些结果显示芝麻素在临床治疗肺 癌或辅助治疗肺癌方面具有一定潜力,并为临床用 药的开发提供了实验依据。
| [1] | Zhang XR,Zhang C,Wang XY,et al.Effects of LAAO on proliferation and apoptosis of human lung cancer cell A549[J].Zhongguo Yao Fang, 2011,22(25):2325-7.[张小润,张程,王晓宇,等. L-氨基酸氧化酶对人肺腺癌A549细胞增殖、凋亡的影响研究[J]. 中国药房, 2011,22(25):2325-7.] |
| [2] | Mitsuo Namiki.The chemistry and physiological functions of sesame[J].Food Rev Intern,1995,211:281-329. |
| [3] | Tang CH,Peng ZY. Survey on studies of sesame lignun “sesame” [J].Liang Shi Yu You Zhi,2000,6:37-39.[唐传核, 彭志英. 芝麻木酚素“芝麻素”研究概况[J].粮食与油脂,2000,6:37-9.] |
| [4] | Shen XL. Nutritive ingredients and health value of sesame[J].Zhongguo Shi Wu Yu Ying Yang,2006,7:51-2.[沈旭丽.芝麻的营养成分及保健价值[J].中国食物与营养,2006,7: 51-2.] |
| [5] | Razavi HM, HamiltonJA, Feng Q. Modulationof apoptosis by nitric oxide: implications in myocardial ischemia and heart failure[J].Pharmacol Ther,2005, 106(2):147-62. |
| [6] | Koike K,Takaki A,Tatsukawa M,et al.Combination of 5-FU and IFNalpha enhances IFN signaling pathway and caspase-8 activity,resulting in marked apoptosis in hepatoma cell lines[J]. Int J Oncol,2006,29(5):1253-61. |
| [7] | CrightonD,KMRyan. Splicing DNA-damage responses to tumour cell death[J]. Biochim Biophys Acta,2004,1705(l):3-15. |
| [8] | Sun C L,Yang W G,Li H X,et al.The anti-cancer effect carboxy- methyiglucanin vitro[J].Zhongguo Sheng Hua Yao Wu Za Zhi,2006,27(3):153-5.[羧甲基葡聚糖体外抗肿瘤作用的研究[J].中国生化药物杂志,2006,27(3):153-5.] |
| [9] | MiyaharaY,Komiya T,Katsuzaki H,et al.Sesamin and episesamin induce apoptosis in human lymphoid leukemia Molt 4B cells[J].Int J Mol Med,2000,6(1):43-6. |
| [10] | Hibasami H, Fujikawa T, Takeda H,et al. Induction of apoptosis by Acanthopanax senticosus HARMS and its component,ssamin in human stomach cancer KATO Ⅲcell[J]. Oncol Rep, 2000, 7(6): 1213-6. |
| [11] | Wei YJ,Bian HL,Yu WJ,et al.Effect of Sesamin on liver cancer H22 cells proliferation and influence of tumor growth H22 mice a tumorburdened [J].Zhong Cao Yao,2008,39(8):1222-4.[魏艳静,卞红磊,余文静,等.芝麻素对肝癌H22细胞增殖及H22荷瘤小鼠肿瘤生长的影响[J].中草药,2008,39(8):1222-4.] |
| [12] | Bian HL.Effect of sesamin on immune function and proliferating cell nuclear antigen in S180 sarcoma-bearing mice[J].Zhongguo Xian Dai Yi Xue Za Zhi,2008,18(23):3411-3.[卞红磊.芝麻素对S180荷瘤小鼠免疫功能及对增殖细胞核抗原表达的影响[J].中国现代医学杂志,2008,18(23):3411-3.] |
| [13] | Li TF,Luo YM,Lv CZ. Cell apoptosis and the mechanism of Caspase regulation [J].ZhongguoLin Chuang Shen Jing Ke Xue,2003,11(3):313-5.[李天富,罗玉敏,吕传真. 细胞凋亡与Caspase机制调控[J].中国临床神经科学,2003,11(3):313-5.] |
 2014, Vol.41
2014, Vol.41