原发性肝细胞肝癌(以下简称肝癌)是世界 范围内常见的恶性肿瘤之一,每年全世界新增约 63万例肝癌患者,死亡人数约60万人,确诊的患 者大多在一年内死亡[1,2]。如何安全有效地治疗肝 癌,成为该研究领域关注的热点。随着人们对肝 癌发病机制的深入认识和基因治疗技术的逐步成 熟,肝癌的基因治疗有望成为新的治疗方法[3]。 目前,人们已经从分子生物学水平对其进行了大 量研究,如相关癌基因的激活、抑癌基因的失活 等。Foxp1(forkhead box p1)基因是新近发现的 一种转录因子,属于FOX家族的P亚族,该家族是 一个庞大的转录因子家族,功能广泛,涉及胚胎 的正常发育、细胞凋亡和细胞周期、糖类和脂类 代谢、生物老化、免疫调节等多种生物学过程[4], 并且在多种肿瘤中均有表达[5],其蛋白产物在不同 的肿瘤中具有不同的生物学作用[6,7,8,9]。
RNAi现象是生物体内双链RNA(double stranded RNA,dsRNA)在Dicer酶的作用下特异性 地被裂解为21~23 nt的dsRNA,即干扰性小RNA (small interfering RNA或short interfering RNAs, siRNA),进而形成沉默复合体(RNA-induced silencing complex,RISC)诱导同源靶基因mRNA 发生特异性降解,从而导致基因沉默[10]。但是 siRNA引起的基因沉默必须在靶细胞内实现,哺乳 动物细胞不接受裸露的、没有细胞穿透能力(不 管是否经过化学修饰)的siRNA序列。所以如何将 siRNA序列转入细胞内引起特异序列的基因沉默是 细胞执行siRNA的关键。由反转录病毒构建的慢 病毒载体为不含致病基因、无复制能力,但能感 染几乎所有体细胞[11,12],所以本文拟通过构建具有 三质粒分装系统的慢病毒载体将体外合成的干扰 Foxp1功能的核酸片段(siRNA Foxp1)感染高表 达Foxp1的肝癌细胞,通过检测细胞内Foxp1表达 水平来评估慢病毒载体的功能,并探讨Foxp1对癌 细胞增殖、凋亡和迁移的影响。
1 材料和方法 1.1 细胞株和试剂
四株肝癌细胞株(7721、7402、97H、 HepG2)、感受态大肠杆菌(TOP10)、人肾胚细 胞(293T)、慢病毒三质粒(pLL3.7、pMD2.G、 psPAX2)均购于百奥迈科生物技术有限公司。 DMEM培养液、胎牛血清、脂质体Lipofectamine 2000、Trizol试剂均购自美国Invitrogen公司。 PVDF膜购自美国Pharrnacai公司。人抗鼠Foxp1抗 体、β-actin 抗体和HRP偶联的二抗均购于美国 Santa Cruz公司。
1.2 方法 1.2.1 筛选高表达Foxp1 mRNA的肿瘤细胞
将四株肝癌细胞分别置于含10%胎牛血清 的DMEM培养液中,于37℃、5%CO2培养箱内 培养。分别采用TRIzol试剂盒提取四种细胞的总 RNA,反转录成cDNA,其步骤如下:RNA 4 μl、 oligo dT 1 μl、dNTP 1.5 μl,70℃5 min,立即 置冰上5 min;5×M-MLV反转录酶Buffer 9 μl、 M-MLV反转录酶0.3 μl、Rnase InHibiter 1 μl、 DEPC H2O 9.5 μl,42℃60 min,95℃30 s。实时 荧光定量PCR(real time Q-PCR,RT- QPCR)检 测四种细胞中Foxp1 mRNA表达水平,反应体系 为:cDNA 1 μl、2×QPCR master mix 12.5 μl、引 物F 0.5 μl、H2O 9.5 μl 。Foxp1引物(序列为F: 5’ -TCAGAGATTACGAAGATGAATTCAAGAGAT TCATCTTCGTAATCTCTGTTTTTTC-3’,55 bp; R:5’-TCGAGGAAAAAACAGAGATTACG AA GATGAATCTCTTGAATTCATCTTCGTAATCTCT GA-3’,60 bp),GAPDH为内参(序列为F:5’- GAAGGTGAAGGTCGGAGTC-3’,19 bp;R:5’- GAAGATGGTGATGGGATTTC-3’,20 bp)均由百 奥迈科生物技术有限公司合成。反应条件:95℃ 预变性3 min后,95℃变性45 s,60℃退火45 s, 72℃延伸30 s,共35个循环,72℃再延伸7 min。 收集RT- QPCR反应荧光信号,进一步做产物熔解 曲线分析,检测qPCR产物的特异性。qPCR数据用 2 -ΔΔCt法进行分析[13],用7721细胞做均一化,得到 目的基因Foxp1在不同细胞中的相对表达量。筛选 高表达Foxp1 mRNA的癌细胞用于后续实验研究。
1.2.2 靶向Foxp1 mRNA的siRNA序列筛选
设计分别靶向Foxp1基因823、1 015和2 516碱 基位的三对siRNA序列,见表 1。进行序列比对 (BLAST),确定与人类其他基因组没有同源 性,并注意了G/C的百分比为50%以上,避免选取 高G含量或连续G区段。三条siRNA序列均由百奥 迈科生物技术有限公司协助合成。将高表达Foxp1 的癌细胞接种于24孔培养板中进行培养,当细胞 生长融合达到80%时参照Lipofectamine 2000转染 试剂操作说明将上述三对siRNA靶序列分别转染培 养细胞。转染后48 h提取总RNA,RT-QPCR检测 Foxp1 mRNA表达水平,GAPDH (Glycoraldelyde-3-phosphate dehydrogenase)为内参。反应条件同 上。筛选较高抑制能力的siRNA序列用于构建靶向 Foxp1的siRNA慢病毒载体。
|
|
表 1 靶向Foxp1基因823、1 105和2 516碱基位的siRNA序列 Table 1 siRNA sequences of targeted Foxp1-823, 1 015 and 2 516 |
1.2.3 构建靶向Foxp1的siRNA慢病毒载体
将带有绿色荧光蛋白(green fluorescence protein,GFP)有利于细胞转染后跟踪观察的质粒 pLL3.7由内切酶Hpa Ⅰ、Xho Ⅰ进行双酶切后,用 DNA连接酶将体外合成的具有较高特异性siRNA Foxp1序列插入到慢病毒的转移质粒中连接成环 状,构建pLL3.7- siRNA Foxp1重组质粒,见表 2。 转化感受态大肠杆菌TOP10,在LB琼脂平板上培 养后,挑取白色单菌落,用特异引物进行PCR扩 增,反应条件同上。以重组成功的pLL3.7质粒作 为对照标准样品。电泳检测扩增产物送上海美吉 生物医药科技有限公司测序,验证其准确性。
|
|
表 2 构建慢病毒载体的核酸序列 Table 2 Nucleotide sequence of the recombinant lentiviral vector |
病毒颗粒的复制由三质粒系统转染人胚肾293T 细胞产生。将新制备的含有Foxp1-siRNA序列pLL3.7 重组质粒和另外两个质粒pMD2.G、psPAX2,按 如 下比例:20 μg pLL3.7-Foxp1,12 μg psPAX2和5 μg pMD2.G溶于转染试剂(Gibco-BRL,Gaithersburg, MD)室温静置30 min组成慢病毒三质粒系统,待 293T细胞生长融合达到50%时轻轻加入慢病毒三 质粒系统。4~6 h后换新鲜培养液,72 h后收集, 低速离心(800 r/min,5 min)去杂质,1 ml磷酸 盐缓冲液重悬沉淀物,储存于-80℃。用RNA抽 提试剂盒提取培养液样品中病毒内的RNA,再反 转录成cDNA与供参照的标准样品(重组成功的 pLL3.7质粒)同时进行RT-QPCR检测,反应体系 和反应条件同上,构建靶向Foxp1的siRNA慢病 毒载体(lenti-pLL3.7-Foxp1-siRNA)(MOI值为 20)。同时构建不含有Foxp1-siRNA序列的直接三 质粒系统包装的空病毒载体作为对照组,步骤同 前。
1.2.4 检测lenti-pLL3.7-Foxp1-siRNA感染细胞后Foxp1的表达
将高表达Foxp1的癌细胞以2×105/孔接种于6孔 培养板,培养24 h后加入lenti-pLL3.7-Foxp1-siRNA 继续培养,分别在24、48、72 h,荧光显微镜下 观察细胞中siRNA Foxq1序列的荧光信号。并在培 养72 h后,分别进行RT-QPCR检测Foxp1 mRNA表 达水平(反应条件同上)和Western blot检测细胞 中Foxp1蛋白的表达。Western blot采用常规方法操 作:细胞经lenti-pLL3.7-siRNA Foxp1处理48 h后提 取各组细胞蛋白,用胰蛋白酶消化细胞,PBS洗涤 一次,每孔细胞以15 μl PBS悬浮。改良Lowry法测 定蛋白浓度,调整平衡蛋白量。样品与2×SDS上 样缓冲液[0.1 mol/L Tris-HCl(pH6.8),4%SDS, 20%甘油,0.1%溴酚蓝,5%β-巯基乙醇]等体积 混合,95℃水浴5 min变性,每孔上样量为15 μg蛋 白,等量上样于10%聚丙烯酰胺凝胶电泳(SDSPAGE电泳)。电泳结束后,采用半干转印仪 (BIO-RAD公司)以15V恒压转印1 h,将凝胶中 蛋白质转移到PVDF膜上,用5%的脱脂牛奶封闭 后,加TBST稀释的鼠抗人Foxp1抗体(1400) 中,4℃孵育过夜;加经辣根过氧化物酶(HRP) 标记的羊抗鼠IgG抗体(11 000)室温反应2 h, 于暗室中显影,显色采用ECL化学发光剂(super signal west pieo chemiluminescent substrate,Cat NO34077,PIERCE)Kadak曝光显影。以β-actin作 为内参。
1.2.5 CCK-8法检测细胞增殖活力
将高表达Foxp1的癌细胞以5×103/孔接种于96孔 培养板,用含10%胎牛血清的DMEM基础培养液 孵育24 h后加入lenti-pLL3.7-Foxp1-siRNA,分别再 培养24、48、72 h后,每孔加入CCK-8溶液10 μl, 继续孵育1.5 h,选择450 nm波长,在酶标仪上测 定各孔吸光度值(OD值),记录结果,绘制细胞 生长曲线。
1.2.6 流式细胞仪检测细胞凋亡
在培养的高表达Foxp1的癌细胞中加入lentipLL3.7-Foxp1-siRNA后继续培养48 h,收集细胞, 0.01M PBS洗涤2次,加入500 μl结合缓冲液制成 细胞悬液,与5 μl Annexin V、5 μl PI(propidium iodide)共同孵育15 min,上机检测,CellQuest软 件进行分析。
1.2.7 检测细胞迁移能力
(1)检测细胞二维空间迁移的划痕愈合实 验:将高表达Foxp1的癌细胞以2×104/孔接种于 24孔培养板,培养24 h后加入lenti-pLL3.7-Foxp1-siRNA,继续培养48 h。待细胞融合后,用10 μl移 液器垂直培养板底部呈“一”字形划痕,镜下记录 划痕区相对距离,DMEM培养液洗涤后,用100 μl无抗DMEM FCS培养液继续培养。划痕后24、 48 h,倒置显微镜下观察细胞从划线处向外爬出 的数量与距离,随机选取5个视野(×40),用软 件(Image-ProPlus,version 4.5.1,美国)测量,计 算均值。(2)检测细胞三维空间迁移的细胞侵 袭小室实验:将高表达Foxp1的癌细胞以2×104/孔 接种于24孔培养板,培养24 h后加入lenti-pLL3.7-Foxp1-siRNA,继续培养72 h。2.5%胰酶消化后 重悬于不含血清的DMEM培养液中,细胞浓度为 1×106。将200 μl细胞悬液加于上室,下室为600 μl DMEM培养液(含10%胎牛血清),在37℃、 5%CO2条件下培养24 h。擦去膜上层细胞,取膜经 甲基紫染色后,镜下可见穿膜细胞呈紫色。每孔 随机计数5个视野,取其均值。
1.3 统计学方法
应用SPSS17.0统计软件包,数据表示用均数±
标准差( ±s),计数资料比较采用方差分析和t检
验。率的比较用卡方检验。P<0.05为差异有统计
学意义。
±s),计数资料比较采用方差分析和t检
验。率的比较用卡方检验。P<0.05为差异有统计
学意义。
2 结果 2.1 选择高表达Foxp1 mRNA的肝癌细胞
RT-QPCR检测四种不同的肝癌细胞中Foxp1 mRNA的结果显示:7721细胞中Foxp1 mRNA的表 达分别明显高于其他三株细胞7402、97H和HepG2 细胞的9倍、2.01倍和5.1倍,差异均有统计学意义 (P<0.05),见图 1。因此选用7721细胞作为高表 达Foxp1的细胞用于后续研究。
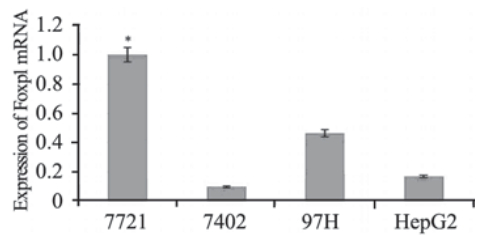 | 图 1 四种肝癌细胞中Foxp1 mRNA的表达(RT-QPCR)Figure 1 Expression of Foxp1 mRNA in the four different hepatoma carcinoma cells (RT-QPCR)*:compared with expression of Foxp1 mRNA in 7721 cells,which taken as 100%,P<0.05 |
2.2 选择有效的针对Foxp1的siRNA靶序列
设计针对Foxp1的三对siRNA靶序列被分别转 染入7721细胞,RT-QPCR检测细胞中Foxp1 mRNA 表达,与单纯转染脂质体组比较,Foxp1 mRNA 的沉默效率分别为Foxp1-823-siRNA:78.23%、 Foxp1-1015-siRNA: 55.7%和Foxp1-2516-siRNA: 54.29%,Foxp1-823-siRNA较其他两对siRNA具 有更高的抑制效率(P<0.05),而Foxp1-1015-siRNA和Foxp1-2516-siRNA的抑制效率差异无统计 学意义(P>0.05),见图 2。
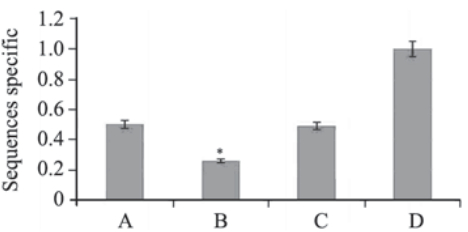 | 图 2 Foxp1 siRNA靶序列筛选结果(RT-QPCR)Figure 2 Screening of siRNA Foxp1 target sequences (RTQPCR)A:Foxp1-2516-siRNA; B: Foxp1-823-siRNA; C:Foxp1-1015-siRNA; D:lipo; *: Foxp1-823-siRNA compared with Foxp1-1015-siRNA and Foxp1-2516-siRNA respectively,P<0.05 |
2.3 Lenti-pLL3.7-Foxp1-siRNA的测序结果
测序结果证实插入序列完全正确,lentipLL3.7-Foxp1-siRNA构建成功。分别在lentipLL3.7-Foxp1-siRNA感染后24、48、72 h,荧光显 微镜下均可见绿色荧光信号,且信号强度随时间推 移逐渐增强,见图 3,表明细胞中持续表达siRNA。
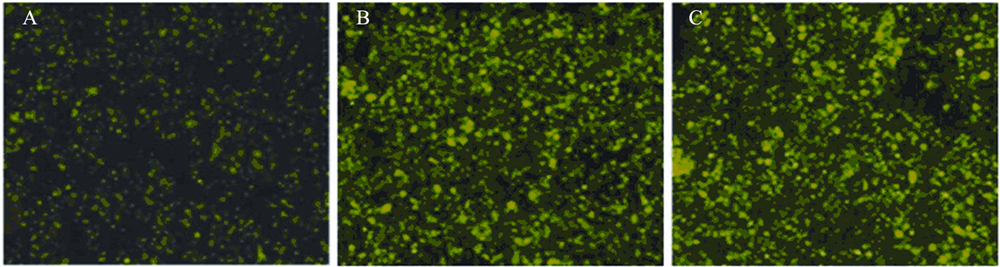 | 图 3 Lenti-pLL3.7-Foxp1-siRNA感染7721细胞后荧光显微镜下检测结果Figure 3 The result of infecting 7721 cells with lenti-pLL3.7-Foxp1-siRNA observed by fluorescence microcopyA:24 h;B:48 h;C:72 h |
2.4 Lenti-pLL3.7-Foxp1-siRNA下调7721细胞中Foxp1的表达
RT-QPCR和Western blot检测结果均显示7721 细胞感染lenti-pLL3.7-Foxp1-siRNA后,与空病毒 载体对照组比较,Foxp1 mRNA和蛋白表达均显著 减少(P<0.05),见图 4。
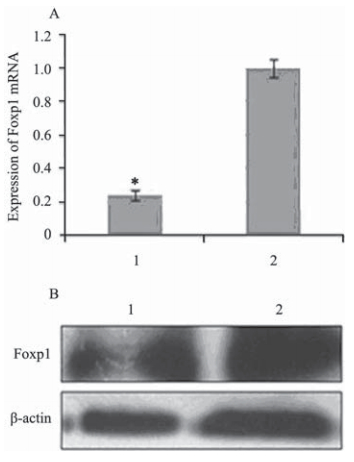 | 图 4 7721细胞感染lenti-pLL3.7-Foxp1-siRNA后Foxp1的 表达Figure 4 Expression of Foxp1 in 7721 cells infected with lenti-pLL3.7-Foxp1-siRNAA: Foxp1 mRNA level(RT-QPCR); B: Foxp1 protein level(Western blot); 1:Lenti-PLL3.7-Foxp1-siRNA;2: control: the empty viral vector; *:comparaed with the control of the empty viral vector,P<0.05 |
2.5 7721细胞感染lenti-pLL3.7-Foxp1-siRNA后增殖受抑
CCK-8法检测细胞增殖活力的生长曲线显示: 7721细胞感染lenti-pLL3.7-Foxp1-siRNA后48 h和 72 h,细胞增殖明显低于空病毒载体对照组,尤以 72 h明显(P<0.05),见图 5。
 | 图 5 7721细胞感染lenti-pLL3.7-Foxp1-siRNA后的生长曲线Figure 5 Growth curve of 7721 cells infected with lentipLL3.7-Foxp1-siRNA for 24,48 and 72h |
2.6 7721细胞感染lenti-pLL3.7-Foxp1-siRNA后凋亡增加
流式细胞仪检测结果显示7721细胞感染lentipLL3.7-Foxp1-siRNA 48 h后,凋亡细胞的比例明 显增加,与空病毒载体对照组比较差异有统计学 意义(P<0.05),见图 6。
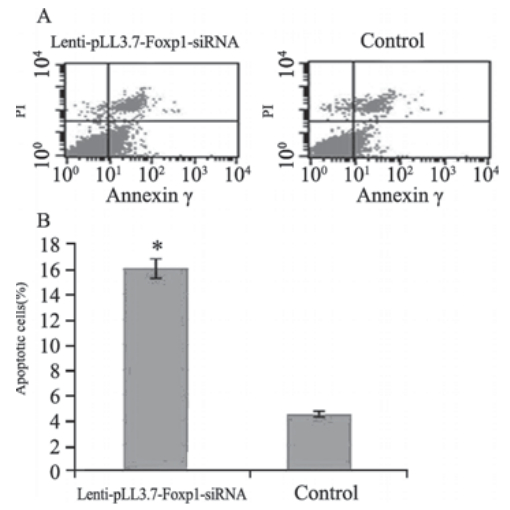 | 图 6 7721细胞感染lenti-pLL3.7-Foxp1-siRNA后48h凋亡增加Figure 6 Increased apoptosis of 7721 cells infected with lenti-pLL3.7-Foxp1-siRNA for 48hA: after been stained by Annexin V-FITC and propidium iodide(PI),the normal live cells were not stained(lower left); the apoptosis cells at early stage were only stained by Annexin V-FITC and the PI staining was negative(lower right),such cells in lenti-pLL3.7-Foxp1-siRNA group were significantly more than those in control group; the necrotic cells and apoptotic cells at later staged could be stained both by Annexin V-FITC and PI(upper right). The detection error within tolerance range was showed in upper left; B: the histogram of apoptosis comparing of two groups; *: comparaed with control of the empty viral vector,P<0.05 |
2.7 7721细胞感染lenti-pLL3.7-Foxp1-siRNA后迁移能力下降
检测划痕愈合实验和细胞侵袭小室实验结果 均显示:细胞感染lenti-pLL3.7-Foxp1-siRNA后细 胞二维空间迁移水平在24和48 h均明显低于空病 毒载体对照组(均P<0.05),见图 7A。感染48 h 后细胞的三维空间迁移能力也受到明显抑制,穿 膜细胞均数(38.49±6.17)较空病毒载体对照组 (124.61±15.22)明显减少(P<0.05),见图 7B。
 | 图 7 7721细胞感染lenti-pLL3.7-Foxp1-siRNA后的细胞迁移情况Figure 7 Migration of 7721 cells infected with lenti-pLL3.7-Foxp1-siRNAA: Wound healing assay; B: Transwell assay; a: penetrating cells observed by microscopy; b: counting statistics of penetrating cells; *: compared with control of the empty viral vector,P<0.05 |
3 讨论
Foxp1基因位于染色体3p14.1,而3号染色体短 臂(3p)的杂合性缺失是很多恶性肿瘤常见的基 因事件[14,15]提示Foxp1可能是一个肿瘤抑制基因。 但又有许多肿瘤中Foxp1的过表达造成患者预后不 佳,如不同类型的淋巴瘤等,提示Foxp1可能具有 某种癌基因的作用[16]。Datta等[17]研究表明:Foxp1 是microRNA-1(miR-1)基因的作用靶点之一;在 人原发性肝癌中miR-1的表达显著下调,使其靶向 抑制Foxp1的能力下降,导致Foxp1过表达,并与 癌恶性生物学行为有关。当miR-1的表达水平升高 时,通过诱导细胞凋亡和抑制细胞周期进程可以 使肝癌细胞的生长受到明显抑制,而此时Foxp1的 表达是减少的。因此,作者推断Foxp1可能参与了 肝癌的发生。
本研究发现不同的肝癌细胞中均有Foxp1的 表达,但表达水平不一,其机制可能与癌不同的 生物学行为有关(另文研究)。本文选择高表达 Foxp1基因的7721肝癌细胞作为研究Foxp1功能的 细胞,通过下调Foxp1的表达进一步探讨该基因对 肝癌增殖、凋亡和迁移的影响。本文设计了针对 Foxp1的siRNA靶序列,尝试使用慢病毒载体介导 的RNAi技术来下调Foxp1的表达。
siRNA是由短dsRNA作用于同源RNA序列, 在细胞内核酸酶的作用下使得与dsRNA有同源 序列的mRNA降解,从而使目的基因的表达得到 抑制。该方法是抑制基因表达的有效工具,目前 已经成为研究基因功能以及进行基因治疗的新手 段。但实验室常用的方法利用脂质体等转染将 siRNA递达到细胞中发挥作用,但在体内研究表 明脂质体等载体对细胞存在较大毒性、转染效 率低、瞬时转染不能长期沉默基因等缺点,限制 了siRNA技术在体内的研究。基于人免疫缺陷病 毒(HIV-1)的慢病毒家族能够感染分裂及非分 裂细胞、转移基因片段容量大、目的基因表达时 间长、免疫反应小等优点,使慢病毒家族能成为 理想的基因转移载体[11,12]。正如本文构建不含有 Foxp1-siRNA序列的直接三质粒系统包装的慢病毒 载体对照组感染细胞后,因其为不含致病基因、 在细胞内无复制能力,未产生明显的细胞毒作 用,表明慢病毒载体对细胞是安全的。
本文构建的靶向Foxp1的siRNA慢病毒载体 (lenti-pLL3.7-Foxp1-siRNA)感染7721细胞24、 48、72 h,荧光显微镜下均可见绿色荧光信号, 且信号强度随时间推移逐渐增强,表明细胞中持 续表达siRNA,证明慢病毒载体能有效的将Foxp1-siRNA 递达到细胞中。RT-PCR和western blot检测 结果显示Foxp1 mRNA和蛋白的表达水平显著降 低,说明siRNA在细胞内发挥的降解Foxp1 mRNA 的作用,进而使Foxp1蛋白合成减少。肝癌细胞 感染lenti-pLL3.7-Foxp1-siRNA后能有效抑制其增 殖,促进其凋亡,同时抑制细胞迁移。研究结果 提示Foxp1作为一种多功能转录因子,可能参与肝 癌的演进,发挥癌基因的作用与肝癌细胞恶性生 物学行为有关。进一步研究Foxp1促进肝癌演进的 作用机制有可能为肝癌的发病学增添新的理论依 据,Foxp1基因有可能成为肝癌基因治疗的新靶 点,从而为肝癌的基因治疗提供新的思路。
| [1] | Yuen MF, Hou JL, Chutaputti A. Hepatocellular carcinoma in the Asia pacific region[J]. J Gastroenterol Hepatol,2009, 24(3): 346-53. |
| [2] | Amarapurkar D, Han KH, Chan HL, et al.Application of surveillance programs for hepatocellular carcinoma in the AsiaPacific Region[J]. J Gastroenterol Hepatol, 2009, 24(6): 955-61. |
| [3] | Mendizabal M, Reddy KR. Current management of hepatocellular carcinoma[J]. Med Clin North Am,2009, 93(4): 885-900. |
| [4] | Jepsen K, Gleiberman AS, Shi C, et al. Cooperative regulation in development by SMRT and FOXP1[J]. Genes Dev,2008, 22(6): 740-5. |
| [5] | Myatt SS, Lam EW. The emerging roles of Forkhead box (Fox) proteins in cancer[J]. Nat Rev Cancer, 2007, 7(11): 847-59. |
| [6] | Bates GJ, Fox SB, Han C, et al. Expression of the forkhead transcription factor FOXP1 is associated with that of estrogen receptor-beta in primary invasive breast carcinomas[J]. Breast Cancer Res Tteat, 2008, 111(3): 453-9. |
| [7] | Rayoo M, Yan M, Takano EA,et al.Expression of the forkhead box transcription factor FOXPl is associated with oestrogen receptor alpha, ocstrogen receptor beta and improved survival in familial breast cancer[J]. J Clin Pathol, 2009, 62(10): 896-902. |
| [8] | Takayama K, Horie-Inoue, Ikeda K, et al.FOXP1 is an androgenresponsive transcription factor that negatively regufates androgen receptor signaling in prostate cancer cells[J]. Biochem Biophys Res Commun, 2008, 374(2): 388-93. |
| [9] | Toma MI, Weber T, Meinhardt M,et al. Expression of the Forkhead transcription factor FOXP1 is associated with tumor grade and Ki67 expression in clear cell renal cell carcinoma[J]. Cancer Invest, 2011, 29(2): 123-9. |
| [10] | Chen L, Qin J, Zhu YY. The progress of RNA interference research in the field of medcine[J]. Yao Wu Sheng Wu Ji Shu, 2009,16(1): 83-9. [陈莉,秦婧,朱远源.在医药领域中RNA干扰研究进展[J]. 药物生物技术, 2009, 16(1): 83-9.] Cancer Invest, 2011, 29(2): 123-9 |
| [11] | Ding ZY, Liang HJ. Advance in RNAi mediated with lentivirusbased vectors[J].Yi Xue Yan Jiu Za Zhi, 2009, 38(4): 15-6. [丁震宇,梁后杰. 慢病毒载体介导RNAi的研究进展[J]. 医学研究杂志, 2009, 38(4): 15-6.] |
| [12] | Morris KV, Rossi JJ. Lentiviral-mediated delivery of siRNAs for antiviral therapy[J]. Gene Ther, 2006, 13(6): 553-8. |
| [13] | Livak KJ, Schmittgen TD. Analysis of relative gene expression data using real-time quantitative PCR and the 2(-Delta Delta C(T)) Method[J]. Methods, 2001, 25(4): 402-8. |
| [14] | Pariani MJ, Spencer A, Graham JM, et al. A 785kb deletion of 3p14.1p13, including the FOXPl gene, associated with speech delay, contractures, hypertonia and blepharophimosis[J]. Eur J Med Genet, 2009, 52(2-3): 123-7. |
| [15] | Taylor BS, Schultz N, Hieronymus H, et al. Integrative genomic profiling of human prostate cancer[J]. Cancer Cell, 2010, 18(1): 11-22. |
| [16] | Brown PJ, Ashe SL, Leich E, et al. Potentially oncogenie B-cell activation induced smaller isoforns of FOXP1 are highly expressed in the activated B cell like subtype of DLBCL[J]. Blood, 2008, 111(5): 2816-24. |
| [17] | Datta J, Kutay H, Nasser MW,et al. Methylation mediated silencing of MicroRNA-1 gene and its role in hepatocellular carcinogenesis[J]. Cancer Res, 2008, 68(13): 5049-58. |
 2014, Vol.41
2014, Vol.41




